Содержание
- 2. Осмос — самопроизвольный переход , растворителя через полупроницаемую мембрану, разделяющую растворитель или два раствора с различной
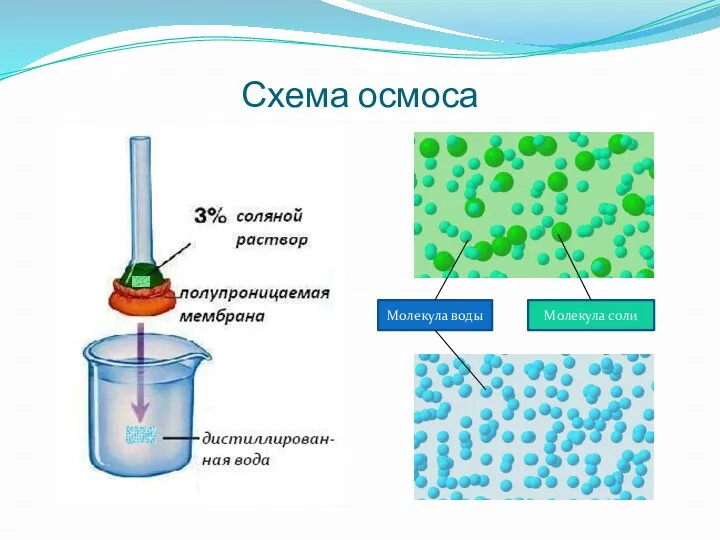
- 3. Схема осмоса Молекула воды Молекула соли
- 4. Схема осмоса Раствор прекращает подниматься, когда возникшее гидростатическое давление станет равным осмотическому давлению
- 5. Осмотическое давление –давление, которое растворенное вещество оказывает на полупроницаемую перегородку
- 6. Уравнение Вант-Гоффа πV=nRТ где π - осмотическое давление(π=cRT), c – молярная концентрация раствора, V- объем раствора,
- 7. Роль осмотического давления Осмотическое давление играет важную роль в процессах, происходя- происходящих в живых организмах и
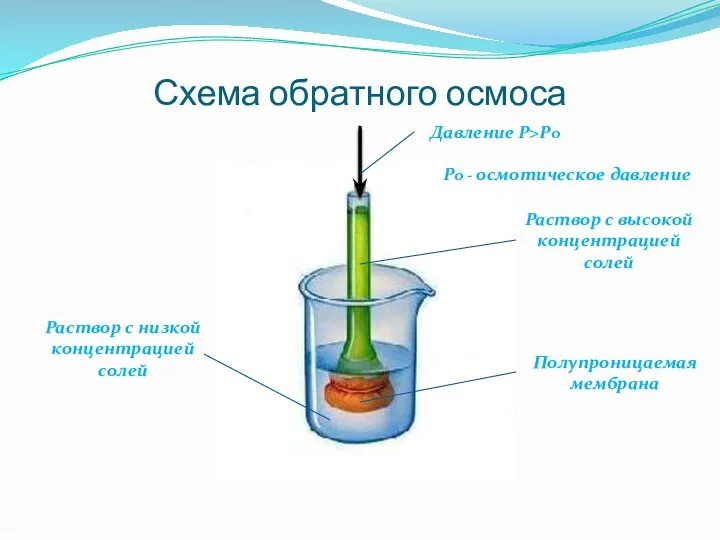
- 8. Обратный осмос - прохождение воды через мембрану из более концентрированного в менее концентрированный раствор в результате
- 9. Схема обратного осмоса Давление Р>Ро Раствор с высокой концентрацией солей Полупроницаемая мембрана Раствор с низкой концентрацией
- 10. Применение обратного осмоса
- 13. Скачать презентацию








 Термоэлектронная эмиссия. Контакт металл - вакуум
Термоэлектронная эмиссия. Контакт металл - вакуум Сила Ампера
Сила Ампера Приборы электромагнитной и электродинамической систем
Приборы электромагнитной и электродинамической систем Использование компьютерных технологий для оценки знаний учащихся. Диск
Использование компьютерных технологий для оценки знаний учащихся. Диск Линейные электрические цепи постоянного тока. (Лекция 1)
Линейные электрические цепи постоянного тока. (Лекция 1) Толқындық қозғалыс
Толқындық қозғалыс Определение ускорения тела при равноускоренном движении
Определение ускорения тела при равноускоренном движении презентация к 50 летию полета женщины в космос
презентация к 50 летию полета женщины в космос Формирование навыков технического конструирования при изучении простых механизмов как основ двигательных конструкций
Формирование навыков технического конструирования при изучении простых механизмов как основ двигательных конструкций Влажность воздуха.
Влажность воздуха. Физика и техника
Физика и техника Презентация Постоянные магниты к уроку 8 класс
Презентация Постоянные магниты к уроку 8 класс Обобщение и уточнение Ньютоном законов Кеплера
Обобщение и уточнение Ньютоном законов Кеплера Основы динамики вращательного движения
Основы динамики вращательного движения Оптика. Задачи
Оптика. Задачи Жарық дисперсиясы
Жарық дисперсиясы Сборка модели электролизера для получения водорода
Сборка модели электролизера для получения водорода Механические волны, их свойства
Механические волны, их свойства Электрические переходы
Электрические переходы Техника безопасности при проведении занятий в школьных мастерских
Техника безопасности при проведении занятий в школьных мастерских Multiple Choice Questions
Multiple Choice Questions Исследование методов расчета технологических потерь электроэнергии при ее передаче по электрическим сетям
Исследование методов расчета технологических потерь электроэнергии при ее передаче по электрическим сетям Реактивное движение. Ракеты
Реактивное движение. Ракеты Виды теплопередачи. Теплопроводность
Виды теплопередачи. Теплопроводность Солнечная энергетика
Солнечная энергетика Сила давления атмосферного воздуха, опыт бургомистра Магдебурга Отто фон Герике
Сила давления атмосферного воздуха, опыт бургомистра Магдебурга Отто фон Герике Виды телефонной связи
Виды телефонной связи Ультрафіолетове випромінювання
Ультрафіолетове випромінювання