Содержание
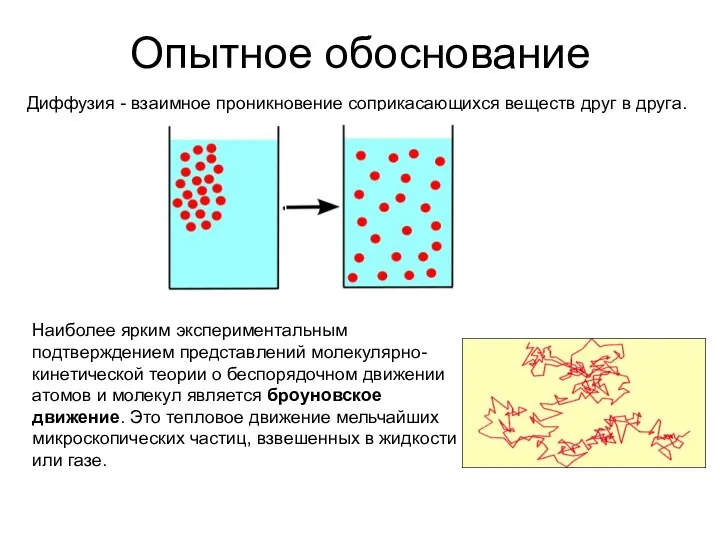
- 2. Опытное обоснование Диффузия - взаимное проникновение соприкасающихся веществ друг в друга. Наиболее ярким экспериментальным подтверждением представлений
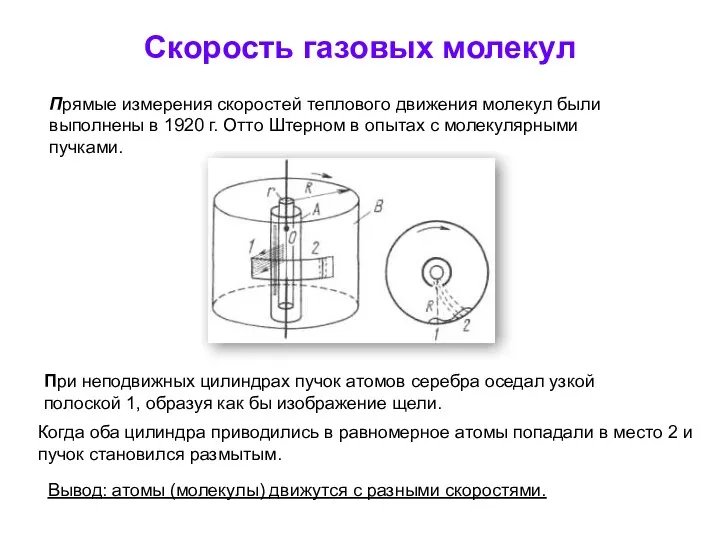
- 3. Скорость газовых молекул Прямые измерения скоростей теплового движения молекул были выполнены в 1920 г. Отто Штерном
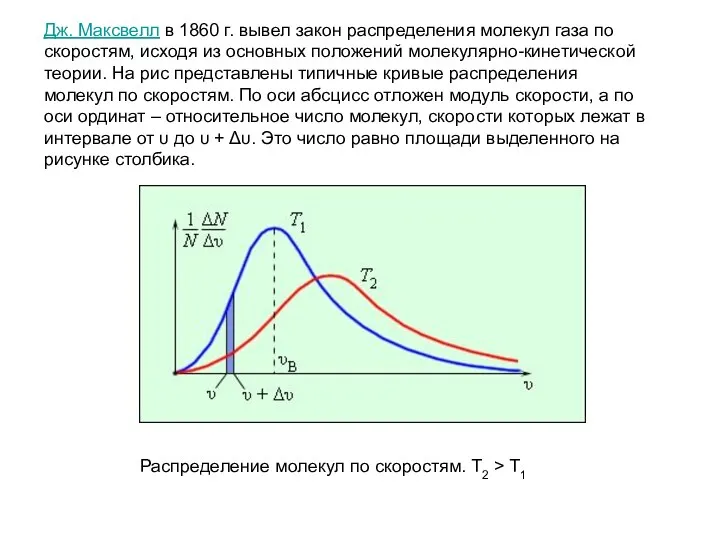
- 4. Дж. Максвелл в 1860 г. вывел закон распределения молекул газа по скоростям, исходя из основных положений
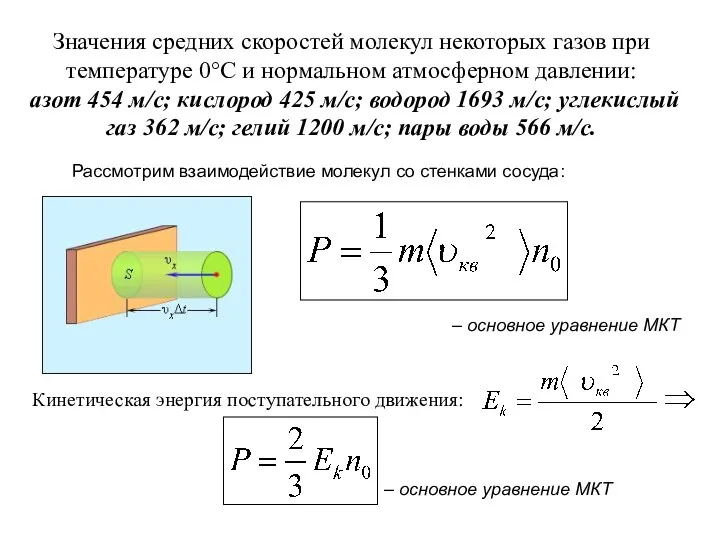
- 5. Значения средних скоростей молекул некоторых газов при температуре 0°С и нормальном атмосферном давлении: азот 454 м/с;
- 6. Уравнение состояния идеального газа Идеальным газом называется газ, между частицами которого отсутствуют силы взаимного притяжения. При
- 7. Термодинамические параметры системы: Температура – T(К) Давление – P(Па) Объем – V(м3) Уравнение состояния идеального газа
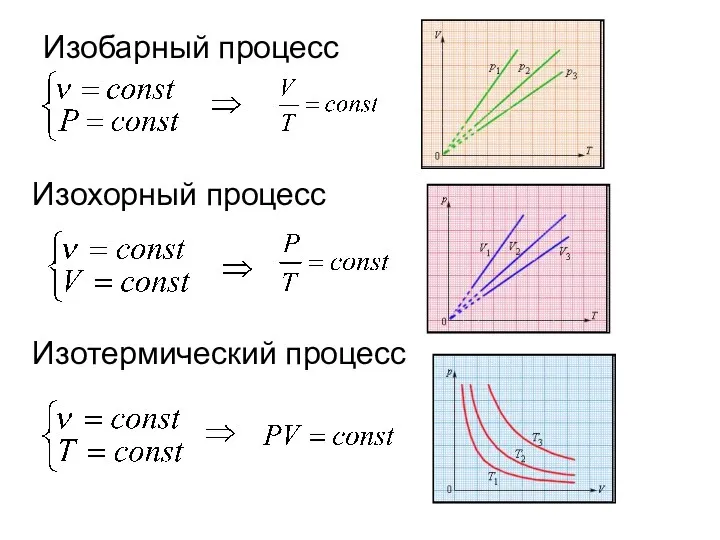
- 8. Изобарный процесс Изохорный процесс Изотермический процесс
- 9. Пример 1. Дано: Решение: При сжатии газа его объем уменьшился на 2 л, а давление увеличилось
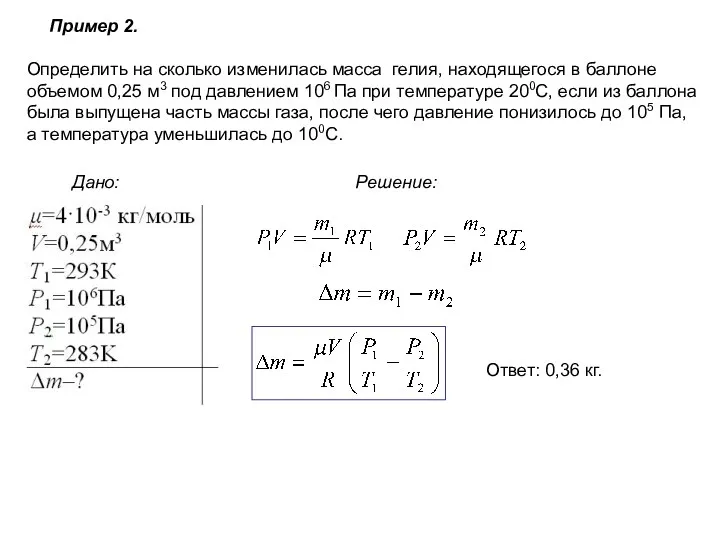
- 10. Пример 2. Дано: Решение: Определить на сколько изменилась масса гелия, находящегося в баллоне объемом 0,25 м3
- 11. Пример 3. Определить объем баллона со сжатым углекислым газом, находящимся под давлением в 100 атмосфер при
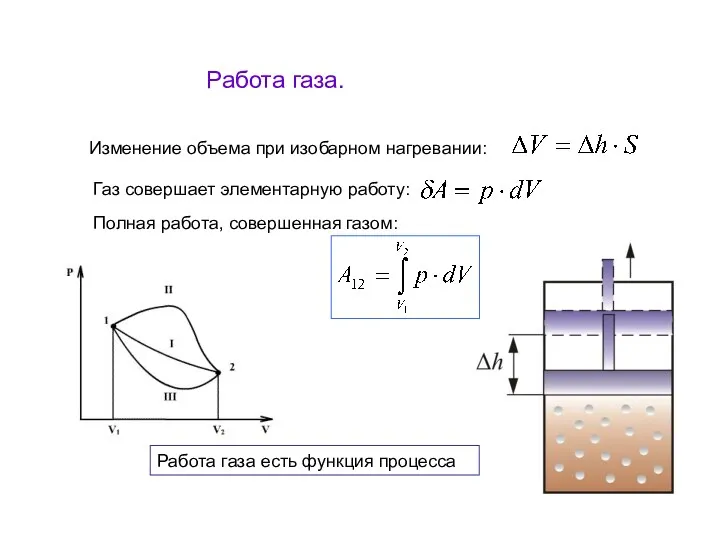
- 12. Работа газа. Изменение объема при изобарном нагревании: Газ совершает элементарную работу: Полная работа, совершенная газом: Работа
- 13. Внутренняя энергия газа.
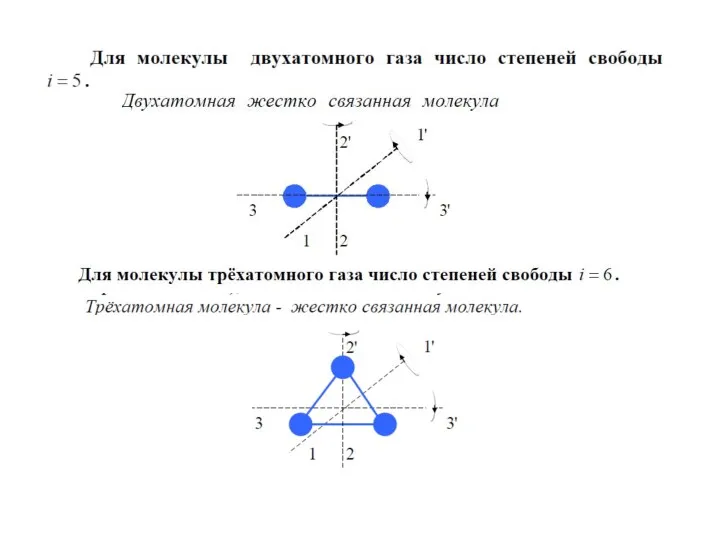
- 17. Внутренняя энергия одноатомного газа Работа газа Первое начало термодинамики Количество теплоты, переданное телу, расходуется на изменение
- 18. Изобарный процесс Изохорный процесс Изотермический процесс Адиабатный процесс
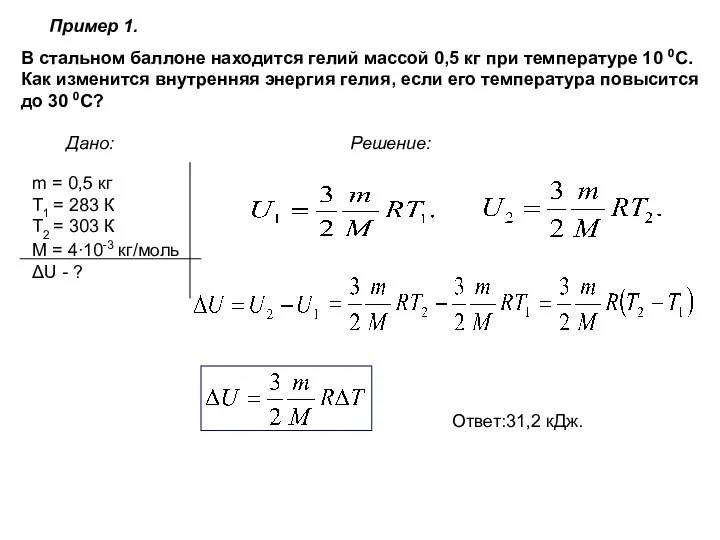
- 19. Пример 1. Дано: Решение: В стальном баллоне находится гелий массой 0,5 кг при температуре 10 0С.
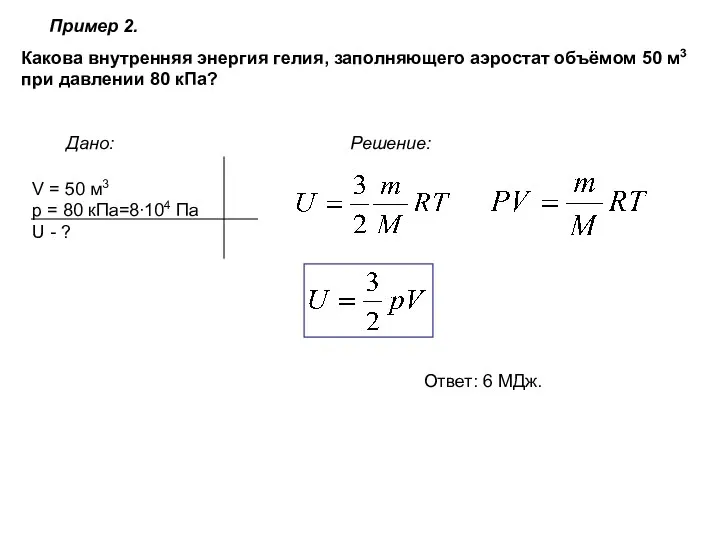
- 20. Пример 2. Какова внутренняя энергия гелия, заполняющего аэростат объёмом 50 м3 при давлении 80 кПа? Дано:
- 21. Идеальный газ переходит из состояния 1 в состояние 4 так, как показано на рисунке. Вычислите работу,
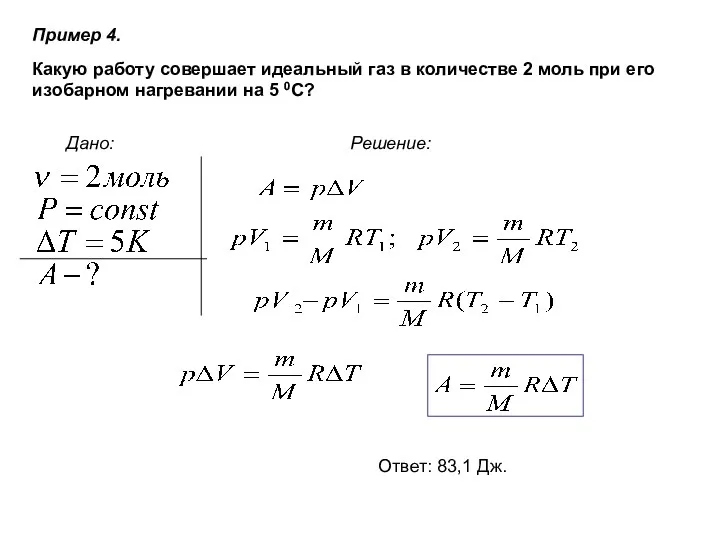
- 22. Пример 4. Дано: Решение: Какую работу совершает идеальный газ в количестве 2 моль при его изобарном
- 23. Пример 5. Дано: Решение: В закрытом баллоне находится газ. При охлаждении его внутренняя энергия уменьшилась на
- 24. Для изобарного нагревания газа, количество вещества которого 400 моль, на 300 К ему сообщили количество теплоты
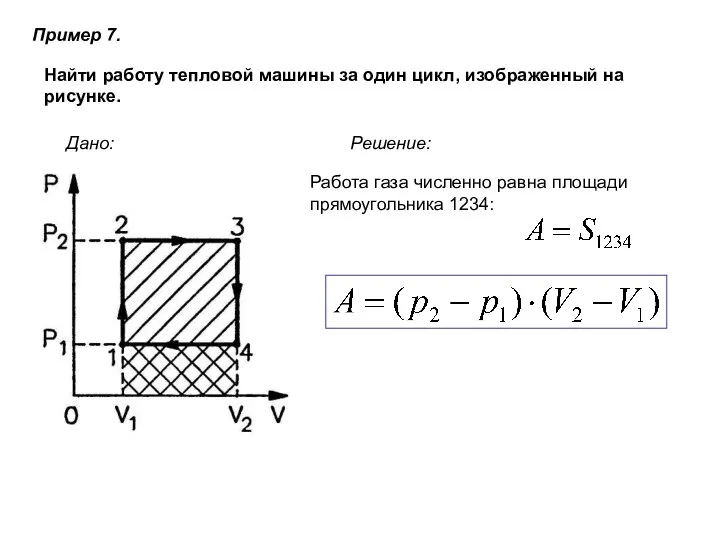
- 25. Найти работу тепловой машины за один цикл, изображенный на рисунке. Пример 7. Дано: Решение: Работа газа
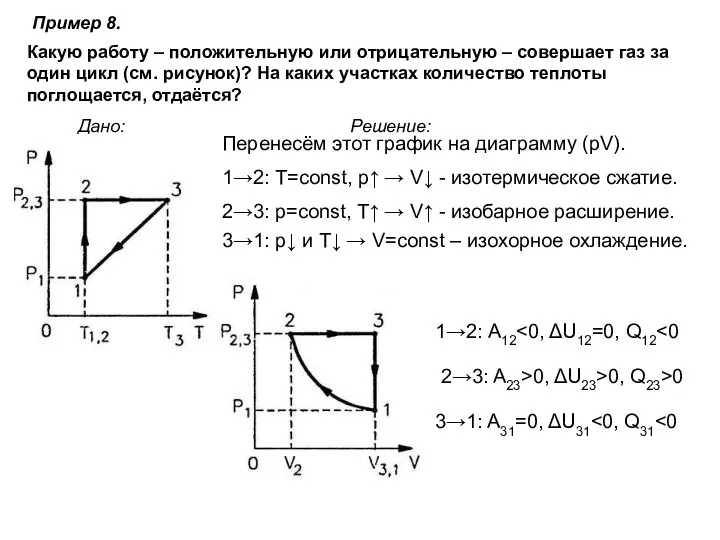
- 26. Пример 8. Дано: Решение: Какую работу – положительную или отрицательную – совершает газ за один цикл
- 27. Теплоемкость идеального газа
- 28. Молярная теплоемкость идеального газа при постоянном объеме СV Молярная теплоемкость идеального газа при постоянном давлении СР
- 29. Классическая теория теплоемкости
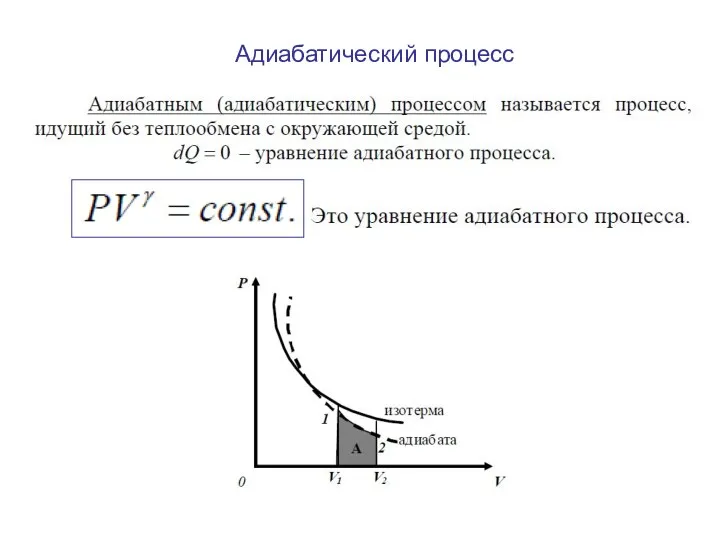
- 30. Адиабатический процесс
- 31. Обратимыми процессами называют процессы перехода системы из одного равновесного состояния в другое, которые можно провести в
- 32. Второе начало термодинамики
- 33. Энтропия
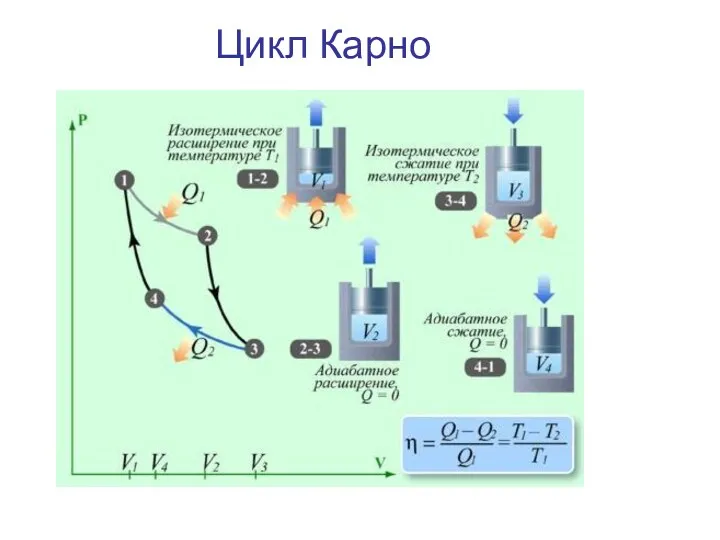
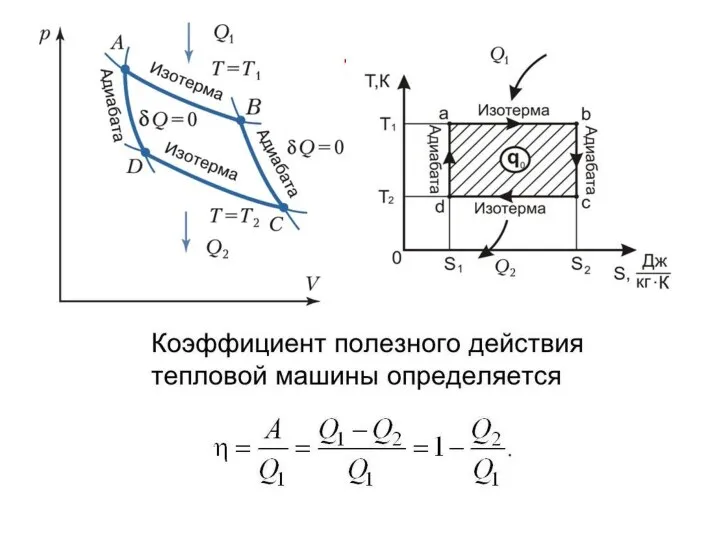
- 34. Цикл Карно
- 36. Первая теорема Карно: КПД любой тепловой машины не может быть больше КПД машины Карно. Вторая теорема
- 37. Газ Ван-дер-Ваальса
- 38. Для реального газа приходится учитывать потенциальную энергию взаимодействия молекул между собой. На молекулы газа действуют силы
- 39. Силы притяжения внутри газа в среднем скомпенсированы для каждой отдельной молекулы. На молекулы, расположенные в тонком
- 40. Сила отталкивания проявляется во всём объёме газа и зависит от расстояния между молекулами. Поэтому необходимо ввести
- 42. Скачать презентацию























 Дисперсия света
Дисперсия света EMI introduction & Coupling modes in EMI 2018-V1
EMI introduction & Coupling modes in EMI 2018-V1 Гироскопические силы. Гироскопы и их применение в технике. Релятивистская механика. (Лекция 6)
Гироскопические силы. Гироскопы и их применение в технике. Релятивистская механика. (Лекция 6) Решение задач по ядерной физике
Решение задач по ядерной физике У кого на огороде картошка вкуснее?
У кого на огороде картошка вкуснее? галактики
галактики Введение в лабораторию
Введение в лабораторию Центр масс. Работа и энергия (лекция 3)
Центр масс. Работа и энергия (лекция 3) Презентации к некоторым лабораторным работам по учебнику А.В.Перышкина Физика 7
Презентации к некоторым лабораторным работам по учебнику А.В.Перышкина Физика 7 Конструкції кип’ятильників і водонагрівальних пристроїв
Конструкції кип’ятильників і водонагрівальних пристроїв Дисперсия света. Опыт Ньютона
Дисперсия света. Опыт Ньютона Урок по физике на тему Звуковые волны
Урок по физике на тему Звуковые волны Реактивные движения в природе
Реактивные движения в природе Конспект урока с презентацией по физике 7 класс Диффузия
Конспект урока с презентацией по физике 7 класс Диффузия Теплообмен человека с окружающей средой
Теплообмен человека с окружающей средой Электротехника. Электрические фильтры. (Лекция 11)
Электротехника. Электрические фильтры. (Лекция 11) Постоянный электрический ток
Постоянный электрический ток Оптика. Развитие взглядов на природу света
Оптика. Развитие взглядов на природу света Взаимодействие тел. Инерция. Масса тела. Сила
Взаимодействие тел. Инерция. Масса тела. Сила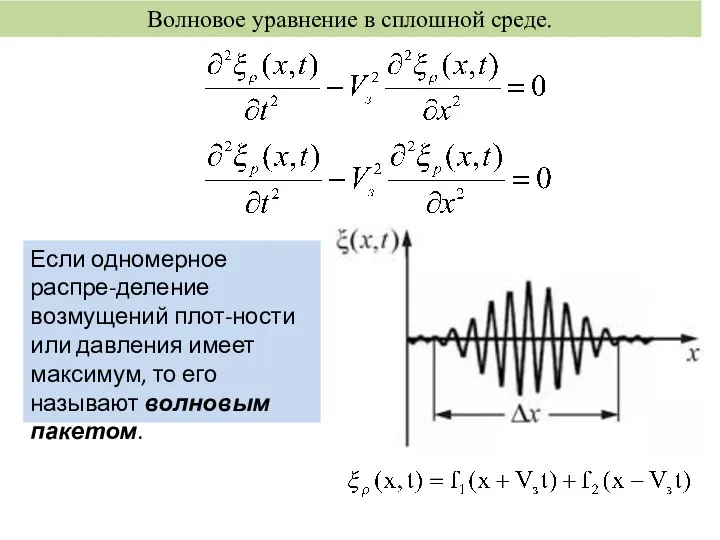 Волновое уравнение в сплошной среде
Волновое уравнение в сплошной среде Тізбек бөлігіне арналған Ом заңы
Тізбек бөлігіне арналған Ом заңы Кинематическое исследование механизмов и машин
Кинематическое исследование механизмов и машин Простейшие движения твердого тела
Простейшие движения твердого тела Исследовательское проектирование прибрежных волноэнергетических систем
Исследовательское проектирование прибрежных волноэнергетических систем Акустика как часть физики
Акустика как часть физики Тест для 8 класса Электрический ток
Тест для 8 класса Электрический ток Основы электроэнергетики
Основы электроэнергетики Агрегатные состояния вещества. Строение твердых, жидких и газообразных тел (в стихах)
Агрегатные состояния вещества. Строение твердых, жидких и газообразных тел (в стихах)