Слайд 2

ПЛАН ЛЕКЦИИ
Теория атома водорода по Бору. Модели атома Томсона и Резерфорда.
Спектр атома водорода. Сериальные формулы.
Комбинационный принцип Ритца.
Модель атома водорода по Бору. Уровни энергий в атоме.
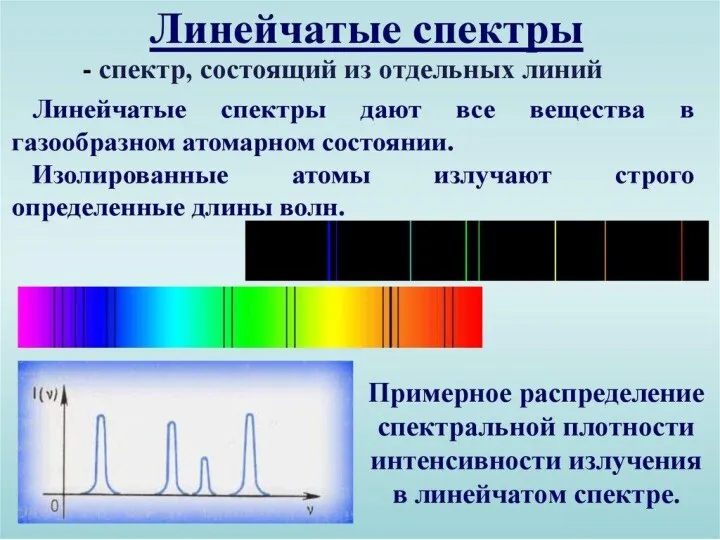
Линейчатые спектры.
Слайд 3

Модели атома Томсона и Резерфорда
Английский физик Дж. Томсон в 1898 г.
предложил первую модель атома в виде положительно заряженного шарика радиусом порядка 10-10 м, в который вкраплены отдельные электроны, нейтрализующие положительный заряд.
Экспериментальная проверка модели Томсона была осуществлена в 1911 г. английским физиком Э. Резерфордом. Резерфорд использовал поток быстрых положительно заряженных α-частиц, испускаемых радиоактивными веществами. Пропуская пучок α-частиц через тонкую золотую фольгу, Резерфорд обнаружил, что некоторая часть частиц отклоняется на значительный угол от первоначального направления, а часть отражается от фольги.
Резерфорд предложил ядерную (планетарную) модель строения атома, в которой атом представлен в виде миниатюрной Солнечной системы.
Слайд 4

Модели атома Томсона и Резерфорда
Согласно ядерной модели, весь положительный заряд и
почти вся масса атома (99,4%) сосредоточены в атомном ядре.
Размер ядра (~10-15 м) ничтожно мал по сравнению с размером атома (~10-10 м).
Вокруг ядра по замкнутым орбитам движутся электроны, образуя электронную оболочку атома. Заряд ядра равен суммарному заряду электронов.
Однако предложенная Резерфордом модель строения атома не объяснила спектральных закономерностей и оказалась в противоречии с законами классической механики и электродинамики.
Атомы являются устойчивыми системами и имеют линейчатые спектры излучения.
Слайд 5

Спектр атома водорода. Сериальные формулы
Внутреннее строение атома изучать непосредственно невозможно из-за
малости размеров атома. Структура атома проявляется только косвенно в явлениях, связанных с его внутренним строением. К числу этих явлений относится излучение.
При изучении излучения ученым удалось установить общие закономерности в характере спектров и найти ряд эмпирических законов, которым они подчиняются.
Было установлено, что спектральные линии всех элементов можно разбить на ряд серий. Структуры соответствующих серий, относящихся к различным химическим элементам, схожи между собой.
В пределах одной серии расположение спектральных линий имеет определенный порядок. Наиболее простым атомом является атом водорода.
Слайд 6

Спектр атома водорода. Сериальные формулы
Слайд 7

Спектр атома водорода. Сериальные формулы
Слайд 8

Спектр атома водорода. Сериальные формулы
Слайд 9

Комбинационный принцип Ритца
Слайд 10

Комбинационный принцип Ритца
Комбинационный принцип Ритца:
для каждого атома возможно найти последовательность
чисел, называемых спектральными термами, таких, что частоты всех спектральных линий этого атома будут выражаться в виде двух каких-либо спектральных термов:
v = T1(i) - T2(n).
Обоснование этого принципа связано со строением атома, с процессами, происходящими внутри атома при излучении волн с частотой, соответствующей какой-либо спектральной линии.
Только теория Бора, выдвинутая им в 1913 г., выяснила значение спектральных законов и показала, что эти законы отражают квантовый характер внутриатомной структуры.
Слайд 11

Модель атома водорода по Бору
Слайд 12

Слайд 13

Слайд 14

Слайд 15

Слайд 16
Слайд 17

















 Энергия. Работа. Мощность. Работа постоянной и переменной силы. Кинетическая энергия
Энергия. Работа. Мощность. Работа постоянной и переменной силы. Кинетическая энергия Переоценка безопасности атомной энергетики
Переоценка безопасности атомной энергетики Интересные факты о физике и астрономии
Интересные факты о физике и астрономии Физические величины. Измерение Физических величин
Физические величины. Измерение Физических величин Физическая игра Интеллектуальный ринг для 5- класса
Физическая игра Интеллектуальный ринг для 5- класса Физика. Простые механизмы
Физика. Простые механизмы Давления света. Химическое действие света
Давления света. Химическое действие света Конструирование. Детали машин
Конструирование. Детали машин Транспортирование машин
Транспортирование машин Основы технического обслуживания и ремонта. (Занятие 1)
Основы технического обслуживания и ремонта. (Занятие 1) Явление полного отражения
Явление полного отражения Ремонт автомобилей. Нормирование сверлильных работ. (Тема 5.2.2)
Ремонт автомобилей. Нормирование сверлильных работ. (Тема 5.2.2) История связи. Виды телеграфной связи и основные этапы ее развития
История связи. Виды телеграфной связи и основные этапы ее развития Свойства воздуха
Свойства воздуха Оптические телескопы
Оптические телескопы творческая работа обучающегося Микроволновая печь-вред или польза
творческая работа обучающегося Микроволновая печь-вред или польза Устройство и принцип действия насосов
Устройство и принцип действия насосов Схемы многокорпусных выпарных установок
Схемы многокорпусных выпарных установок Поляризация света
Поляризация света Методи огляду простору. Вторинне випромінювання радіохвиль
Методи огляду простору. Вторинне випромінювання радіохвиль Свет в нашей жизни
Свет в нашей жизни Физбой. Интеллектуальная игра по физике
Физбой. Интеллектуальная игра по физике Метрология, стандартизация и сертификация. Взаимозаменяемость
Метрология, стандартизация и сертификация. Взаимозаменяемость Неоднородное одномерное уравнение теплопроводности
Неоднородное одномерное уравнение теплопроводности Механізація подрібнення стеблових кормів
Механізація подрібнення стеблових кормів Презентация к уроку решения задач по физике Построение изображений в линзах 8 класс
Презентация к уроку решения задач по физике Построение изображений в линзах 8 класс Электризация тел. Электростатика (8)
Электризация тел. Электростатика (8) Презентация Определение цены деления прибора 7 класс
Презентация Определение цены деления прибора 7 класс