Содержание
- 2. Левкип и Демокрит – 400 лет до н.э. М.В. Ломоносов – XVIII век. «О причине теплоты
- 3. Молекулярно-кинетической теорией называют учение о строении и свойствах вещества на основе представления о существовании атомов и
- 4. 1. Все вещества – жидкие, твердые и газообразные – образованы из мельчайших частиц – молекул (атомов),
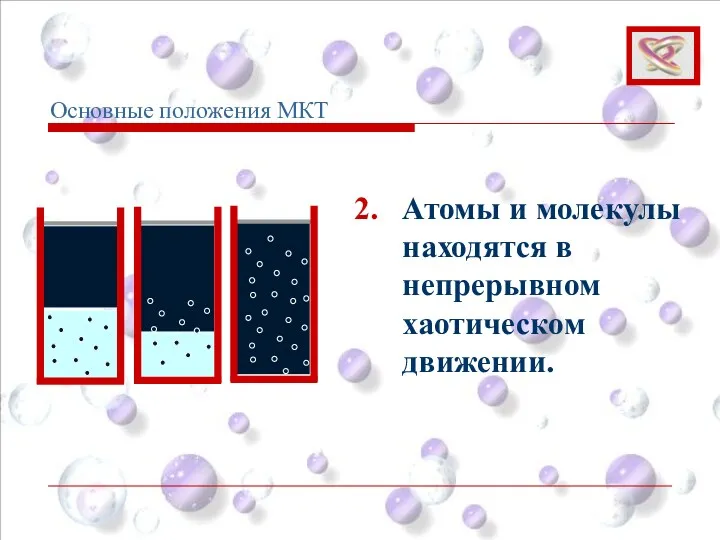
- 5. 2. Атомы и молекулы находятся в непрерывном хаотическом движении. Основные положения МКТ
- 6. 3. Частицы взаимодействуют друг с другом силами, имеющими электрическую природу. Гравитационное взаимодействие между частицами пренебрежимо мало.
- 7. 1. Закон кратных отношений: при образовании из двух элементов различных веществ массы одного из элементов в
- 8. 7 г азота, соединяясь с 4 г кислорода, образуют 11 г закиси азота N2O, 8 г
- 9. 2. Молекулы наблюдаются с помощью ионного проектора, электронного микроскопа Современный электронный микроскоп Опытные обоснования МКТ Существование
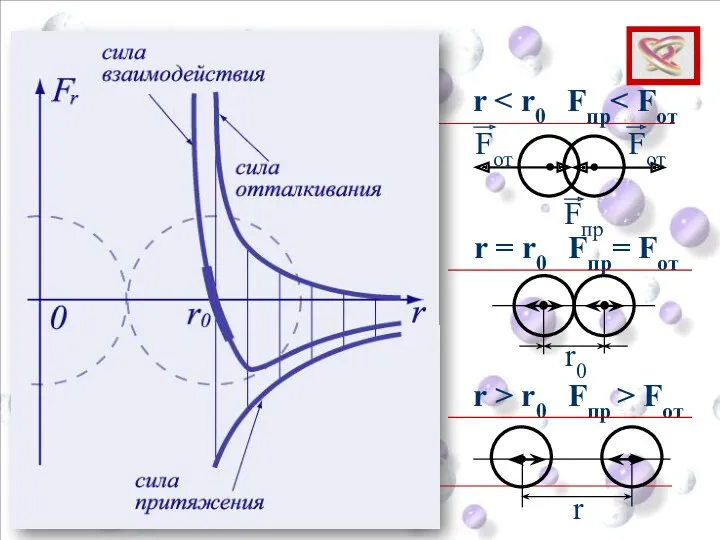
- 10. Опытные обоснования МКТ Взаимодействие молекул Силы притяжения и отталкивания действуют одновременно. Силы электромагнитной природы.
- 11. r r0 Fпр Fот Fот r = r0 Fпр= Fот r > r0 Fпр > Fот
- 12. Опытные обоснования МКТ Хаотическое движение молекул Наиболее ярким экспериментальным подтверждением представлений молекулярно-кинетической теории о беспорядочном движении
- 13. Фотография броуновского движения Опытные обоснования МКТ Хаотическое движение молекул
- 14. 1. Броуновское движение. 2. Диффузия. 3. Давление газа на стенки сосуда. 4. Стремление газа занять любой
- 15. Беспорядочное хаотическое движение молекул называется тепловым движением. Кинетическая энергия теплового движения растет с возрастанием температуры. Основы
- 16. Основы МКТ
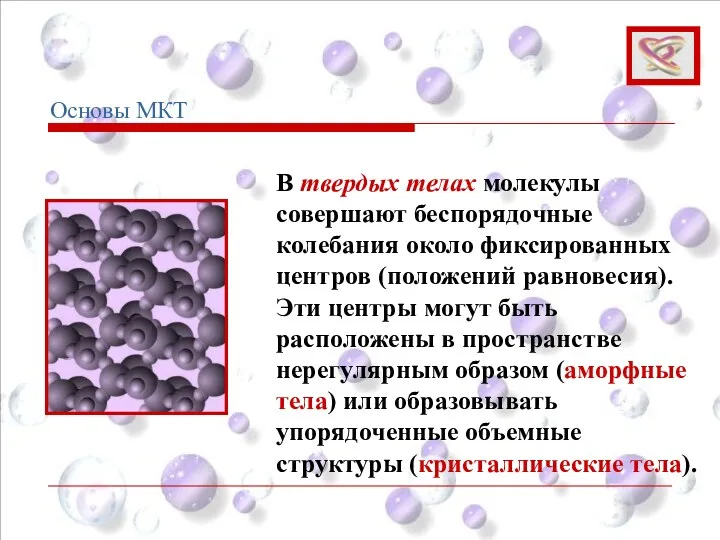
- 17. В твердых телах молекулы совершают беспорядочные колебания около фиксированных центров (положений равновесия). Эти центры могут быть
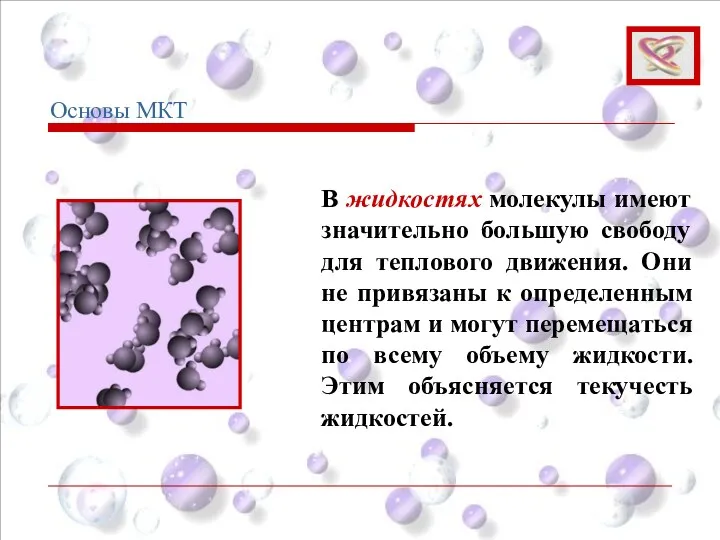
- 18. В жидкостях молекулы имеют значительно большую свободу для теплового движения. Они не привязаны к определенным центрам
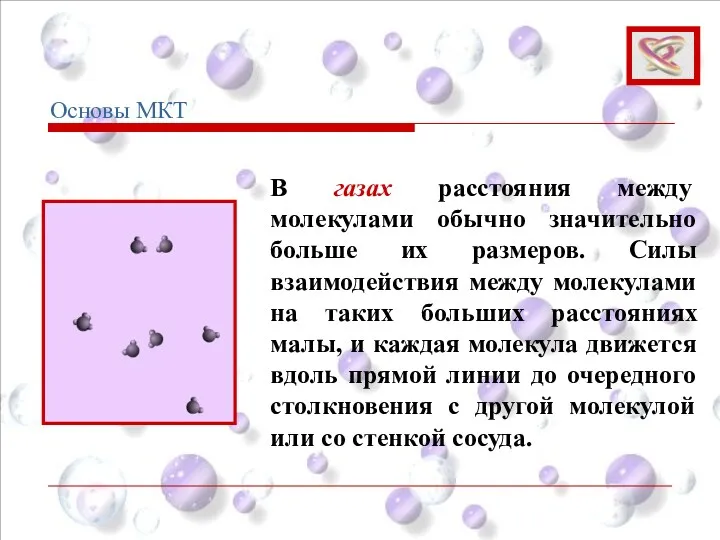
- 19. В газах расстояния между молекулами обычно значительно больше их размеров. Силы взаимодействия между молекулами на таких
- 20. Простейшей моделью молекулярно-кинетической теории является модель идеального газа. В кинетической модели идеального газа молекулы рассматриваются как
- 21. Модель идеального газа достаточно хорошо описывает поведение реальных газов в широком диапазоне давлений и температур. Суммарный
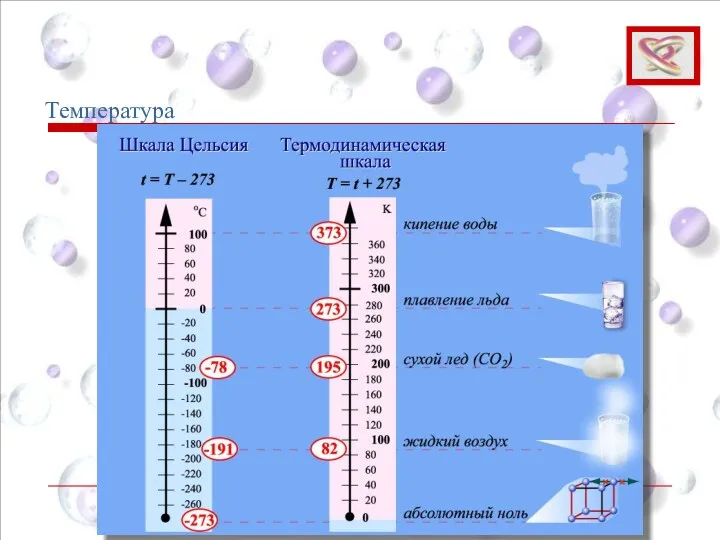
- 22. T = t + 273,15 Температурная шкала Кельвина называется абсолютной (термодинамической) шкалой температур. В СИ единицей
- 23. Температура
- 24. Температура Понятие температуры тесно связано с понятием теплового равновесия. Тепловое равновесие – это такое состояние системы
- 25. Макроскопические параметры: давление, объем, температура. Основы МКТ p V T ?
- 26. Газовые законы
- 27. ИЗОПРОЦЕССЫ В ГАЗАХ (газовые законы) Процессы, протекающие при неизменном значении одного из параметров (p, V, T)
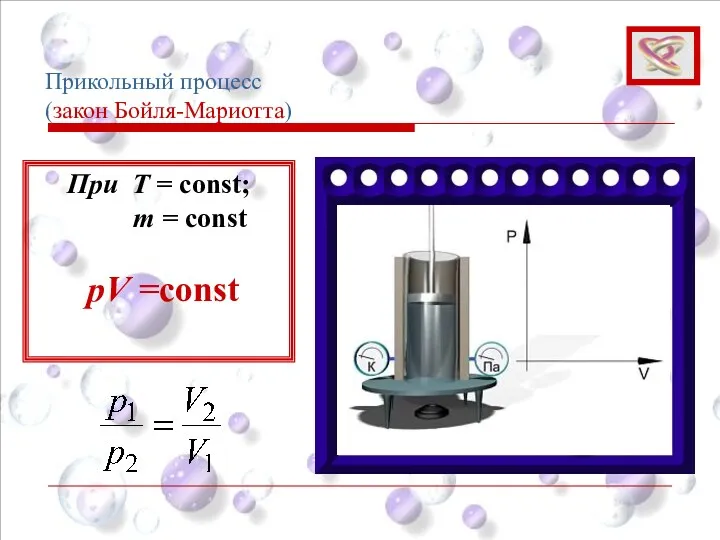
- 28. Изотермический процесс (закон Бойля-Мариотта) Для данной массы газа при постоянной температуре произведение давления газа на его
- 29. p V T1 T2 > T1 График процесса: изотерма p Т Т2 Т1 Т V Т1
- 30. При T = const; m = const pV =const Прикольный процесс (закон Бойля-Мариотта)
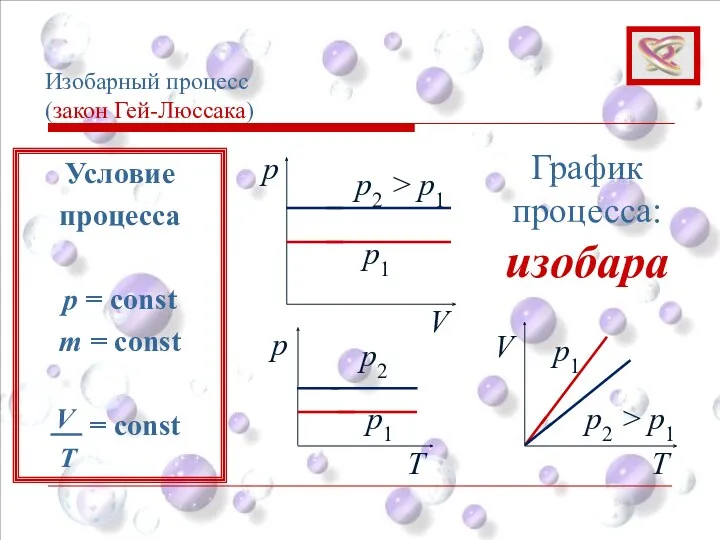
- 31. Изобарный процесс (закон Гей-Люссака) Изобарным процессом называют процесс, протекающий при неизменном давлении p. Объем данной массы
- 32. где V0 – объем газа при температуре 0 °С. Коэффициент α равен (1/273,15) К–1. Его называют
- 33. Изобарный процесс (закон Гей-Люссака) p V p1 p2 > p1 График процесса: изобара p Т Т
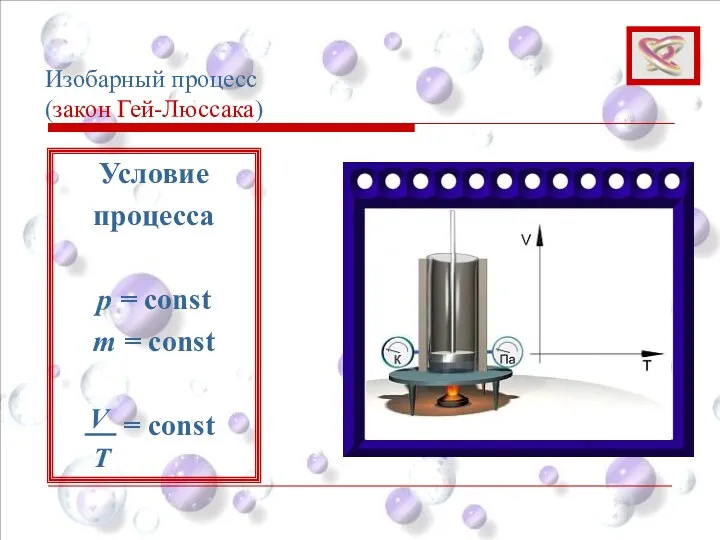
- 34. Изобарный процесс (закон Гей-Люссака) Условие процесса p = const m = const = const T V
- 35. Изохорный процесс (закон Гей-Люссака – Шарля) Изохорный процесс – это процесс протекающий при постоянном объеме V.
- 36. Изохорный процесс (закон Гей-Люссака – Шарля) где p0 – давление газа при температуре 0 °С. Коэффициент
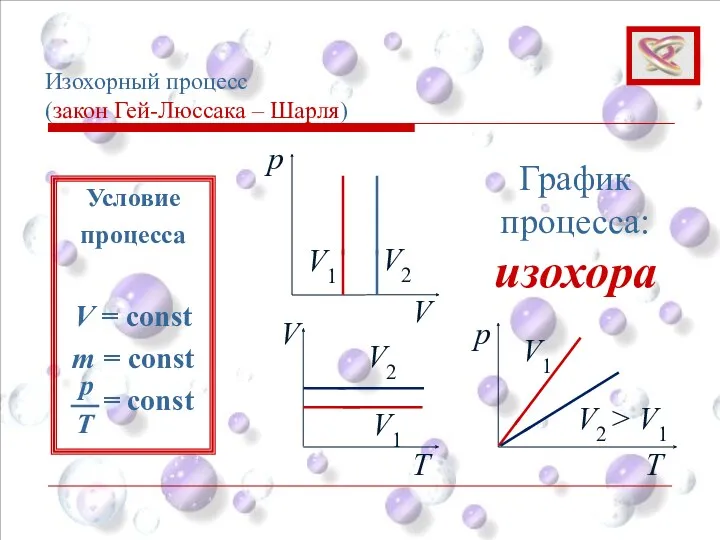
- 37. Изохорный процесс (закон Гей-Люссака – Шарля) p V V1 V2 График процесса: изохора V Т Т
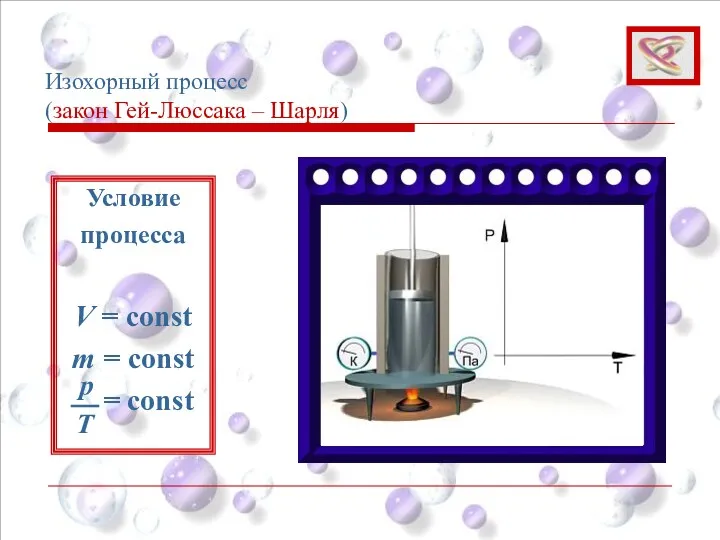
- 38. Изохорный процесс (закон Гей-Люссака – Шарля) Условие процесса V = const m = const = const
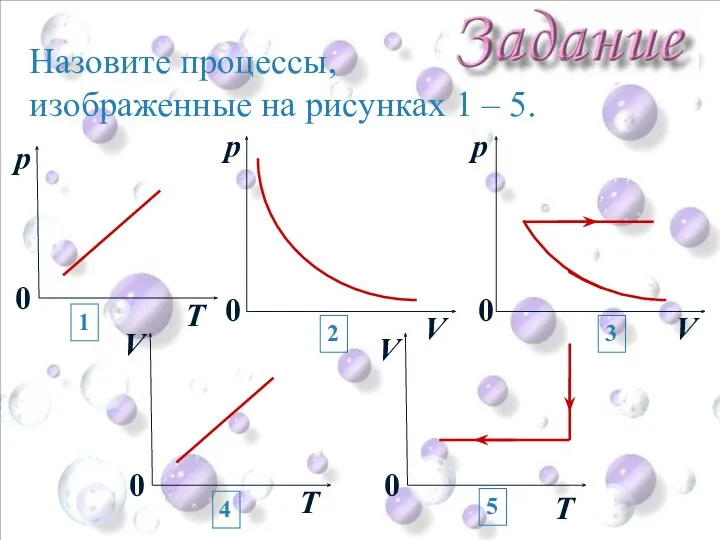
- 39. Назовите процессы, изображенные на рисунках 1 – 5. Т p 0 p V 0 p V
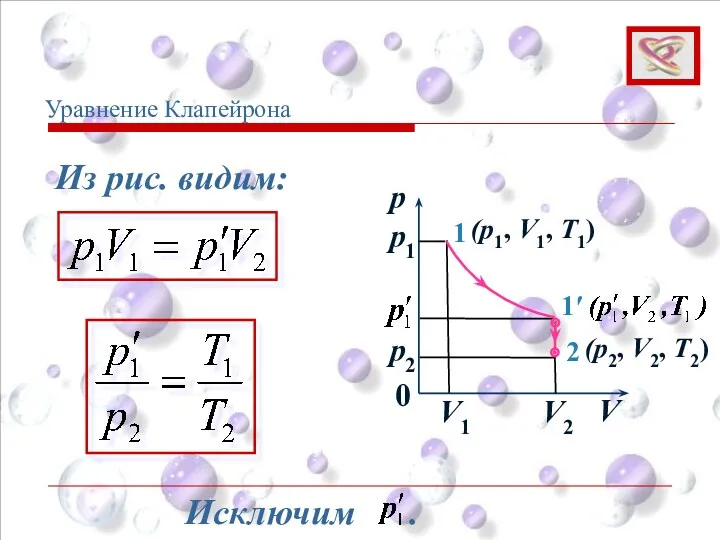
- 40. p V 0 1 1′ 2 p1 p2 V1 V2 (p1, V1, T1) (p2, V2, T2)
- 41. p V 0 1 1′ 2 p1 p2 V1 V2 (p1, V1, T1) (p2, V2, T2)
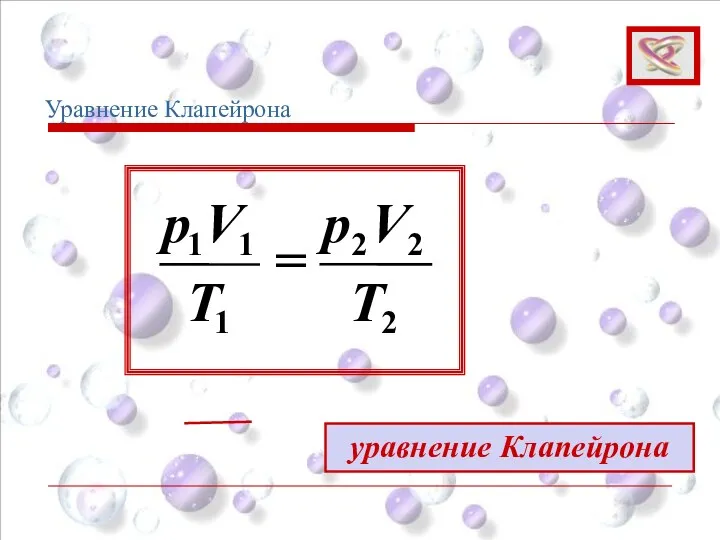
- 42. 2 2 2 1 1 1 T V р T V р = уравнение Клапейрона Уравнение
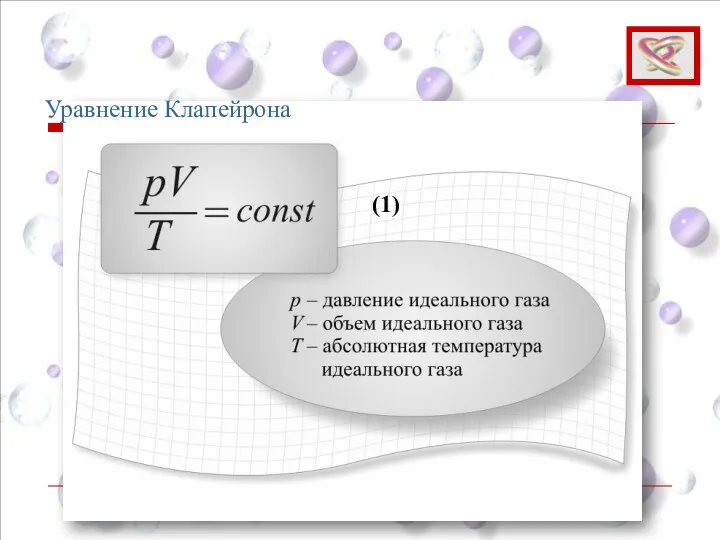
- 43. Уравнение Клапейрона (1)
- 44. Один моль любого газа при нормальных условиях (Т = 273 К и р = 1,013∙105 Па)
- 45. Уравнение Менделеева-Клапейрона
- 46. Уравнение Менделеева-Клапейрона (молярная газовая постоянная)
- 47. Тогда для 1 моль газа уравнение (1) можно записать в виде: Уравнение Менделеева-Клапейрона для 1 моль
- 48. Тогда для любой массы газа m: Учтено, что: Уравнение Менделеева-Клапейрона ν – (количество вещества) число молей
- 49. Уравнение Менделеева-Клапейрона
- 50. Задача молекулярно-кинетической теории состоит в том, чтобы установить связь между микроскопическими (масса, скорость, кинетическая энергия молекул)
- 51. Газ, состоящий из отдельных атомов, а не молекул, называют одноатомным. К одноатомным газам относят инертные газы
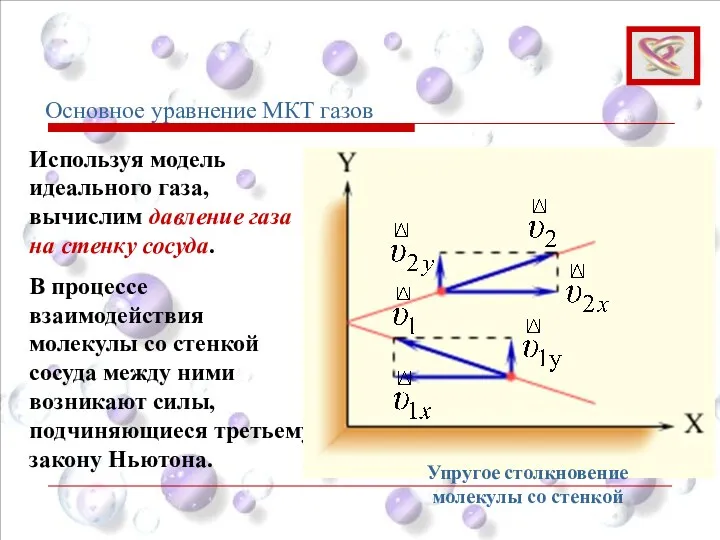
- 52. Используя модель идеального газа, вычислим давление газа на стенку сосуда. В процессе взаимодействия молекулы со стенкой
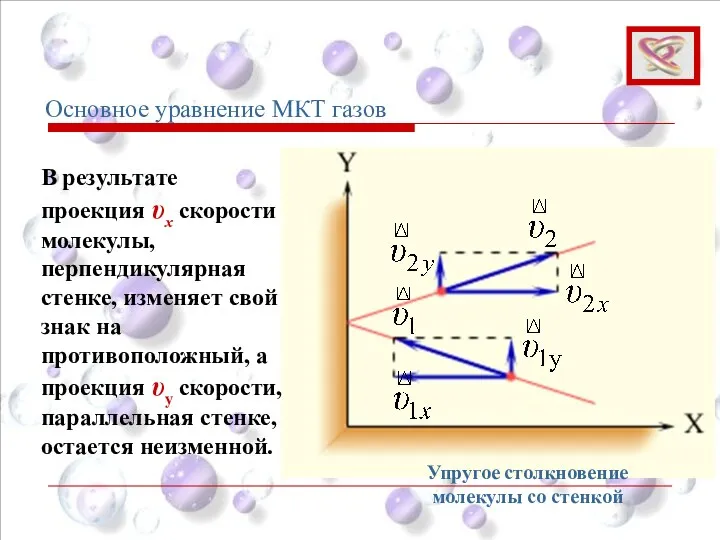
- 53. В результате проекция υx скорости молекулы, перпендикулярная стенке, изменяет свой знак на противоположный, а проекция υy
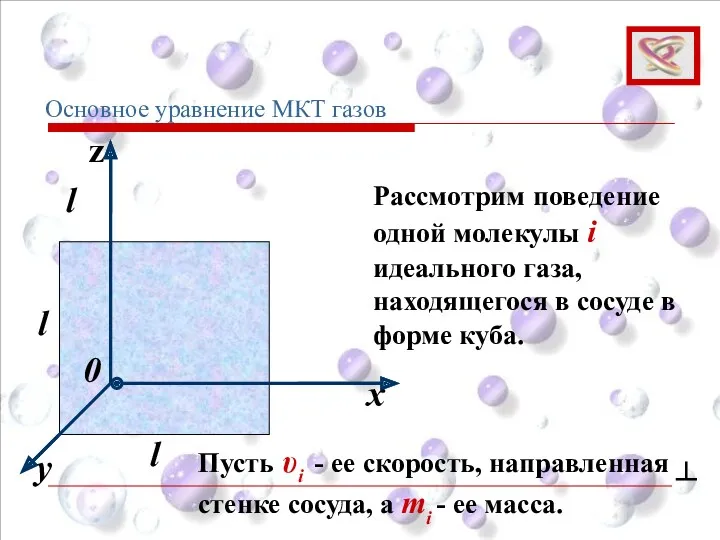
- 54. y x z 0 l l l Рассмотрим поведение одной молекулы i идеального газа, находящегося в
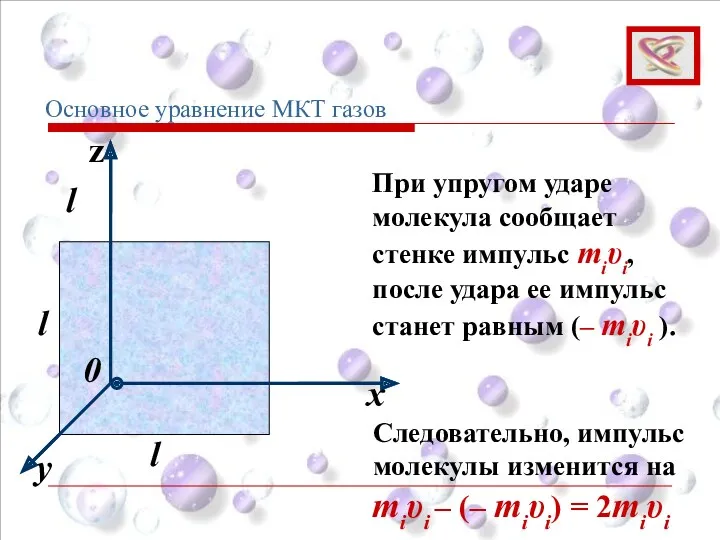
- 55. y x z 0 l l l При упругом ударе молекула сообщает стенке импульс miυi, после
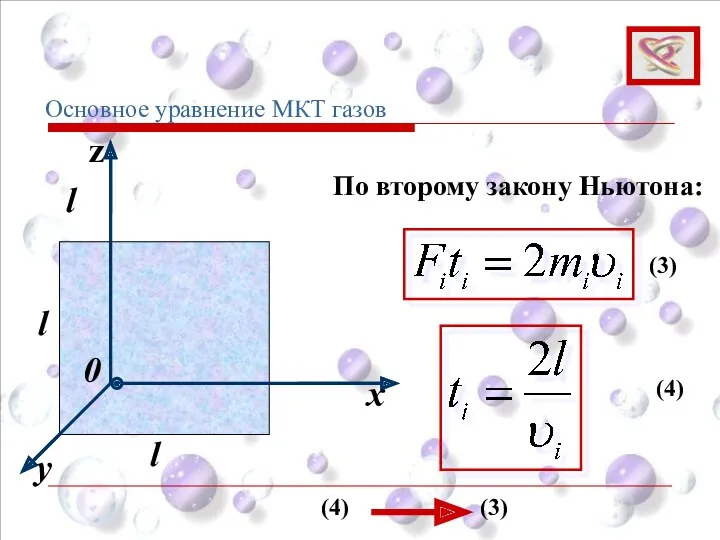
- 56. y x z 0 l l l Основное уравнение МКТ газов По второму закону Ньютона: (3)
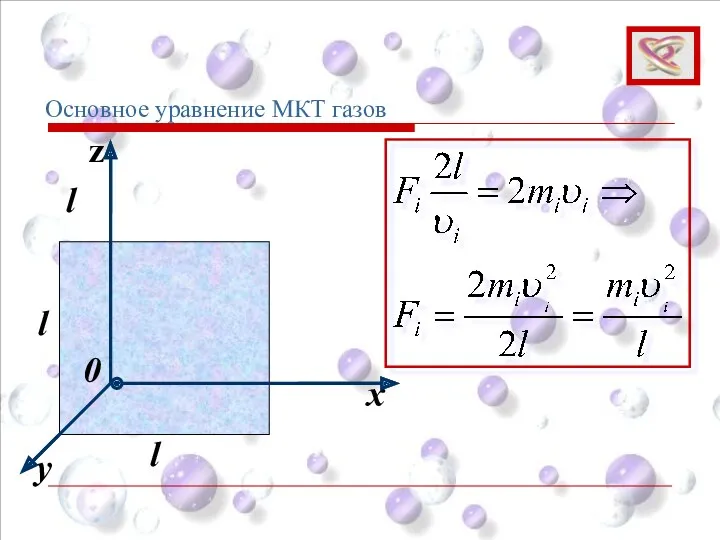
- 57. y x z 0 l l l Основное уравнение МКТ газов
- 58. y x z 0 l l l Основное уравнение МКТ газов Между двумя противоположными гранями куба
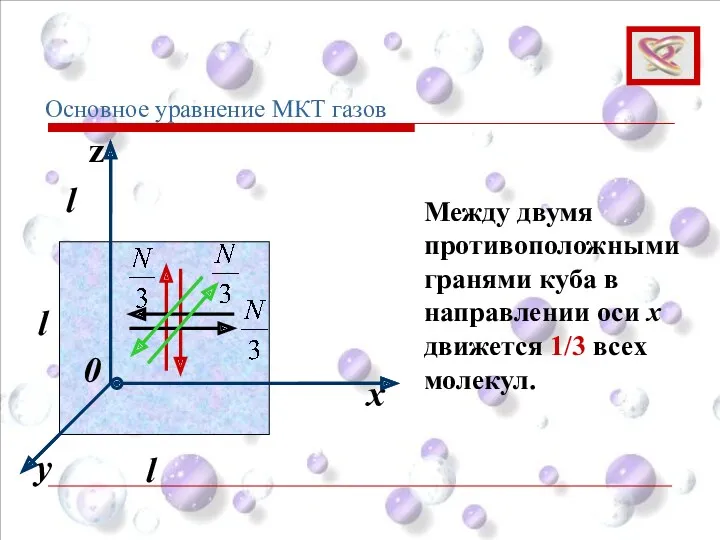
- 59. Суммарная сила ударов об одну грань: Основное уравнение МКТ газов
- 60. Основное уравнение МКТ газов Для идеального газа (m1 = m2 = … = mn = m0):
- 61. Основное уравнение МКТ газов р – давление газа на стенку сосуда. С другой стороны, сила F,
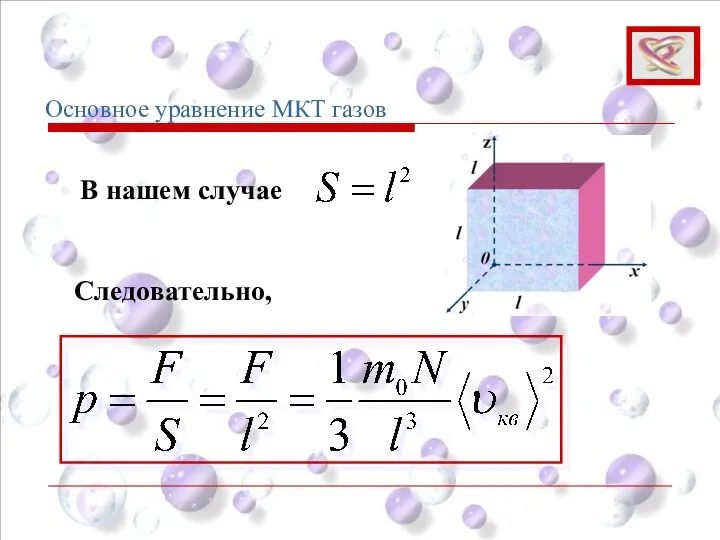
- 62. Основное уравнение МКТ газов В нашем случае Следовательно,
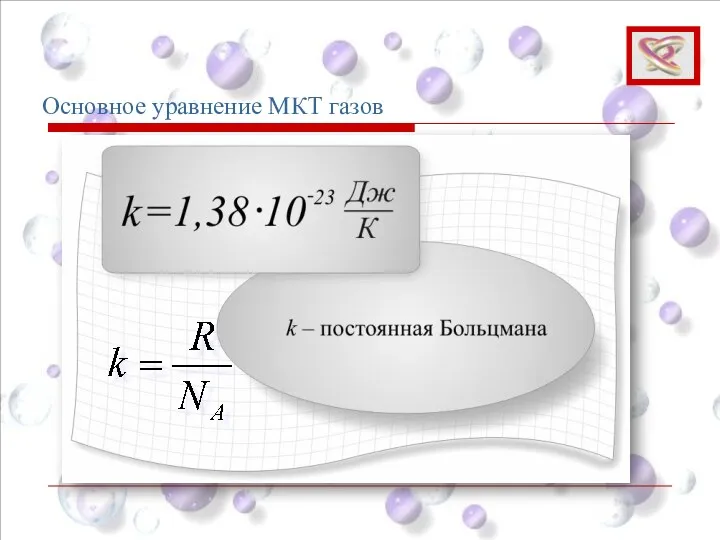
- 63. Или Основное уравнение МКТ (5) Основное уравнение МКТ газов ‒ концентрация молекул
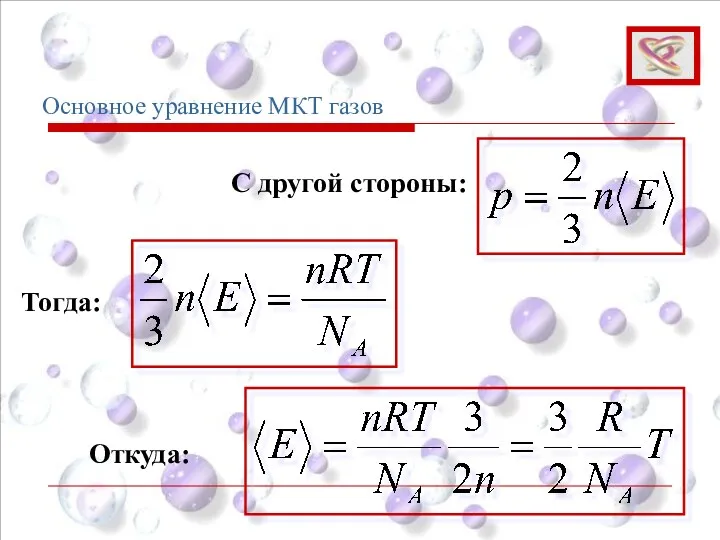
- 64. Основное уравнение МКТ газов Средняя кинетическая энергия хаотического движения молекул газа Откуда (5)
- 65. Основное уравнение МКТ газов (6) Основное уравнение МКТ
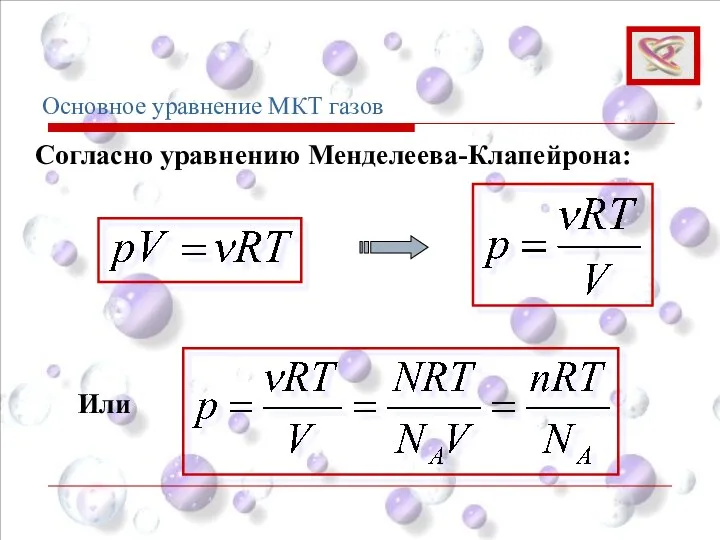
- 66. Основное уравнение МКТ газов Согласно уравнению Менделеева-Клапейрона: Или
- 67. Основное уравнение МКТ газов Тогда: С другой стороны: Откуда:
- 68. Основное уравнение МКТ газов
- 69. Основное уравнение МКТ газов Тогда: Средняя кинетическая энергия хаотического движения молекул газа прямо пропорциональна абсолютной температуре.
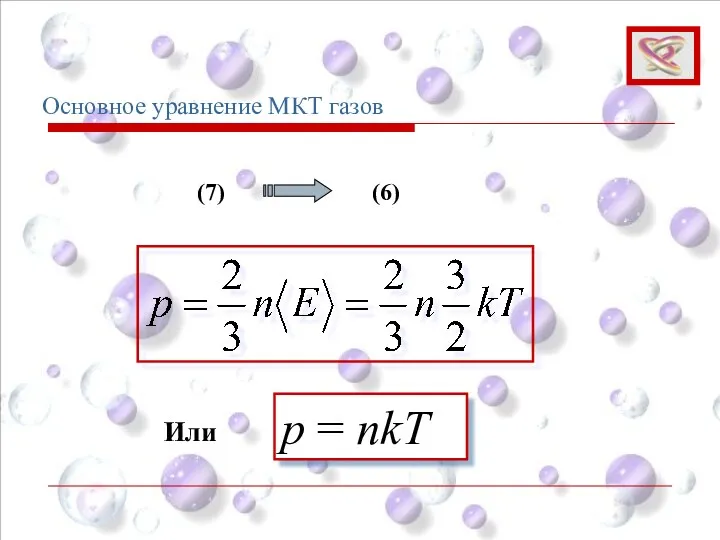
- 70. Основное уравнение МКТ газов p = nkT (7) (6) Или
- 72. Скачать презентацию










































 Проектирование фрагментов учебного занятия с использованием ЦОР на уроках физики
Проектирование фрагментов учебного занятия с использованием ЦОР на уроках физики Синергетика. Предмет, методы и школы синергетики
Синергетика. Предмет, методы и школы синергетики Строительная механика энергетических установок
Строительная механика энергетических установок Разработка урока физики по теме Магнитное поле и его свойства 9 класс
Разработка урока физики по теме Магнитное поле и его свойства 9 класс Теплоизмерительные приборы
Теплоизмерительные приборы Деформация и механические свойства материалов
Деформация и механические свойства материалов Постоянный электрический ток
Постоянный электрический ток Плотность. Решение задач
Плотность. Решение задач Внедрение ФГОС общего образования второго поколения по физике
Внедрение ФГОС общего образования второго поколения по физике Особливості функціонування лінійних та нелінійних кіл. Зворотні зв'язки в електричних колах
Особливості функціонування лінійних та нелінійних кіл. Зворотні зв'язки в електричних колах Презентация Законы Ньютона
Презентация Законы Ньютона 090ee86581854a8e900ae9f90b8772bc
090ee86581854a8e900ae9f90b8772bc Цепи постоянного тока
Цепи постоянного тока Проектная деятельность, как важнейший фактор деятельностной педагогики
Проектная деятельность, как важнейший фактор деятельностной педагогики Атом ядросының модельдерінің түрлерІ
Атом ядросының модельдерінің түрлерІ Турнир юных физиков среди учащихся 7 класса
Турнир юных физиков среди учащихся 7 класса Internal combustion engine
Internal combustion engine решение задач на давление в жидкости
решение задач на давление в жидкости Физические свойства горных пород
Физические свойства горных пород Плавание судов. Воздухоплавание
Плавание судов. Воздухоплавание Техническое обслуживание и ремонт автомобильного транспорта
Техническое обслуживание и ремонт автомобильного транспорта Презентация игры Любите ли вы физику?
Презентация игры Любите ли вы физику? Кинематика. Лекция 1-1
Кинематика. Лекция 1-1 Тепловые процессы. Теплообменники. Нагрев острым паром
Тепловые процессы. Теплообменники. Нагрев острым паром Муфты. Механические муфты. Лекция № 16. Тема 6
Муфты. Механические муфты. Лекция № 16. Тема 6 Изготовление столярного соединения УС-1
Изготовление столярного соединения УС-1 Поверхностное натяжение жидкости. Смачивание, капиллярные явления
Поверхностное натяжение жидкости. Смачивание, капиллярные явления Развитие технологии полупроводников. Методы исследования и контроля наноструктур
Развитие технологии полупроводников. Методы исследования и контроля наноструктур