Содержание
- 2. Содержание раздела: Тема 1. Основные положения МКТ
- 3. Тема 1. Основные положения МКТ
- 4. Основные понятия Молекулярная физика – раздел физики, изучающий зависимости строения и физических свойств тел от характера
- 5. Основные понятия Атомом называют наименьшую частицу данного химического элемента. Молекулой называют наименьшую устойчивую частицу данного вещества,
- 6. Электронный микроскоп 1. Все тела состоят из мельчайших частиц – атомов, молекул, в состав которых входят
- 7. 2. Атомы и молекулы вещества всегда находятся в непрерывном хаотическом (беспорядочном) движении. Основные положения МКТ Диффузия
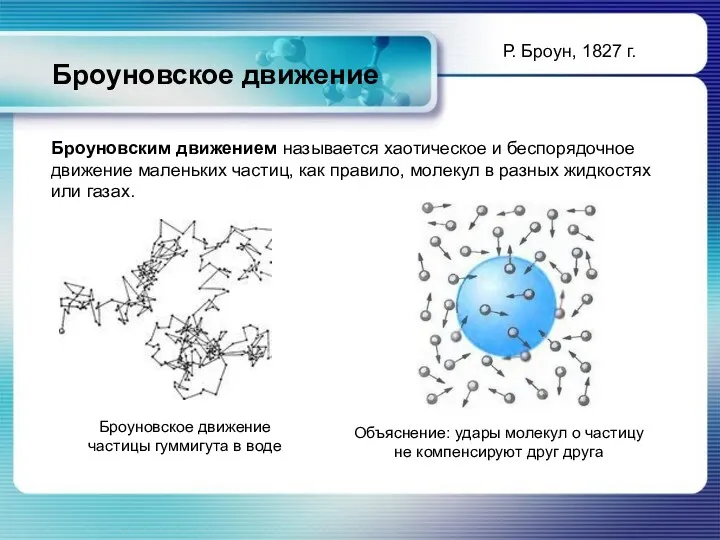
- 8. Броуновское движение Броуновское движение частицы гуммигута в воде Объяснение: удары молекул о частицу не компенсируют друг
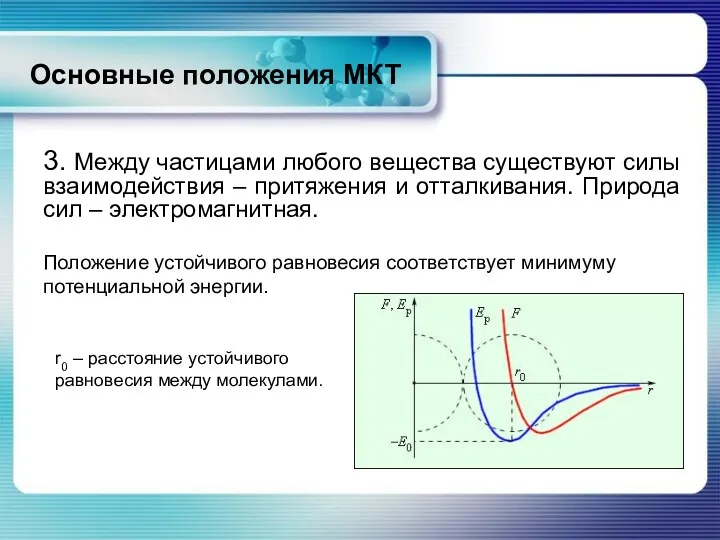
- 9. 3. Между частицами любого вещества существуют силы взаимодействия – притяжения и отталкивания. Природа сил – электромагнитная.
- 10. Масса молекул Mr - относительная молекулярная масса, безразмерная величина, равная отношению массы молекулы к 1/12 массы
- 11. Количество вещества Количество вещества ν — физическая величина, характеризующая количество однотипных структурных единиц, содержащихся в данной
- 12. Закрепление Задание 2 Определите молярную массу следующих веществ: аммиак, гелий, органического соединения (C3H6O)2. Задание 4 Поместятся
- 13. Тема 2. Идеальный газ
- 14. Строение газообразных, жидких и твёрдых тел Газы. Частицы газа не связаны молекулярными силами притяжения и движутся
- 15. Идеальный газ. Параметры состояния Идеальным газом называют такой газ, для которого можно пренебречь размерами молекул, силами
- 16. Параметры состояния идеального газа Объём газа V всегда совпадает с вместимостью сосуда, который он занимает, единица
- 17. Температура Температура – физическая величина, характеризующая степень нагретости тела. Состояние системы тел, при котором теплообмен между
- 18. Температурные шкалы Прибор для измерения температуры называют термометром. Эти шкалы не являются научно обоснованными.
- 19. Абсолютная шкала температур Задание 6 Переведите в абсолютную шкалу температур: 27°C, - 97°C. Термодинамическая шкала температур
- 20. Тема 3. Основное уравнение МКТ
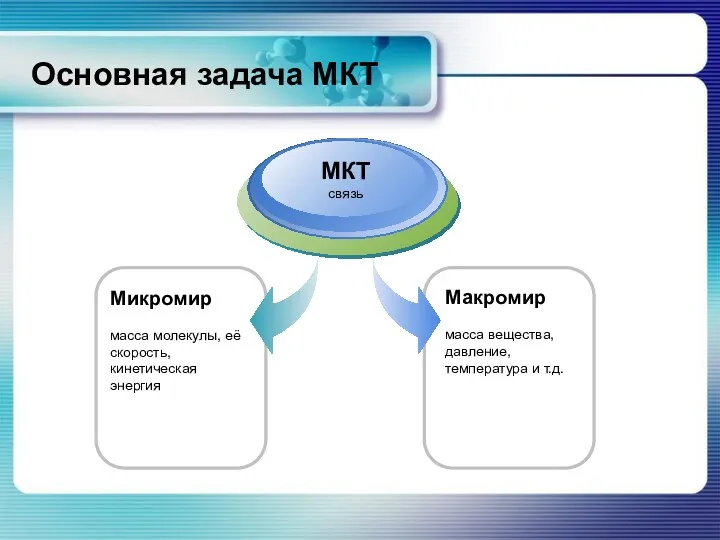
- 21. Основная задача МКТ Микромир масса молекулы, её скорость, кинетическая энергия МКТ связь Макромир масса вещества, давление,
- 22. Основное уравнение МКТ МКТ рассматривает давление газа на стенки сосуда, в котором он находится, как результат
- 23. Следствие Основное уравнение МКТ: Средняя кинетическая энергия молекулы газа: Давление газа равно 2/3 от средней кинетической
- 24. Закрепление Задание 7 Средняя кинетическая энергия поступательного движения молекул водорода равна 1,35⋅10-20Дж. Определите среднюю квадратичную скорость
- 25. Тема 4. Газовые законы
- 26. Изопроцессы Всякое изменение состояния газа называется термодинамическим процессом. Процесс, при котором один из параметров остается постоянным,
- 27. Изобарный процесс (p=const) Закон Гей-Люссака: при изобарном процессе отношение объёма данной массы газа к его абсолютной
- 28. Изохорный процесс (V=const) Закон Шарля: при изохорном процессе отношение давления данной массы газа к его абсолютной
- 29. Изотермический процесс (T=const) Закон Бойля - Мариотта: при изотермическом процессе произведение давления данной массы газа на
- 30. Уравнение Клапейрона На практике чаще всего встречаются случаи, когда одновременно изменяются все три параметра состояния. Можно
- 31. Уравнение Менделеева-Клапейрона В общем случае выполняется закон Менделеева-Клапейрона:
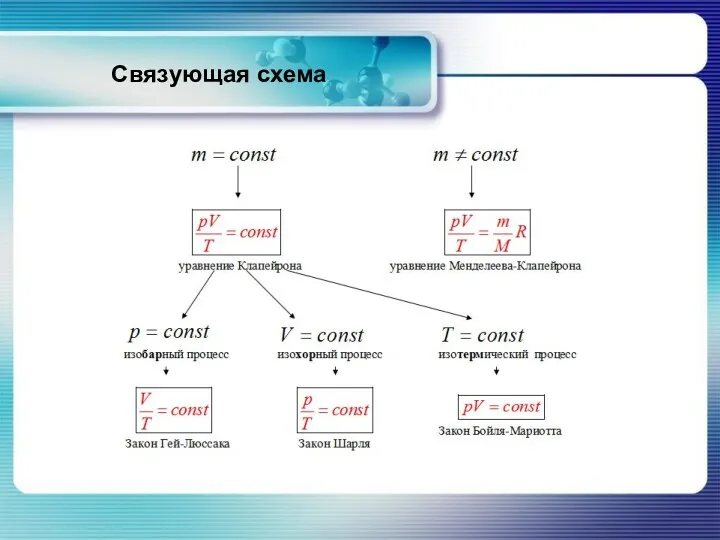
- 32. Связующая схема
- 33. Закрепление Задание 10 Каким должен быть наименьший объём V баллона, чтобы он вмещал m = 6,4
- 34. Средняя квадратичная скорость молекул Из уравнения Менделеева - Клапейрона Из основного уравнения МКТ - средняя квадратичная
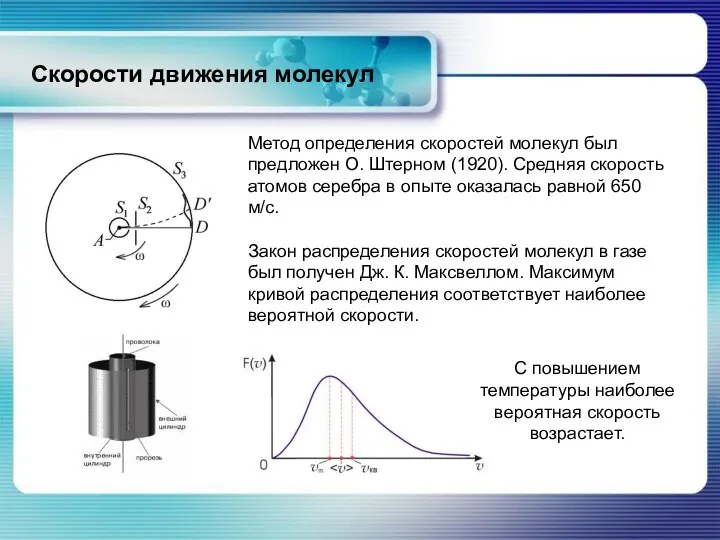
- 35. Скорости движения молекул Метод определения скоростей молекул был предложен О. Штерном (1920). Средняя скорость атомов серебра
- 37. Скачать презентацию





























 Действие жидкости и газа на погруженное в них тело
Действие жидкости и газа на погруженное в них тело Физическая и коллоидная химия
Физическая и коллоидная химия Replacement of controller (Decos Ⅲc)
Replacement of controller (Decos Ⅲc) Решение задач по физике в 7 - классе.
Решение задач по физике в 7 - классе. Жидкие кристаллы – не кристаллы
Жидкие кристаллы – не кристаллы Искусственные спутники земли
Искусственные спутники земли Урок - КВН по теме: Взаимодействие тел. Силы в природе
Урок - КВН по теме: Взаимодействие тел. Силы в природе Простые механизмы
Простые механизмы Конвективный теплообмен
Конвективный теплообмен Презентация к уроку. Подготовка к ЕГЭ на уроках физики. Тема урока: Решение задач по теме Электромагнитные колебания
Презентация к уроку. Подготовка к ЕГЭ на уроках физики. Тема урока: Решение задач по теме Электромагнитные колебания Ремонт пластинчатых насосов
Ремонт пластинчатых насосов Сила упругости
Сила упругости Условия плавания тел в жидкости. Лабораторная работа
Условия плавания тел в жидкости. Лабораторная работа Устройство увеличительных приборов
Устройство увеличительных приборов Презентация к уроку физики в 8 классе: Обобщение по теме Агрегатные состояния вещества.
Презентация к уроку физики в 8 классе: Обобщение по теме Агрегатные состояния вещества. Устройства функциональной электроники. Устройства второго поколения (11)
Устройства функциональной электроники. Устройства второго поколения (11) Электрические явления. Соединения проводников
Электрические явления. Соединения проводников Электростатика. Первоначальная энергия электрона
Электростатика. Первоначальная энергия электрона Напруженість електричного поля. Силові лінії електричного поля. Накладання електричних полів. Електричне поле точкових зарядів
Напруженість електричного поля. Силові лінії електричного поля. Накладання електричних полів. Електричне поле точкових зарядів Своя игра. Простые механизмы
Своя игра. Простые механизмы Плавание судов
Плавание судов Тела, вещества, частицы (окружающий мир, 3 класс)
Тела, вещества, частицы (окружающий мир, 3 класс) Сила тока. Условия, необходимые для существования электрического тока. Закон Ома для участка цепи
Сила тока. Условия, необходимые для существования электрического тока. Закон Ома для участка цепи Постоянный электрический ток
Постоянный электрический ток Инерция тел. Взаимодействие тел. Масса (7 класс)
Инерция тел. Взаимодействие тел. Масса (7 класс) Явление электромагнитной индукции
Явление электромагнитной индукции Элементы физической кинетики
Элементы физической кинетики Равновесие системы двух абсолютно твердых тел (сочленения)
Равновесие системы двух абсолютно твердых тел (сочленения)