Содержание
- 2. ОСНОВЫ Молекулярно-Кинетическая Теория Представляет собой: Учение, объясняющее тепловые явления в зависимости от внутреннего строения вещества
- 3. ОСНОВЫ Молекулярно-кинетической теорией называют учение о строении и свойствах вещества на основе представления о существовании атомов
- 4. ОСНОВЫ Молекулярно-Кинетическая Теория Сформировалась в конце Девятнадцатого века Менделеев Д.И. Роберт Бойль Джон Дальтон Луи Гей-Люссак
- 5. Молекулярно-Кинетическая Теория Основывается на следующих положениях: + Вещество состоит из мелких частиц – атомов, молекул, ионов;
- 6. Иными словами: В основе молекулярно-кинетической теории лежат три основных положения: Все вещества – жидкие, твердые и
- 7. Молекулы и атомы представляют собой электрически нейтральные частицы. При определенных условиях молекулы и атомы могут приобретать
- 8. Атомы и молекулы находятся в непрерывном хаотическом движении. Частицы взаимодействуют друг с другом силами, имеющими электрическую
- 9. Простейшая кинетическая модель газа при этом базируется на предположении о том, что: (1) Газ состоит из
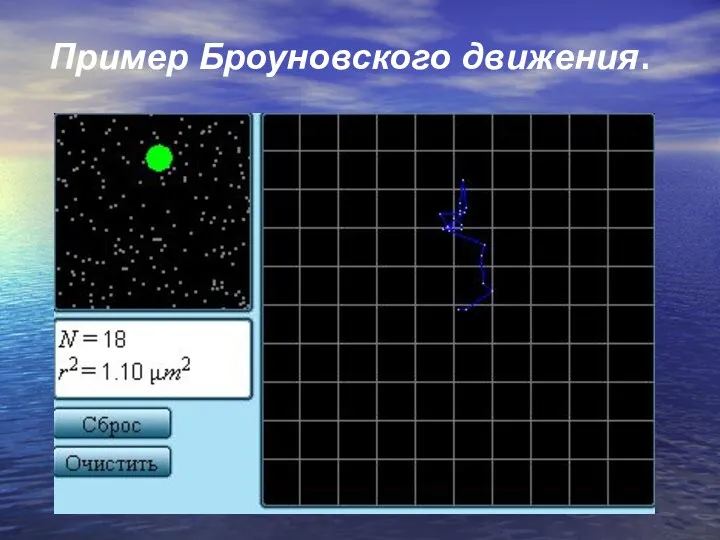
- 10. Наиболее ярким экспериментальным подтверждением представлений молекулярно-кинетической теории о беспорядочном движении атомов и молекул является броуновское движение.
- 11. Пример Броуновского движения.
- 12. Простейшей моделью молекулярно-кинетической теории является модель идеального газа. В кинетической модели идеального газа молекулы рассматриваются как
- 13. Суммарный объем всех молекул предполагается малым по сравнению с объемом сосуда, в котором находится газ. Модель
- 14. Задача молекулярно-кинетической теории состоит в том, чтобы установить связь между микроскопическими (масса, скорость, кинетическая энергия молекул)
- 15. Идеальный газ представляет собой Газ с «идеальными» частицами и «идеальным» поведением. идеализированным отношением между Давлением, Объемом,
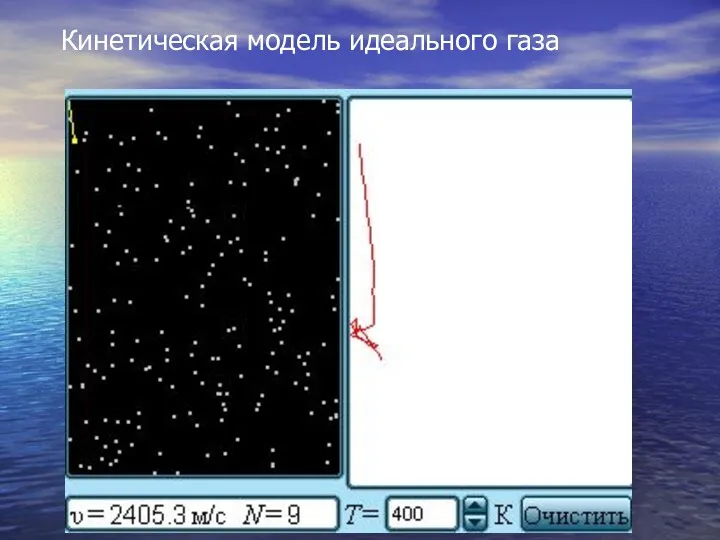
- 16. Кинетическая модель идеального газа
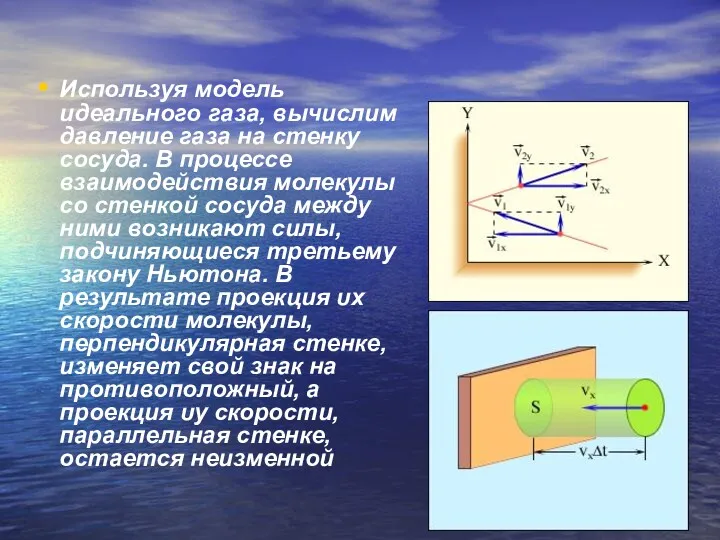
- 17. Используя модель идеального газа, вычислим давление газа на стенку сосуда. В процессе взаимодействия молекулы со стенкой
- 18. В результате многочисленных соударений молекул газа между собой и со стенками в сосуде, содержащем большое число
- 19. При этом все направления векторов скоростей молекул оказываются равноправными (равновероятными), а модули скоростей и их проекции
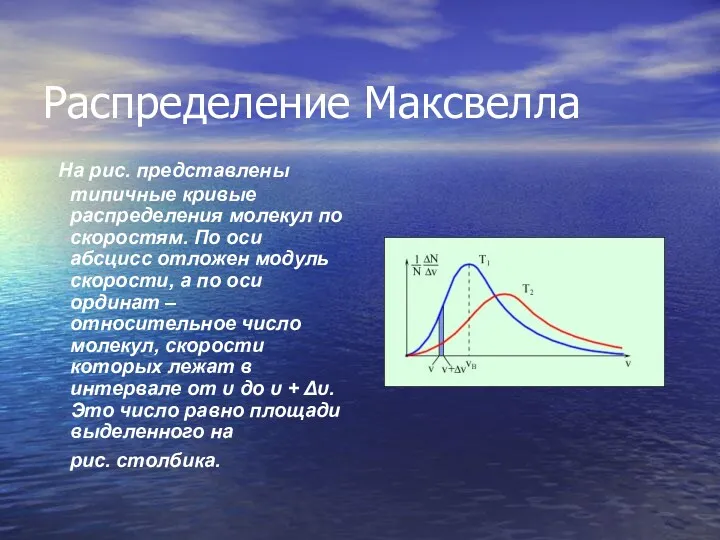
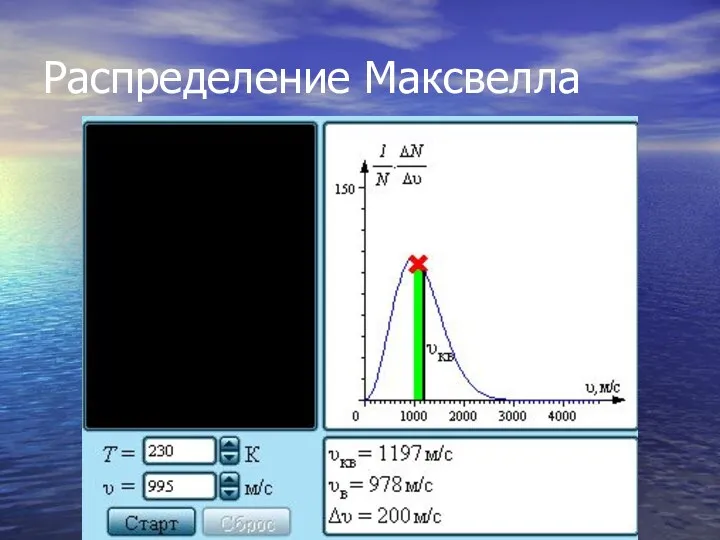
- 20. Распределение молекул газа по модулю скоростей называется распределением Максвелла (1860 г.). Дж. Максвелл вывел закон распределения
- 21. Распределение Максвелла На рис. представлены типичные кривые распределения молекул по скоростям. По оси абсцисс отложен модуль
- 22. Распределение Максвелла
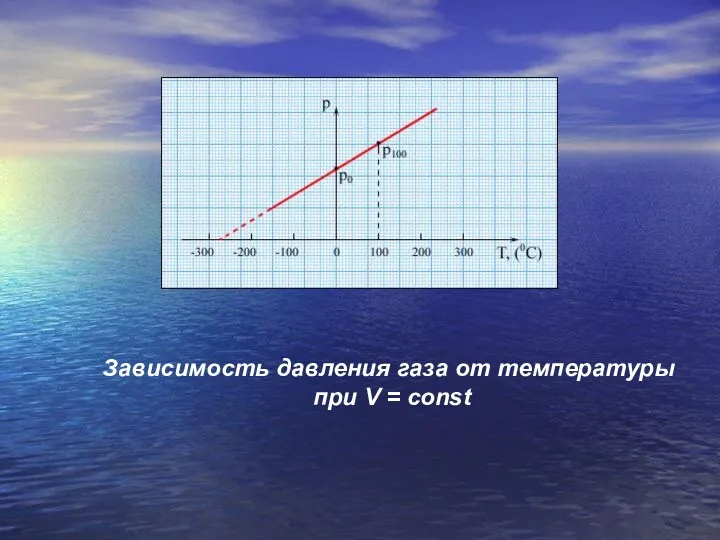
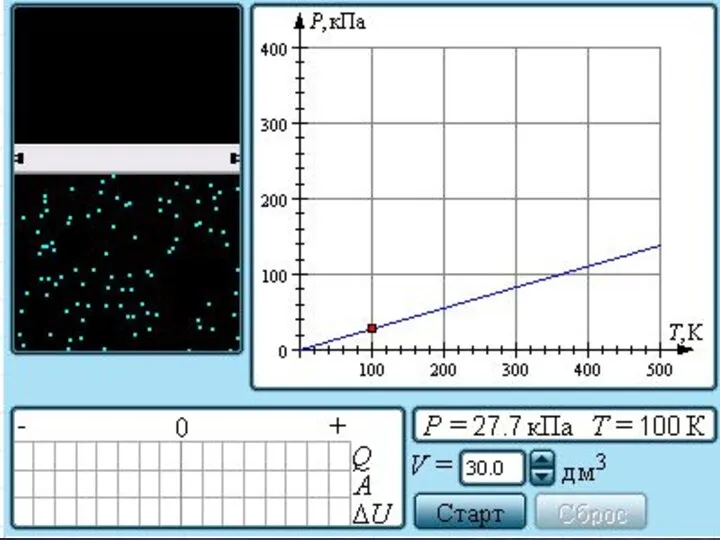
- 23. Зависимость давления газа от температуры при V = const
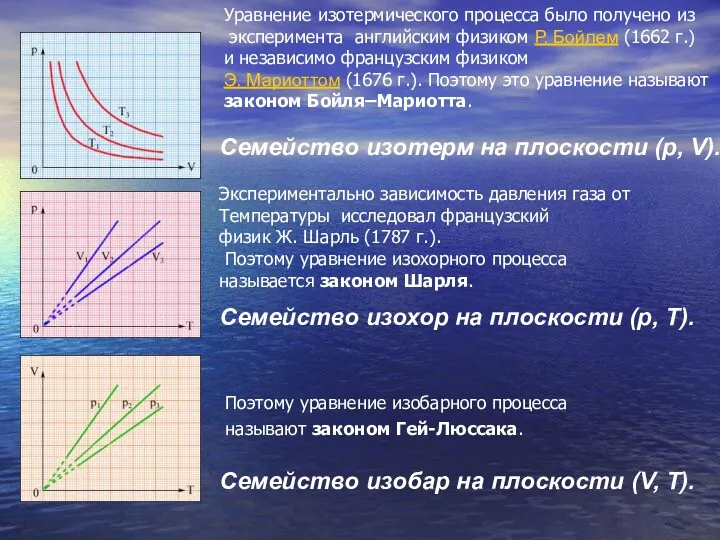
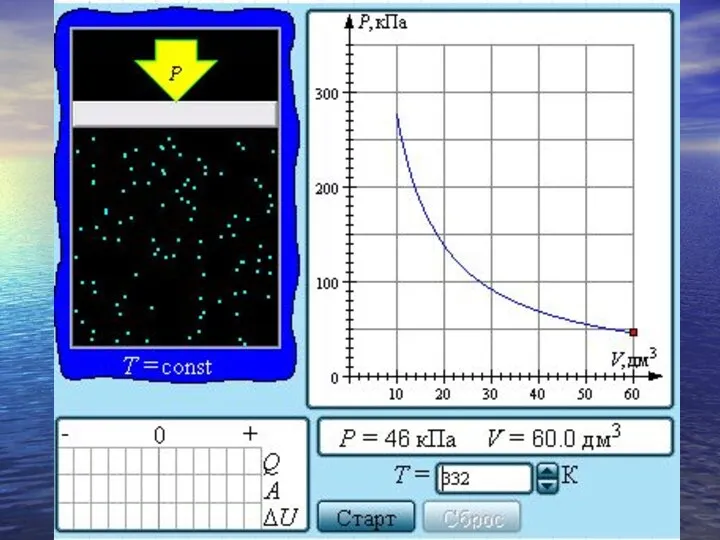
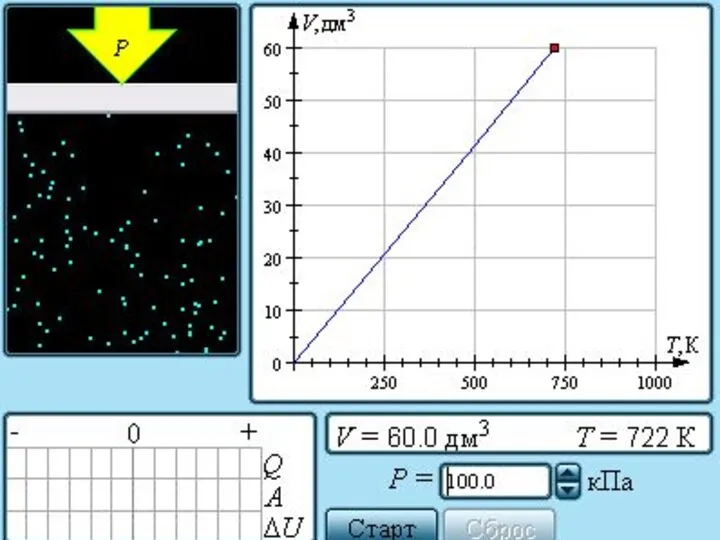
- 24. Семейство изобар на плоскости (V, T). Семейство изохор на плоскости (p, T). Семейство изотерм на плоскости
- 28. Экспериментально установленные законы Бойля–Мариотта, Шарля и Гей-Люссака находят объяснение в молекулярно-кинетической теории газов. Они являются следствием
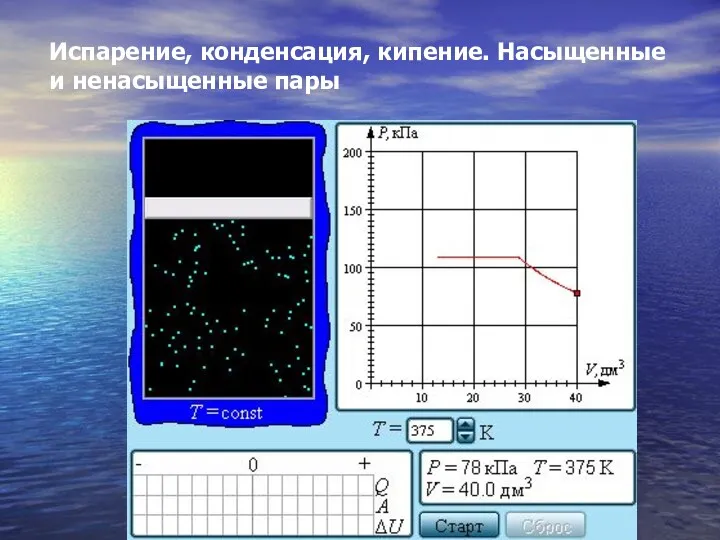
- 29. Испарение, конденсация, кипение. Насыщенные и ненасыщенные пары
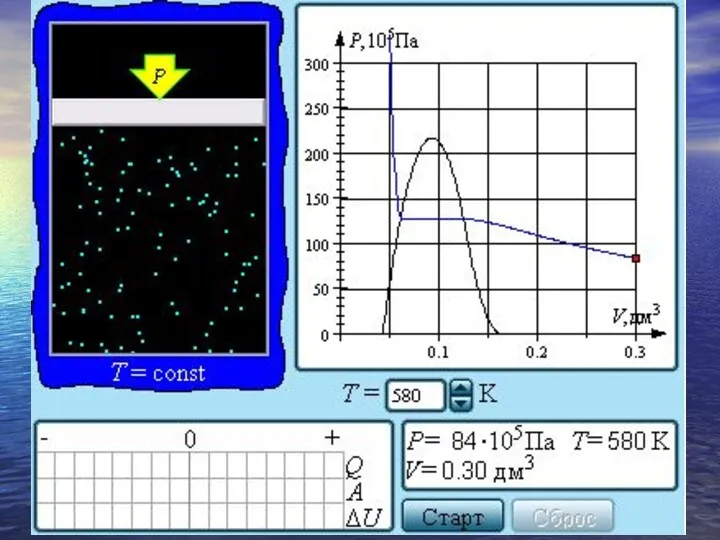
- 30. Если изотермически сжимать ненасыщенный пар при T
- 33. Скачать презентацию


















 Закон Ома для полной цепи
Закон Ома для полной цепи Electric Vehicles 101
Electric Vehicles 101 PID controller Design
PID controller Design Плотность вещества
Плотность вещества Тепловое равновесие. Температура и ее измерение.
Тепловое равновесие. Температура и ее измерение. Презентация Использование Использование Excel
Презентация Использование Использование Excel Конструирование элементов ременных и цепных передач
Конструирование элементов ременных и цепных передач Интерференция света. Когерентность
Интерференция света. Когерентность Движение тел под действием силы тяжести
Движение тел под действием силы тяжести Електромагнітні хвилі
Електромагнітні хвилі Организация топливного участка на СТО
Организация топливного участка на СТО Электронные фильтры
Электронные фильтры Взаимодействие ионизирующего излучения с веществом
Взаимодействие ионизирующего излучения с веществом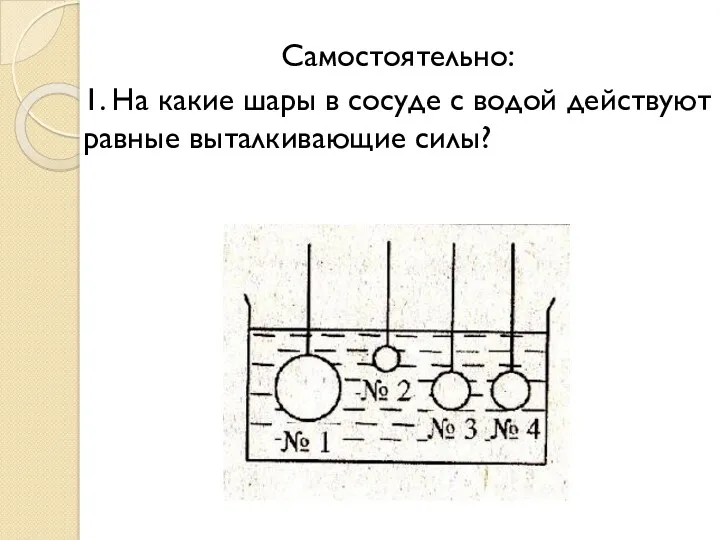 Архимедова сила
Архимедова сила Русские народные игры (презентация)
Русские народные игры (презентация) Готорвимся к ЕГЭ. Физика
Готорвимся к ЕГЭ. Физика Закон инерции. Первый закон Ньютона (7класс)
Закон инерции. Первый закон Ньютона (7класс) Изображения, даваемые линзой
Изображения, даваемые линзой Магнітостатичні хвилі в багатошарових структурах
Магнітостатичні хвилі в багатошарових структурах Тест по теме Магнитное поле 9 класс
Тест по теме Магнитное поле 9 класс Ремонт автомобилей. Ремонт головок цилиндров и распределительных валов. (Тема 4.6)
Ремонт автомобилей. Ремонт головок цилиндров и распределительных валов. (Тема 4.6) Требования к машинам и деталям
Требования к машинам и деталям Қозғалтқыш жалпы түсінік. Қозғалтқыштың құрылысы
Қозғалтқыш жалпы түсінік. Қозғалтқыштың құрылысы Механическая энергия. Кинетическая и потенциальная энергия. Закон сохранения энергии
Механическая энергия. Кинетическая и потенциальная энергия. Закон сохранения энергии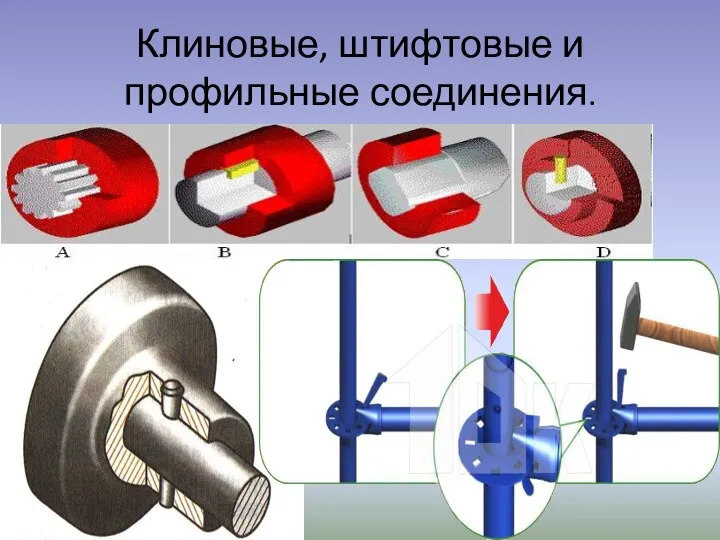 Клиновые, штифтовые и профильные соединения
Клиновые, штифтовые и профильные соединения Электрический ток в вакууме
Электрический ток в вакууме Введение в физику
Введение в физику Формула Мора. Правило Верещагина
Формула Мора. Правило Верещагина