1. Макроскопическая работа при тепловых процессах
Элементарная работа системы, в которой происходит
равновесный термодинамический процесс, сопровождающийся элементарным приращением объема системы dV:
р – равновесное значение давления в системе.
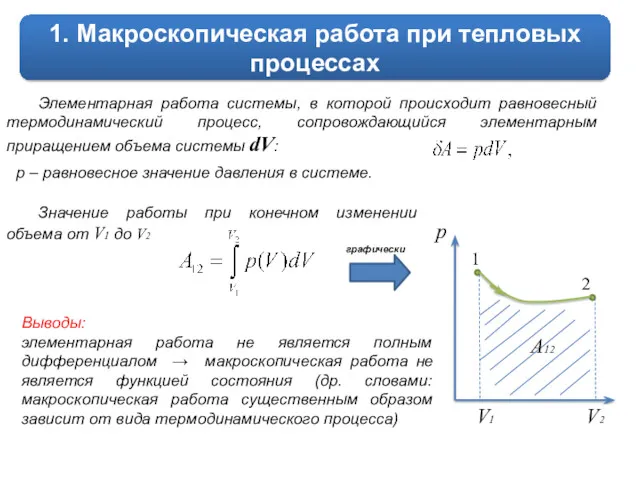
Значение работы при конечном изменении объема от V1 до V2
графически
Выводы:
элементарная работа не является полным дифференциалом → макроскопическая работа не является функцией состояния (др. словами: макроскопическая работа существенным образом зависит от вида термодинамического процесса)









 Коробка передач. Назначение, конструкции
Коробка передач. Назначение, конструкции Инфракрасная спектроскопия
Инфракрасная спектроскопия 丰田海狮格兰维亚安装-中英文
丰田海狮格兰维亚安装-中英文 презентация к внеклассному мероприятию Знатоки физики
презентация к внеклассному мероприятию Знатоки физики Проводники в электростатическом поле
Проводники в электростатическом поле Теория симметричного вибратора
Теория симметричного вибратора Тела и вещества презентация к уроку естествознание 5 класс ФГОС
Тела и вещества презентация к уроку естествознание 5 класс ФГОС Магнитное поле
Магнитное поле Сравнение выхода 99Mo активационным методом на спектрах промышленных реакторов
Сравнение выхода 99Mo активационным методом на спектрах промышленных реакторов Тема 3 Лекция 2 Структурные уровни и системная организация материи
Тема 3 Лекция 2 Структурные уровни и системная организация материи Тест по теме Магнитное поле 9 класс
Тест по теме Магнитное поле 9 класс Расчет и проектирование элементов механического измельчения отходов
Расчет и проектирование элементов механического измельчения отходов Презентация по теме Внутренняя энергия и способы ее изменения8кл
Презентация по теме Внутренняя энергия и способы ее изменения8кл Интегрированный урок (физика – экология) в 8 классе по теме: Тепловые двигатели и охрана окружающей среды
Интегрированный урок (физика – экология) в 8 классе по теме: Тепловые двигатели и охрана окружающей среды Основные характеристики звезд
Основные характеристики звезд Знаменитые лаборатории мира
Знаменитые лаборатории мира Основные зависимости для определения прочности конструкций
Основные зависимости для определения прочности конструкций Световая волна. Интерференция света. Когерентность
Световая волна. Интерференция света. Когерентность Основные положения сопротивления материалов
Основные положения сопротивления материалов Закон всемирного тяготения
Закон всемирного тяготения Конструкционные материалы на основе легких металлов: сплавы бериллия
Конструкционные материалы на основе легких металлов: сплавы бериллия Квантовые свойства света
Квантовые свойства света Импульс тела. Закон сохранения
Импульс тела. Закон сохранения урок в 7 классе по теме Плотность вещества
урок в 7 классе по теме Плотность вещества Шпоночное и штифтовое соединения
Шпоночное и штифтовое соединения Основные положения МКТ. Термодинамические параметры
Основные положения МКТ. Термодинамические параметры Влияние мобильного телефона на здоровье школьника
Влияние мобильного телефона на здоровье школьника Физические диктанты
Физические диктанты