Содержание
- 2. Цель урока: Расширить знания учащихся по вопросу строения атома Изучить фундаментальный эксперимент английского физика Э. Резерфорда
- 3. Актуализация знаний Что вам известно о строении вещества? Как мы узнаем о строении вещества? Каково строение
- 4. Гипотеза о том, что вещества состоят из большого числа атомов, зародилась свыше двух тысячелетий назад. «Существует
- 5. Ломоносов Михаил Васильевич (8/19.11.1711 - 4/15.04.1765 ) М. В. Ломоносов утверждает, что все вещества состоят из
- 6. Конкретные представления о строении атома развивались по мере накопления физикой фактов о свойствах вещества. 1888 г.
- 7. В 1904 году японский физик Хантаро Нагаока предложил модель атома, построенную по аналогии с планетой Сатурн.
- 8. Модель строения атома Томсона Атом – шар, по всему объёму которого равномерно распределён положительный заряд. Внутри
- 9. Модель строения атома Томсона «пудинг с изюмом»
- 10. Модель Томсона нуждалась в экспериментальной проверке. Важно было убедиться, действительно ли положительный заряд распределён по всему
- 11. Резерфорд Эрнест (1871–1937) – английский физик, основоположник ядерной физики. Его исследования посвящены атомной и ядерной физике,
- 12. Идея опыта Резерфорда: Зондировать атом альфа - α–частицами. α-частицы возникают при распаде радия. Масса α-частицы в
- 15. Статистика вспышек
- 16. Результаты опытов : Подавляющая часть α-частиц - более 90% -проходит сквозь фольгу практически без отклонения или
- 17. Обнаружилось, что некоторые α-частицы отклонялись на большие углы, до 180º. Резерфорд понял, что такое отклонение возможно
- 18. Выводы из опытов: Положительный заряд сосредоточен в малой части атома – ядре; Практически вся масса атома
- 19. На основе выводов из опытов Резерфордом была предложена планетарная модель атома Конец ХIХ - начало ХХ
- 20. Выводы: В центре атома находится положительно заряженное ядро, вокруг которого вращаются по определенным орбитам электроны. Основная
- 21. Недостатки модели атома Резерфорда Данная модель не согласуется с наблюдаемой стабильностью атомов. По законам классической электродинамики
- 22. Попыткой спасения планетарной модели атома стали постулаты Нильса Бора (07.10.1885 г. – 08.11.1962 г.)
- 23. 1922 г. - Нильсу Бору присуждена Нобелевская премия
- 24. I постулат: Атомная система может находиться только в особых стационарных или квантовых состояниях, каждому из которых
- 25. II постулат: Излучение света атомом происходит при переходе атома из стационарного состояния с большей энергией Em
- 26. Энергетический уровень – энергия, которой обладает атомный электрон в определенном квантовом состоянии. Основное состояние атома –
- 27. Частота излучения или поглощения
- 29. Линейчатые спектры – излучения - поглощения
- 30. h =h/2π =1,05*10-34 Дж – приведенная постоянная Планка; n – главное квантовое число; при n =1
- 32. На длине окружности каждой стационарной орбиты укладывается целое число n длин волн де Бройля , соответствующих
- 33. Строение атома вещество молекула атом ядро электроны нуклоны протоны нейтроны кварки
- 34. Луи де Бройль ДИРАК ПОЛЬ АДРИЕН МОРИС Вернер Карл Гейзенберг Эрвин Шрёдингер
- 35. Вопросы на закрепление: 1. В чём заключается сущность модели Томсона? 2. В чём заключалась идея опыта
- 36. Проверим себя Минитест 1. В атоме кремния 14 электронов. Выберите правильное утверждение. А. В ядре атома
- 37. Домашнее задание: § 74, 75, стр. 288 - Задания ЕГЭ
- 39. Скачать презентацию




































 Расчет СЭС общественных зданий. (Лекция 6)
Расчет СЭС общественных зданий. (Лекция 6) Система параллельных сил и пар
Система параллельных сил и пар Твердотельная и оптическая электроника
Твердотельная и оптическая электроника Lektsia_16_Fotoeffekt
Lektsia_16_Fotoeffekt Звук. Характеристики звука
Звук. Характеристики звука Урок: Параллельное соединение проводников
Урок: Параллельное соединение проводников Получение компактных нанокристаллических материалов
Получение компактных нанокристаллических материалов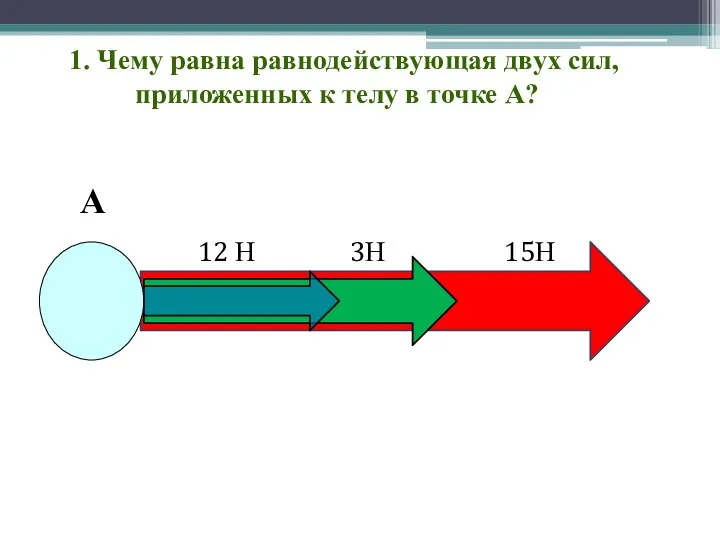 Чему равна равнодействующая двух сил, приложенных к телу в точке А?
Чему равна равнодействующая двух сил, приложенных к телу в точке А? Жидкостная хроматография Waters Breeze
Жидкостная хроматография Waters Breeze Состав атомного ядра. Изотопы. Ядерные силы
Состав атомного ядра. Изотопы. Ядерные силы Механические процессы обработки металлов: протягивание
Механические процессы обработки металлов: протягивание Критерии совершенства конструкций. Лекция 3
Критерии совершенства конструкций. Лекция 3 Действия электрического тока
Действия электрического тока Постоянные магниты. Магнитное поле Земли. Опыты
Постоянные магниты. Магнитное поле Земли. Опыты Презентация к уроку 10 класс Положения МКТ
Презентация к уроку 10 класс Положения МКТ Давление. Единицы давления
Давление. Единицы давления Гамма-сәуле шығару
Гамма-сәуле шығару Презентация к уроку по теме Электромагнитная индукция 11 клас
Презентация к уроку по теме Электромагнитная индукция 11 клас Неподвижные элементы и неисправности газораспределительных механизмов
Неподвижные элементы и неисправности газораспределительных механизмов Проектировочный расчет закрытой зубчатой передачи
Проектировочный расчет закрытой зубчатой передачи Физические основы механики. Элементы кинематики
Физические основы механики. Элементы кинематики Работа. Энергия. Механика
Работа. Энергия. Механика Фотогальванический эффект в p-n переходе. Фотодиод. Фотоэлемент. Солнечная батарея
Фотогальванический эффект в p-n переходе. Фотодиод. Фотоэлемент. Солнечная батарея Оптические измерения. Введение. Основные термины и определения. Погрешности измерений
Оптические измерения. Введение. Основные термины и определения. Погрешности измерений презентация к уроку физики 8 кл. по теме Испарение и конденсация УМК Л.С.Хижнякова
презентация к уроку физики 8 кл. по теме Испарение и конденсация УМК Л.С.Хижнякова Кипение. Влажность воздуха. Способы определения влажности воздуха
Кипение. Влажность воздуха. Способы определения влажности воздуха колебательное движение
колебательное движение Механические свойства материалов. Диаграммы растяжения и сжатия. (Лекция 4)
Механические свойства материалов. Диаграммы растяжения и сжатия. (Лекция 4)