Содержание
- 2. План лекции Предмет термодинамики. Термодинамическая система, состояние, процесс. Параметры уравнения состояния макроскопической системы. Количество вещества, объём,
- 3. Атомная гипотеза Если бы в результате какой-то мировой катастрофы все накопленные научные знания оказались бы уничтоженными
- 4. Броуновское движение Молекулы всякого вещества находятся в беспорядочном, хаотическом движении без выделенного направления. Интенсивность движения зависит
- 5. Броуновское движение частиц – экспериментальное доказательство теплового движения. Опыт Ж. Перрена (1909 г.) Броуновское движение (по
- 6. Термодинамика Термодинамика – наука о наиболее общих свойствах макроскопических систем, находящихся в состоянии термодинамического равновесия и
- 7. Термодинамическое равновесие Общее начало термодинамики: Любая система при неизменных внешних условиях приходит в некоторое состояние, в
- 8. Статистическая физика Статистическая или молекулярная физика даёт обоснование принципов термодинамики и их связь с законами движения
- 9. Масса и размеры молекул Один моль – количество вещества, содержащего NA = 6,02 1023 молекул. NA
- 10. Состав воздуха по массе: N2 – 75,5%; O2 – 23,2%; Ar – 1,3%; остальные газы –
- 11. Основные определения Система – совокупность частиц, которые могут взаимодействовать между собой и с другими телами (внешней
- 12. Микро- и макросостояния Микросостояние – это состояние системы, определяемое заданием координат и импульсов всех частиц системы.
- 13. Уравнение состояния. Процесс, квазистатический процесс. Уравнение состояния – это функциональная зависимость, связывающая друг с другом давление
- 14. Температура: идеально-газовая шкала Температура - мера «нагретости» тела. Идеально-газовая шкала. Для одного моля: PV = R(t
- 15. Идеальный газ: PV = νRT. Уравнение состояния идеального газа – уравнение Клапейрона: PV = νRT, ν
- 16. Молекулярно-кинетический смысл температуры εпост = 3/2 kT Модель: идеальный газ – газ невзаимодействующих упругих шариков. Давление
- 17. Барометрическая формула P = P0e-mgz/kT Распределение Больцмана Барометрическая формула – зависимость давления от высоты Р =
- 18. Средняя потенциальная энергия молекул газа в поле тяжести Для дискретной величины среднее значение (математическое ожидание): =
- 19. Опыт Ж. Перрена или как определили число Авогадро Для определения числа Авогадро Ж.Перрен измерял распределение по
- 20. Результат Потенциальная энергия с учётом силы Архимеда: u = u(z) = (m – mв)gz = m*gz;
- 21. Распределение Максвелла – распределение Гаусса Гаусс φ(x) = 1/(2π)1/2σ exp(-x2/2σ2) распределение большого количества независимых случайных величин
- 22. Характерные скорости Средний модуль х-ой компоненты скорости: = ∫|vx|dw = ∫|vx|φ(vx)dvx = 2 ∫vxφ(vx)dvx = (2kT/πm)1/2
- 23. Характерные скорости Наиболее вероятная скорость для абсолютного значения: F'(v) = 0 ⇨ vвер = (2kT/m)1/2 Средний
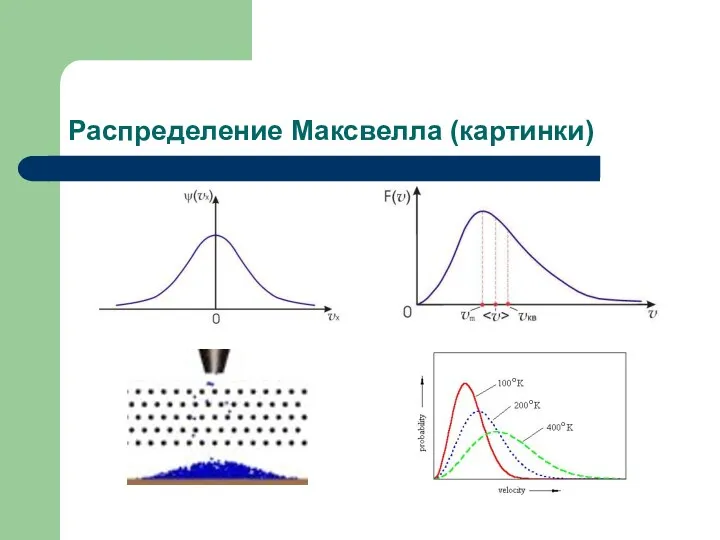
- 24. Распределение Mаксвелла (картинки)
- 25. Среднее число ударов молекул о стенку плотность потока частиц dj = vxdn(vx) = vxφ(vx)dvx → j
- 26. Вращательная энергия ε = ½ Izωz2 Средняя энергия вращения молекулы вокруг оси z: = ½ Iz
- 27. Важные константы и полезные соотношения Универсальная газовая постоянная: R = 8,31451 Дж/моль К = 1,9872 кал/моль
- 28. Полезные формулы Интеграл Пуассона: In= ∫0 ξne-ξ2dξ I0 = ∫0 e-ξ2dξ = ½π1/2 I1 = I3
- 29. Жан Батист Перрен (1870-1942)
- 31. Скачать презентацию



























 Плавання тіл. Закон Архімеда
Плавання тіл. Закон Архімеда Методы анализа переходных процессов в линейных цепях со сосредоточенными параметрами
Методы анализа переходных процессов в линейных цепях со сосредоточенными параметрами Масс-спектрометрия с индуктивно связанной плазмой (ИСП-МС)
Масс-спектрометрия с индуктивно связанной плазмой (ИСП-МС) Презентация к уроку Изменение агрегатных состояний вещества
Презентация к уроку Изменение агрегатных состояний вещества Лазеры и их применение
Лазеры и их применение Допоміжне устаткування холодильних машин
Допоміжне устаткування холодильних машин Тепловизоры. История создания тепловизора
Тепловизоры. История создания тепловизора Нарезание резьбы на металлических деталях
Нарезание резьбы на металлических деталях Магнитное поле тока
Магнитное поле тока Автосцепка. Назначение автосцепных устройств
Автосцепка. Назначение автосцепных устройств Предмет физика. Измерение физических величин. Погрешности
Предмет физика. Измерение физических величин. Погрешности Никола Тесла
Никола Тесла Методы электрофизической и электрохимической обработки поверхностей заготовок
Методы электрофизической и электрохимической обработки поверхностей заготовок Экспериментальные факты, лежащие в основе теории магнетизма
Экспериментальные факты, лежащие в основе теории магнетизма Законы постоянного тока. Законы Кирхгофа
Законы постоянного тока. Законы Кирхгофа Транспортирующие машины. (Лекция № 5)
Транспортирующие машины. (Лекция № 5) История создания швейной машинки
История создания швейной машинки Энергия. Работа. Мощность
Энергия. Работа. Мощность Правила по уходу за велосипедом
Правила по уходу за велосипедом Презентация по физике Реактивное движение. 9 класс
Презентация по физике Реактивное движение. 9 класс Методы наблюдения и регистрации элементарных частиц
Методы наблюдения и регистрации элементарных частиц Презентация Параллельное соединение проводников
Презентация Параллельное соединение проводников Урок - исследование. Воздух и его свойства. Воздушная оболочка Земли
Урок - исследование. Воздух и его свойства. Воздушная оболочка Земли Як був винайденний блискавковідвід
Як був винайденний блискавковідвід Теорема о кинетической энергии
Теорема о кинетической энергии Презентация к уроку Электрический ток
Презентация к уроку Электрический ток Математические модели движения ракет класса поверхность-поверхность в плотных слоях атмосферы
Математические модели движения ракет класса поверхность-поверхность в плотных слоях атмосферы Сопротивление в цепи переменного тока
Сопротивление в цепи переменного тока