Содержание
- 2. Электрический ток может протекать в пяти различных средах: Металлах Вакууме Полупроводниках Жидкостях Газах
- 3. Жидкости по степени электропроводности делятся на: диэлектрики (дистиллированная вода) проводники (электролиты) полупроводники (расплавленный селен)
- 4. Электрический ток в жидкостях Электролитами принято называть проводящие среды, в которых протекание электрического тока сопровождается переносом
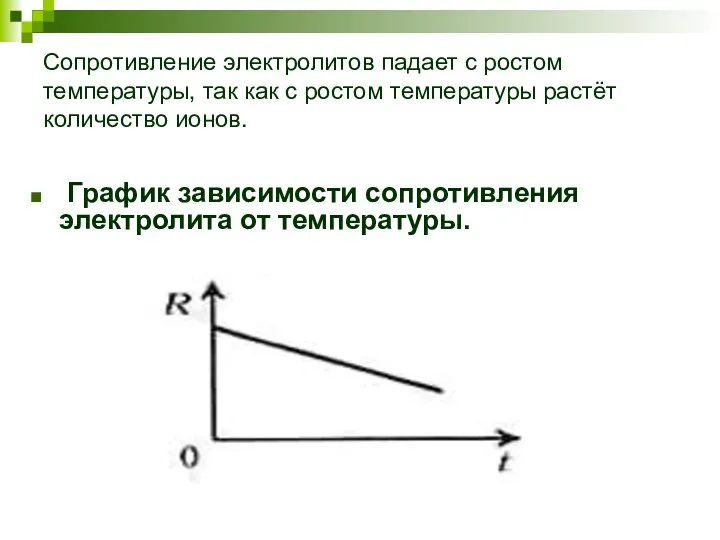
- 5. Сопротивление электролитов падает с ростом температуры, так как с ростом температуры растёт количество ионов. График зависимости
- 6. Электролитическая диссоциация - при растворении в результате теплового движения происходят столкновения молекул растворителя и нейтральных молекул
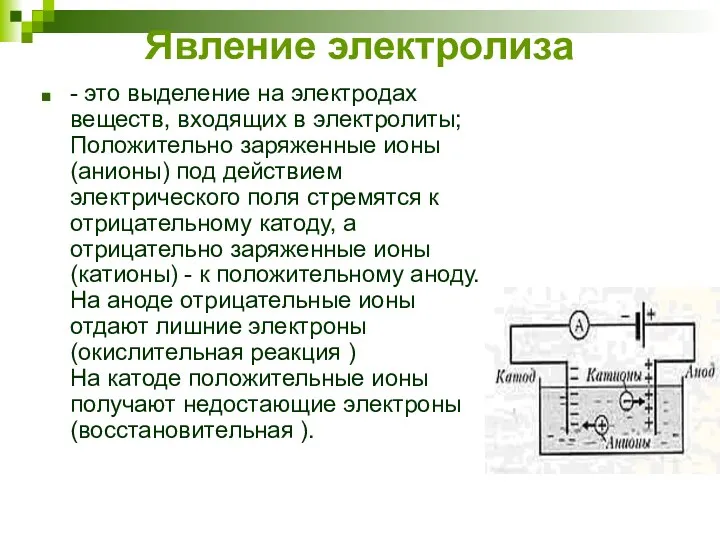
- 7. Явление электролиза - это выделение на электродах веществ, входящих в электролиты; Положительно заряженные ионы (анионы) под
- 8. Законы электролиза Фарадея. Законы электролиза определяют массу вещества, выделяемого при электролизе на катоде или аноде за
- 10. Скачать презентацию





 Холодильні машини
Холодильні машини Зрение
Зрение Масса. Взаимодействие тел
Масса. Взаимодействие тел Проектирование участка для ремонта двигателя внутреннего сгорания трактора Т-40М ремонтного предприятия на 200 тракторов в год
Проектирование участка для ремонта двигателя внутреннего сгорания трактора Т-40М ремонтного предприятия на 200 тракторов в год Тепловое излучение
Тепловое излучение Водяной пар
Водяной пар Технологія матеріалів
Технологія матеріалів Магнит өрісінің тогы бар өткізгішке әрекеті. Электрқозғалтқыштар. Электр өлшеуіш аспаптар
Магнит өрісінің тогы бар өткізгішке әрекеті. Электрқозғалтқыштар. Электр өлшеуіш аспаптар Магнитное поле
Магнитное поле Презентация Откуда берётся звук.
Презентация Откуда берётся звук. Детектирование нейтронов
Детектирование нейтронов Кинематика. Лекция 1-1
Кинематика. Лекция 1-1 Переменный ток.Производство, передача и потребление электроэнергии.
Переменный ток.Производство, передача и потребление электроэнергии. Презентация Работа сил электрического поля
Презентация Работа сил электрического поля Плоское движение твёрдого тела
Плоское движение твёрдого тела Открытый урок по теме: Архимедова сила
Открытый урок по теме: Архимедова сила Шкала электромагнитных излучений
Шкала электромагнитных излучений Фазированные антенные решетки и их назначение. Типы диаграммоформирования
Фазированные антенные решетки и их назначение. Типы диаграммоформирования Преимущества и недостатки использования оптических волокон в системах связи
Преимущества и недостатки использования оптических волокон в системах связи 10 класс Презентация по физике на тему Транзисторы
10 класс Презентация по физике на тему Транзисторы Приборы электромагнитной и электродинамической систем
Приборы электромагнитной и электродинамической систем Урок.Высота, тембр, громкость.
Урок.Высота, тембр, громкость. Физическая лаборатория
Физическая лаборатория Давление газов. Закон Паскаля
Давление газов. Закон Паскаля Работа спектрофотометра и определение оптической плотности вещества
Работа спектрофотометра и определение оптической плотности вещества Электростатика. Лекция 13
Электростатика. Лекция 13 Моторизованный микроскоп. Съемка живых клеток
Моторизованный микроскоп. Съемка живых клеток Локомотивтің механикалық бөлігінде пневматикалық элементтердің орналасуы
Локомотивтің механикалық бөлігінде пневматикалық элементтердің орналасуы