Содержание
- 2. Открытие радиоактивности 1895год В.К. Рентген поведал миру об икс-лучах. Эти лучи 22 декабря лучи заинтересовали Антуана
- 3. Радиоактивное излучение Радиоактивность появились на Земле со времени ее образования , и человек за всю историю
- 4. 1896г - открыл явление радиоактивности (способность атомов некоторых химических элементов к самопроизвольному излучению) Анри Беккерель
- 5. Открытие новых радиоактивных элементов Мария Склодовская-Кюри обнаружила излучения тория. Позже она с мужем открыла неизвестные ранее
- 6. Мария Склодовская-Кюри и Пьер Кюри. Полоний Радий (лучистый)
- 7. РАДИОАКТИВНЫЕ ПРЕВРАЩЕНИЯ Э. Резерфорд вместе с английским радиохимиком Ф. Содди доказал, что радиоактивность сопровождается самопроизвольным превращением
- 8. X – символ химического элемента A – массовое число Z – зарядовое число ОБОЗНАЧЕНИЕ ЯДРА АТОМА
- 9. Пояснение А – массовое число, это сумма протонов и нейтронов в ядре Z – зарядовое число,
- 11. Например В таблице Менделеева химический элемент Вольфрам А = 183, 85 ≈ 184 Z = 74
- 12. Например Pb – свинец (Plumbum) – по таблице Менделеева A = 214 Z = 82
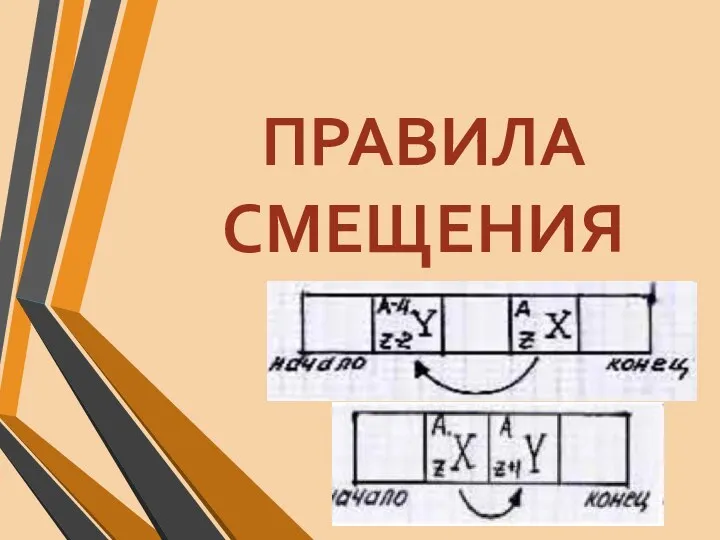
- 13. ПРАВИЛА СМЕЩЕНИЯ
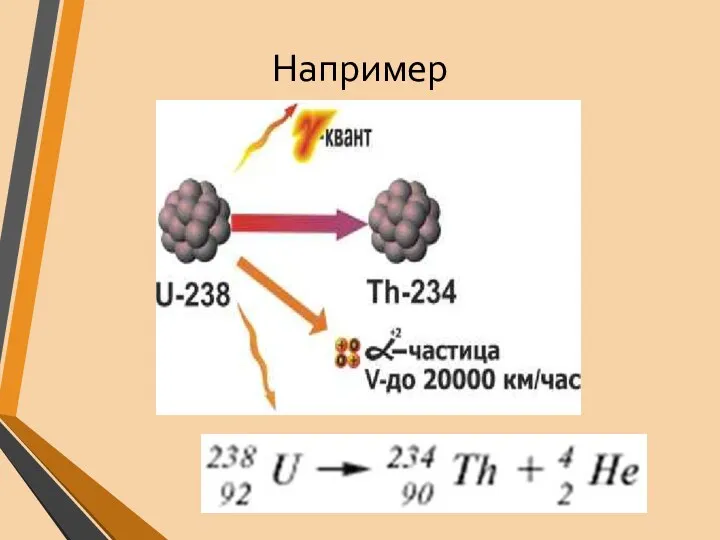
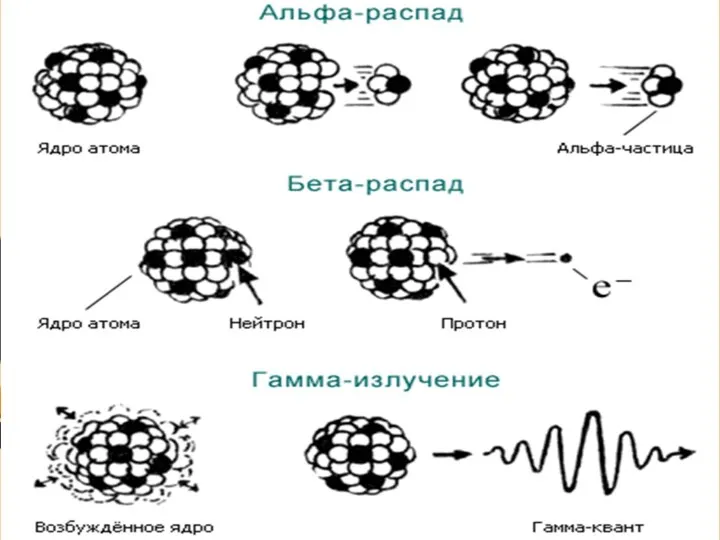
- 14. -альфа-частица (ядро атома гелия) - характерен для радиоактивных элементов с порядковым номером больше 83 - обязательно
- 15. Например
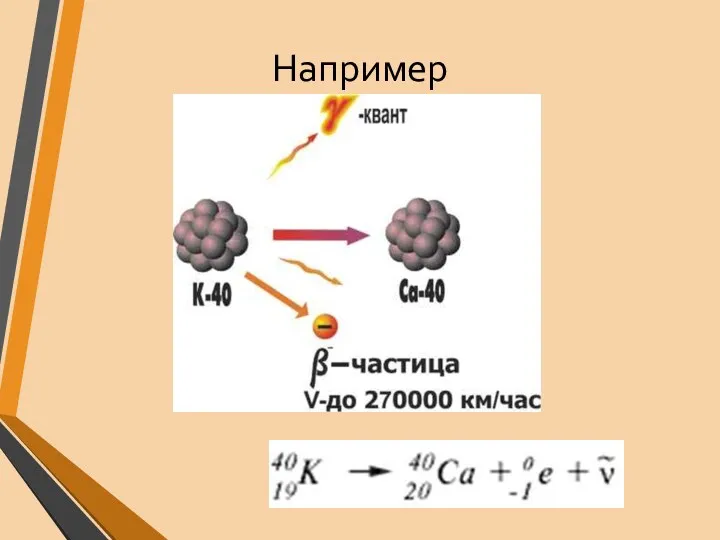
- 16. БЕТА - РАСПАД : - бета-частица (электрон). - часто сопровождается гамма-излучением. - может сопровождаться образованием антинейтрино
- 17. нейтрон в ядре атома может превращаться в протон, электрон и антинейтрино, в результате ядро излучает электрон.
- 18. Например
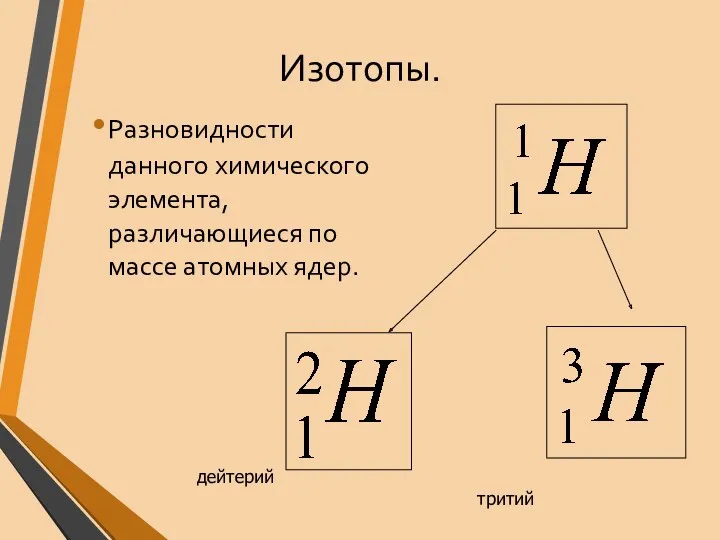
- 19. Изотопы. Разновидности данного химического элемента, различающиеся по массе атомных ядер. дейтерий тритий
- 21. Примеры α-распада и β-распада α-распад β-распад
- 22. 1. Определите ядро какого химического элемента образуется из углерода—14 в результате бета-распада. Решение задач
- 23. 1. Ответ
- 24. 2. Ядро изотопа Висмут-211 получилось из другого ядра после последовательных бета- и альфа-распадов. Что это за
- 25. 2. Ответ
- 26. 3. Сколько альфа- и бета-распадов происходит в результате превращения радия-226 в свинец-206? Решение задач
- 27. 3. Ответ
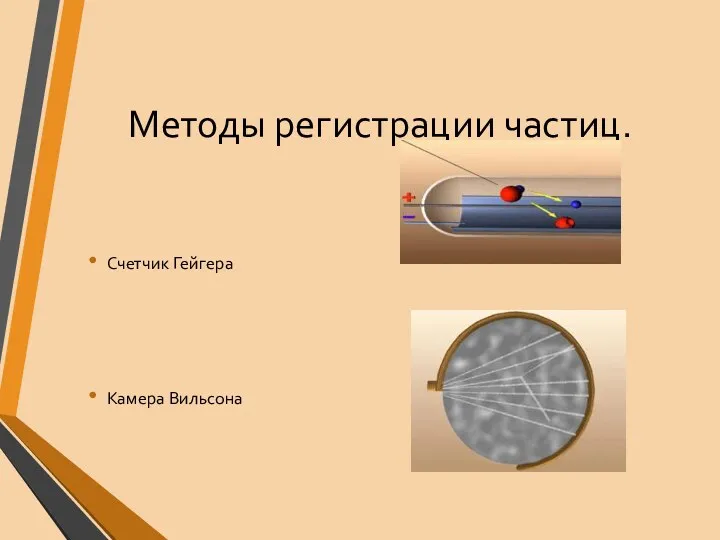
- 28. Методы регистрации частиц. Счетчик Гейгера Камера Вильсона
- 29. Деление атомного ядра. «Богатырь с короткими руками» Дефект масс ∆m ЭНЕРГИЯ !!! Отто Ган и Фриц
- 30. Цепная ядерная реакция
- 31. Неуправляемая цепная ядерная реакция. Водородная бомба Атомная бомба
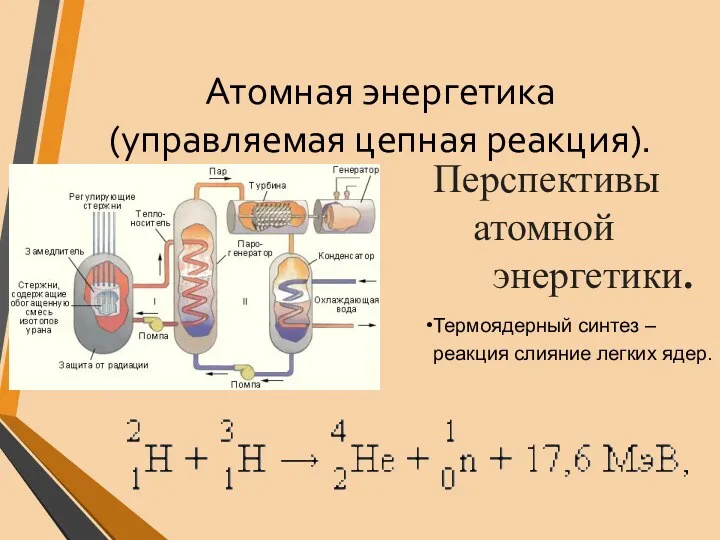
- 32. Атомная энергетика (управляемая цепная реакция). Перспективы атомной энергетики. Термоядерный синтез – реакция слияние легких ядер.
- 33. Игорь Васильевич Курчатов Главная идея научной деятельности - физика атомного ядра 1946г. – первый европейский реактор
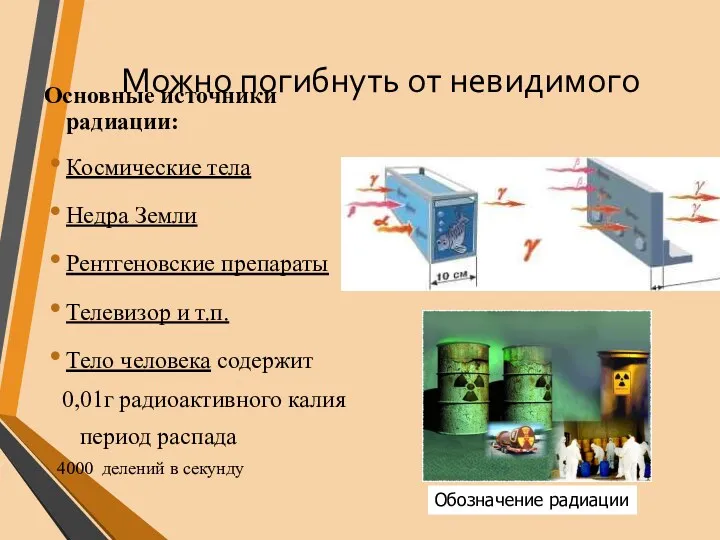
- 34. Можно погибнуть от невидимого Основные источники радиации: Космические тела Недра Земли Рентгеновские препараты Телевизор и т.п.
- 36. Скачать презентацию
























 У кого на огороде картошка вкуснее?
У кого на огороде картошка вкуснее? Кремниевые подложки интегральных схем
Кремниевые подложки интегральных схем Основы вибродиагностики
Основы вибродиагностики Лекция № 5. Спектральный анализ непериодических сигналов
Лекция № 5. Спектральный анализ непериодических сигналов Простые механизмы. Зубчатая передача
Простые механизмы. Зубчатая передача Датчик числа оборотов G28
Датчик числа оборотов G28 Колебания. Основные определения
Колебания. Основные определения Да здравствует физика!
Да здравствует физика! Методология времени
Методология времени Тертя. Сили тертя. Коефіцієнт тертя ковзання. Тертя в природій техніці
Тертя. Сили тертя. Коефіцієнт тертя ковзання. Тертя в природій техніці презентация к уроку плотность вещества
презентация к уроку плотность вещества Режимы работы электрооборудования
Режимы работы электрооборудования Шпоночное и штифтовое соединение
Шпоночное и штифтовое соединение История развития физики. Физика и техника
История развития физики. Физика и техника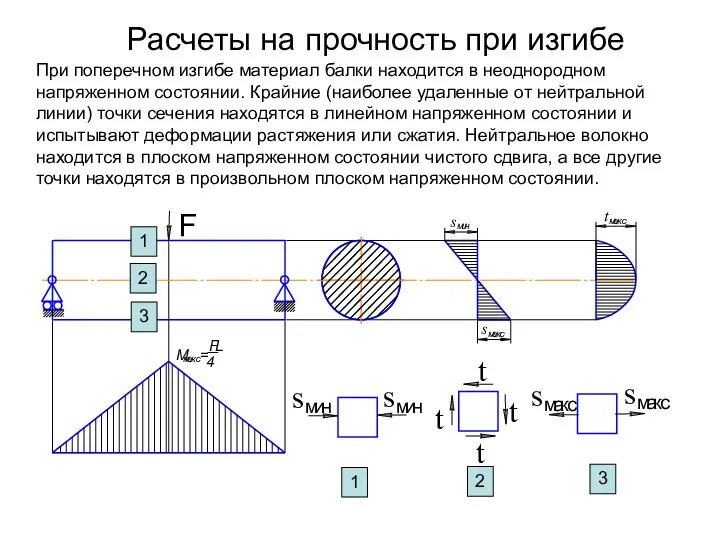 Расчеты на прочность при изгибе
Расчеты на прочность при изгибе Отдельные электроприемники в однофазной цепи переменного тока
Отдельные электроприемники в однофазной цепи переменного тока Задачи С1 ЕГЭ по физике
Задачи С1 ЕГЭ по физике Небесное и земное в звуках и красках
Небесное и земное в звуках и красках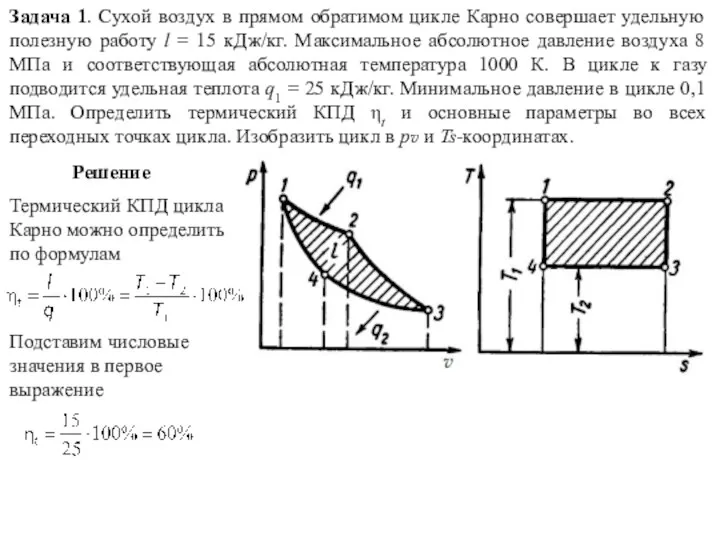 Задачи. Термодинамические циклы
Задачи. Термодинамические циклы Спектроскопические методы. Продолжение. Лекция 8
Спектроскопические методы. Продолжение. Лекция 8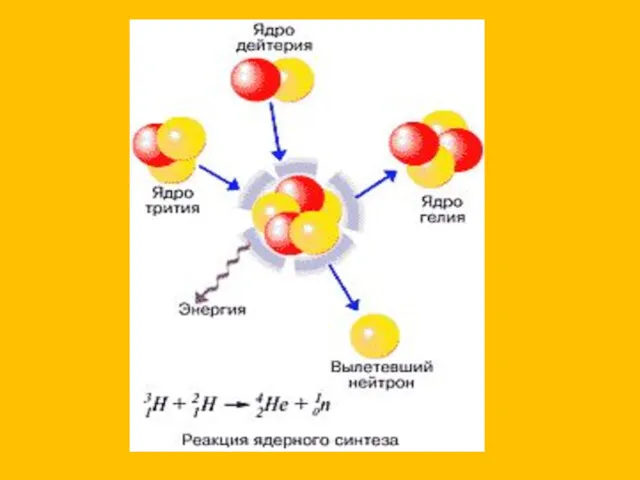 Термоядролық реакция
Термоядролық реакция Загальна характеристика історичного розвитку фізики як науки
Загальна характеристика історичного розвитку фізики як науки Электронная презентация Массы молекул и атомов
Электронная презентация Массы молекул и атомов Смачивание и капиллярные явления. Урок 6. Физика. 8 класс
Смачивание и капиллярные явления. Урок 6. Физика. 8 класс Механические процессы обработки металлов: протягивание
Механические процессы обработки металлов: протягивание Ремонт редуктора электропоезда
Ремонт редуктора электропоезда Перші автомобілі в історії
Перші автомобілі в історії Учебная практика (техническое обслуживание автомобилей)
Учебная практика (техническое обслуживание автомобилей)