Содержание
- 2. Растворение - это физико-химический процесс, а раствор – это гомогенная (однородная) система, состоящая из частиц растворенного
- 3. Доказательством химического взаимодействия служат такие признаки химических реакций, как выделение или поглощение тепла при растворении.
- 4. Признаки раствора: 1) Раствор содержит два или более компонентов. 2) Раствор – однородная система, в которой
- 5. Растворы Жидкость + Твердое вещество Жидкость + Жидкость Газ + Жидкость Твердое вещество + Твердое вещество
- 6. Растворимость вещества Растворимость твердых веществ при повышении температуры увеличивается. Растворимость газов с повышением температуры уменьшается. С
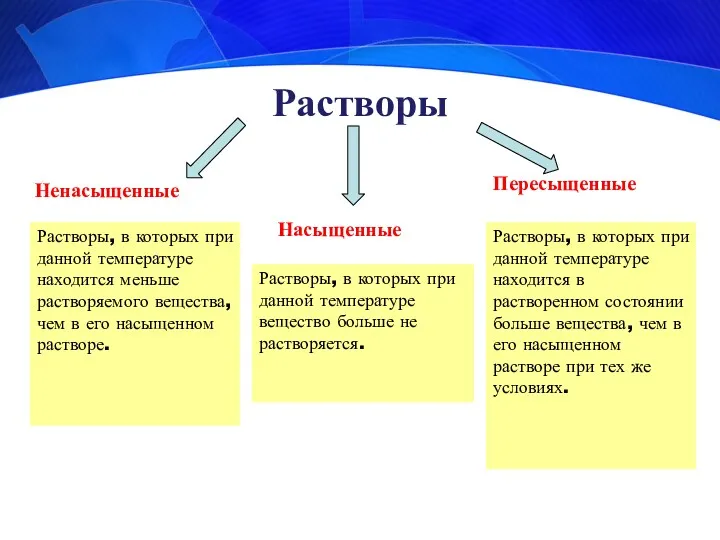
- 7. Растворы Ненасыщенные Насыщенные Пересыщенные Растворы, в которых при данной температуре вещество больше не растворяется. Растворы, в
- 8. Концентрация растворов
- 9. Массовая доля вещества в растворе (процентная концентрация)
- 10. m(р-ра) – масса раствора m(в) – масса растворенного вещества m(р-ля) – масса растворителя m(р-ра)= m(в) +
- 11. Массовая доля вещества в растворе: - массовая доля вещества в растворе
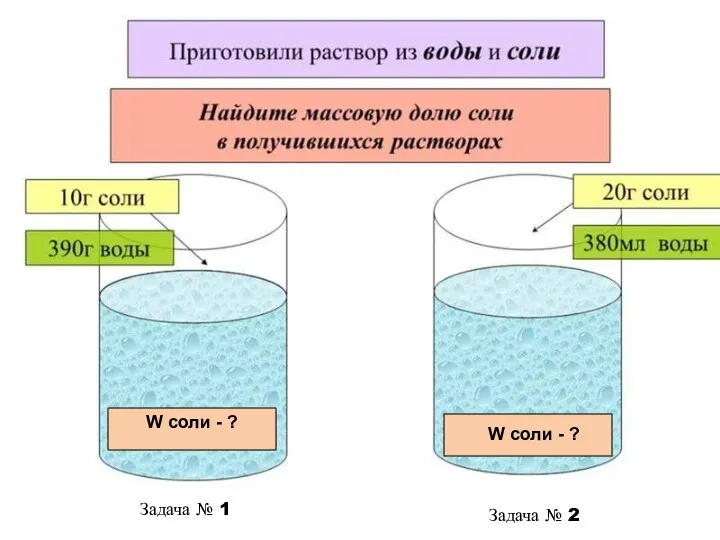
- 12. W соли - ? W соли - ? Задача № 1 Задача № 2
- 13. Дано: mв = 10г mр-ля = 390г ω - ? Решение: Ответ: ω = 2,5% Задача
- 14. Задача № 2 Дано: mв = 20г Vр-ля = 380мл ω - ? Решение: 1) mр-ля
- 15. Задачи на разбавление. К 120 г раствора с массовой долей соли 7% прилили 30 г воды.
- 17. Скачать презентацию












 Парогенераторы АЭС. Первичные теплоносители. (Тема 3)
Парогенераторы АЭС. Первичные теплоносители. (Тема 3) Сила трения
Сила трения Синтез наноматериалов золь-гель методом. (Лекция 5)
Синтез наноматериалов золь-гель методом. (Лекция 5) Nanophotonics class 4. Density of states
Nanophotonics class 4. Density of states Изопроцессы
Изопроцессы Сложение скоростей
Сложение скоростей ТРИЗ Электричество
ТРИЗ Электричество Все о ракетах
Все о ракетах Физика в профессии Слесарь по ремонту автомобилей
Физика в профессии Слесарь по ремонту автомобилей Электрооборудование автомобилей. Автоматическая коробка переключения передач с электронным управлением
Электрооборудование автомобилей. Автоматическая коробка переключения передач с электронным управлением Методы оптической молекулярной спектроскопии
Методы оптической молекулярной спектроскопии Types of Forces
Types of Forces Магнітне поле постійного струму
Магнітне поле постійного струму Внутренняя энергия. Первый закон термодинамики
Внутренняя энергия. Первый закон термодинамики Заттың агрегаттық күйлерінің өзгеруі. 8 сынып
Заттың агрегаттық күйлерінің өзгеруі. 8 сынып Тонкостенные оболочки. Основные допущения. Уравнение Лапласа. Лекция 8
Тонкостенные оболочки. Основные допущения. Уравнение Лапласа. Лекция 8 Тяговый расчет автомобиля
Тяговый расчет автомобиля Сообщающие сосуды
Сообщающие сосуды Лампа накаливания
Лампа накаливания Interest in the synthesis of metal nanoparticles by explosion
Interest in the synthesis of metal nanoparticles by explosion Электромагнитные колебания
Электромагнитные колебания Взаимодействие электромагнитных световых волн с веществом. Поляризация света. Виды поляризации
Взаимодействие электромагнитных световых волн с веществом. Поляризация света. Виды поляризации Полевые транзисторы FET (field-effect transistor). Устройство, принципы работы полевых транзисторов различных типов
Полевые транзисторы FET (field-effect transistor). Устройство, принципы работы полевых транзисторов различных типов Физика. Физические основы механики
Физика. Физические основы механики Критерії роботоздатності деталей машин. (Лекція 2)
Критерії роботоздатності деталей машин. (Лекція 2) Дыбыс, кең мағынасында
Дыбыс, кең мағынасында Magnit orici
Magnit orici Законы постоянного тока
Законы постоянного тока