Содержание
- 2. Розчини - однорідна багатокомпонентна система, що складається з розчинника, розчинених речовин і продуктів їх взаємодії. Розчини
- 3. Розчини Ненасичені Насичені Перенасичені
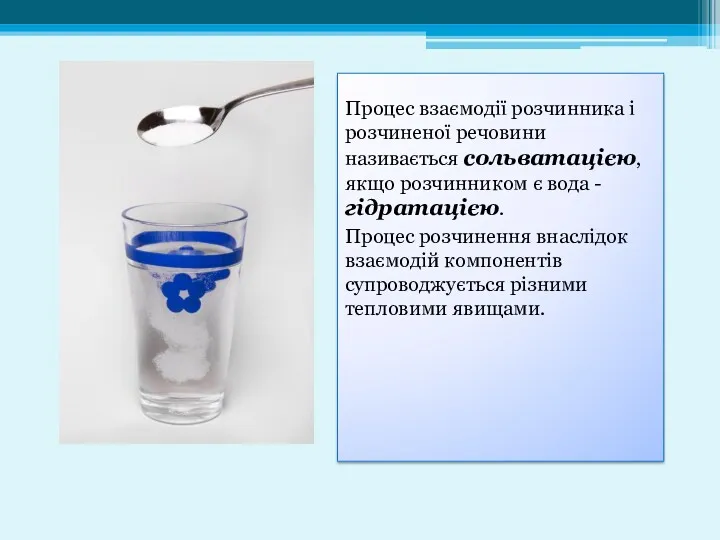
- 4. Процес взаємодії розчинника і розчиненої речовини називається сольватацією, якщо розчинником є вода - гідратацією. Процес розчинення
- 5. Процеси, що поглинають тепло: Руйнування кристалічної решітки, розриви хімічних зв'язків у молекулах; Процеси, що виділяють тепло:
- 6. Розчинністю - називається здатність речовини розчинятися в тому чи іншому розчиннику. Розчинність залежить від природи речовини
- 7. Р – добре розчинні речовини Наприклад: цукор, мідний купорос, гідроксид натрію, спирт, ацетон, хлороводень, аміак. М
- 8. Чинники, що впливають на розчинність Природа розчинника Зміна температури Зміна тиску
- 9. Концентрація розчинів Масова частка розчиненої речовини - це безрозмірна величина,що дорівнює відношенню маси розчиненої речовини до
- 10. Дисперсні системи – це системи, в яких одна речовина рівномірно розподілено у вигляді частинок всередині іншої
- 11. Суспензії - це дисперсні системи, в яких дисперсної фазою є тверда речовина, а дисперсним середовищем –
- 12. Емульсії - це дисперсні системи, в яких і дисперсна фаза і дисперсне середовище є рідинами, взаємно
- 13. Колоїдні розчини - це високодисперсні двофазні системи, що складаються з дисперсійного середовища і дисперсної фази, причому
- 14. Властивості колоїдних розчинів Наявність різного забарвлення Розсіювання світла частками - ефект Тиндаля Наявність однойменних електричних зарядів
- 15. Для осадження золю необхідно, щоб його частинки з'єдналися в більш великі агрегати. З'єднання часток в більш
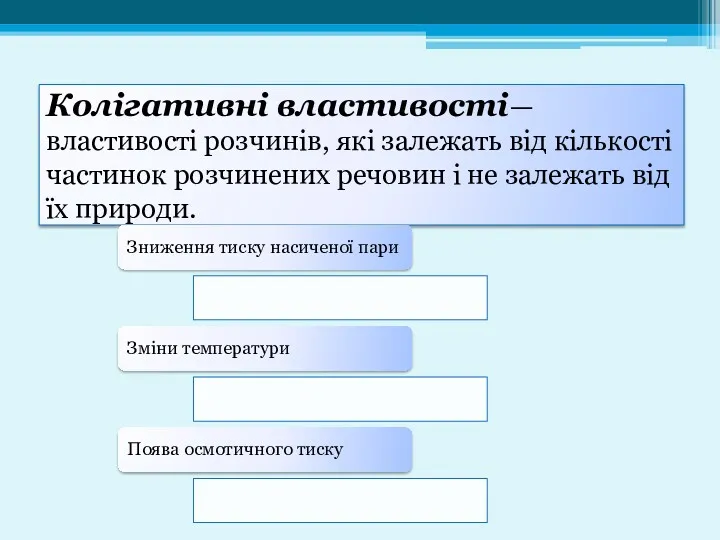
- 16. Колігативні властивості— властивості розчинів, які залежать від кількості частинок розчинених речовин і не залежать від їх
- 17. Зниження тиску насиченої пари розчину описується законом Рауля: відносне зниження тиску насиченої пари розчинника над розчином
- 18. Щоб кількісно оцінити збільшення температури кипіння і зменшення температури плавлення розчину, слід знайти температуру при якій,
- 19. Осмос— це спонтанний перехід чистого розчинника у розчин, відділений від нього напівпроникною мембраною. Значення осмотичного тиску
- 20. Причини застосування розчинів Ідеальне середовище для підведення чи відведення тепла в термічних реакціях; Рідини можуть розчиняти
- 22. Скачать презентацию

















 10 класс. Презентация по физике на тему Механические колебания
10 класс. Презентация по физике на тему Механические колебания Понятие о эпюрах гидростатического давления Понятие о центре давления. Эпюры гидростатического давления
Понятие о эпюрах гидростатического давления Понятие о центре давления. Эпюры гидростатического давления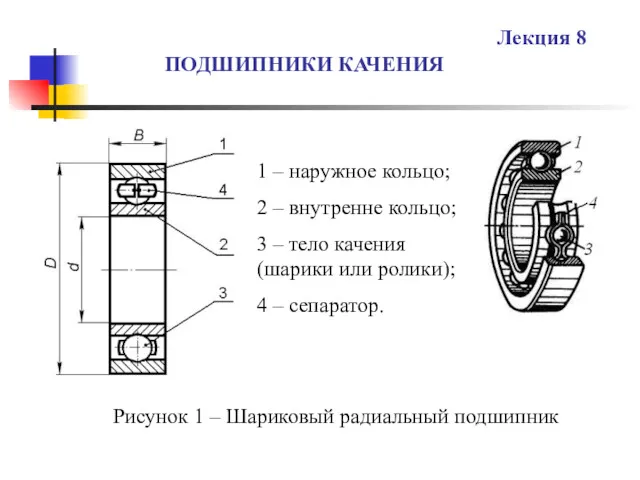 Подшипники качения. (Лекция 8)
Подшипники качения. (Лекция 8) Дисперстік жүйелердің тұрақтылығы. ДЛФО теориясы
Дисперстік жүйелердің тұрақтылығы. ДЛФО теориясы Колебания и волны
Колебания и волны Презентация к уроку физики в 7 классе
Презентация к уроку физики в 7 классе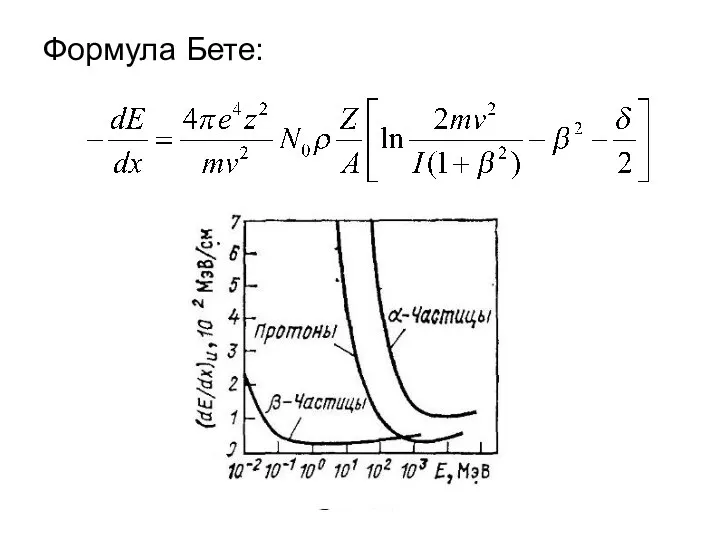 Формула Бете. (Лекция 4)
Формула Бете. (Лекция 4) Механічна енергія
Механічна енергія Автомобілі ЗІЛ-131 та Урал-4320. Особливості будови і принцип дії системи запалювання
Автомобілі ЗІЛ-131 та Урал-4320. Особливості будови і принцип дії системи запалювання Сұйықтық және газ механикасы пәні. Негізгі мәселелер мен болжаулар
Сұйықтық және газ механикасы пәні. Негізгі мәселелер мен болжаулар Сила давления жидкости на плоские и криволинейные стенки
Сила давления жидкости на плоские и криволинейные стенки Электрический ток в вакууме. Электроннолучевая трубка
Электрический ток в вакууме. Электроннолучевая трубка Рівновага тіл. Умова рівноваги тіла
Рівновага тіл. Умова рівноваги тіла Магнитное поле в вакууме
Магнитное поле в вакууме Основные разделы. Законы взаимодействия и движения тел
Основные разделы. Законы взаимодействия и движения тел Энергия связи ядра и дефект масс
Энергия связи ядра и дефект масс Явление электростатической индукции. Лекция 2
Явление электростатической индукции. Лекция 2 Постоянный ток. Лекция №6
Постоянный ток. Лекция №6 Приложения химической термодинамики. Термодинамика фазовых равновесий
Приложения химической термодинамики. Термодинамика фазовых равновесий Задания из ЕГЭ по физике за 2006 год
Задания из ЕГЭ по физике за 2006 год Работа и мощность электрического тока
Работа и мощность электрического тока Микроволновая печь.(Презентация из конференции: Физика на кухне для кулинарного лиция)
Микроволновая печь.(Презентация из конференции: Физика на кухне для кулинарного лиция) Сопротивление материалов. Введение. Основные понятия
Сопротивление материалов. Введение. Основные понятия Реактивное движение
Реактивное движение Рух тіла, кинутого під кутом до горизонту
Рух тіла, кинутого під кутом до горизонту Двигатель S55B30. Марка:BMW
Двигатель S55B30. Марка:BMW Инструментальные методы исследования органических веществ. Лекция 11
Инструментальные методы исследования органических веществ. Лекция 11 Организация подготовки к ГИА по физике в 9 классе
Организация подготовки к ГИА по физике в 9 классе