Содержание
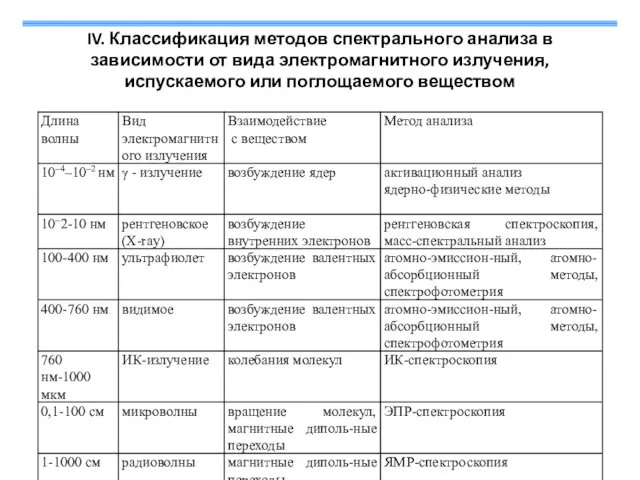
- 2. IV. Классификация методов спектрального анализа в зависимости от вида электромагнитного излучения, испускаемого или поглощаемого веществом
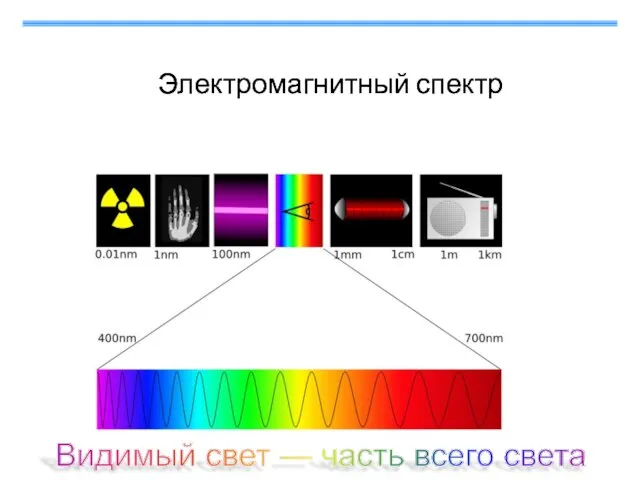
- 3. Видимый свет — часть всего света Электромагнитный спектр Электромагнитный спектр
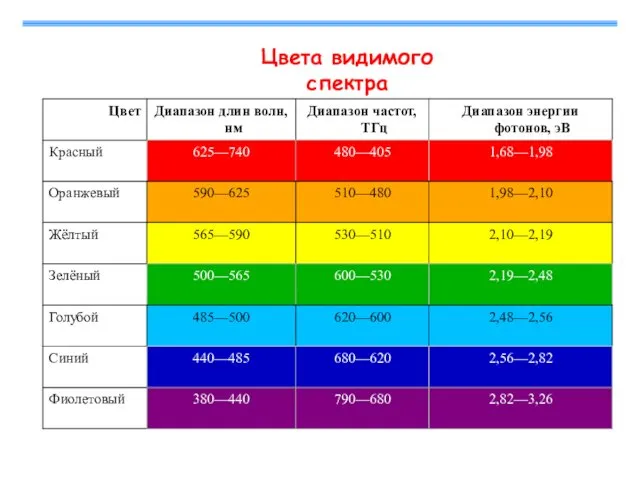
- 4. Цвета видимого спектра
- 5. Спектроскопию в видимой и УФ-областях традиционно называют спектрофотометрией. Энергия фотонов в этих областях спектра достаточна для
- 6. Типы соединений, применяемых в спектрофотометрическом анализе: 1. Однороднолигандные комплексы с неорганическими лигандами: – роданидные и галогенидные
- 7. 3. Разнолигандные и разнометальные комплексы. К этой группе отнесены также ионные ассоциаты, которые близки к ней,
- 8. Спектрофотометрия в видимой области (фотометрия) спектры поглощения в видимой области - 400—700 нм Группа в молекуле,
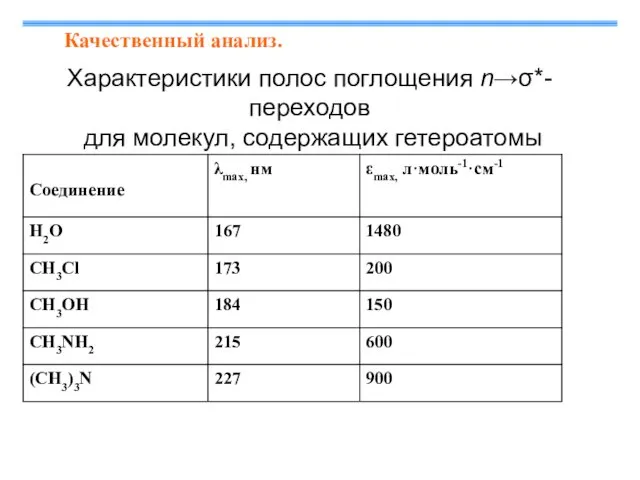
- 9. Характеристики полос поглощения n→σ*-переходов для молекул, содержащих гетероатомы Качественный анализ.
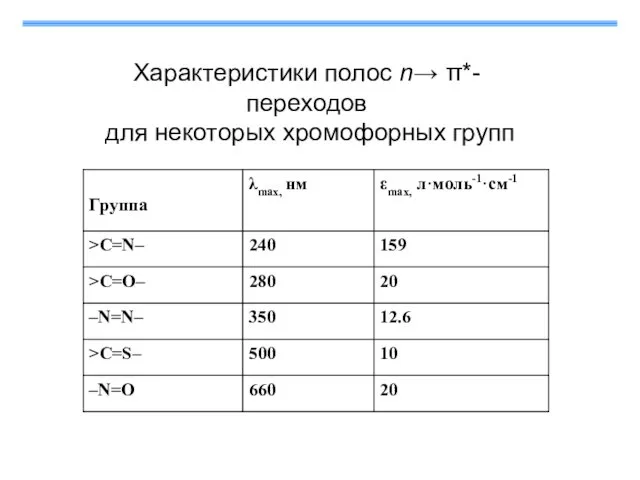
- 10. Характеристики полос n→ π*-переходов для некоторых хромофорных групп
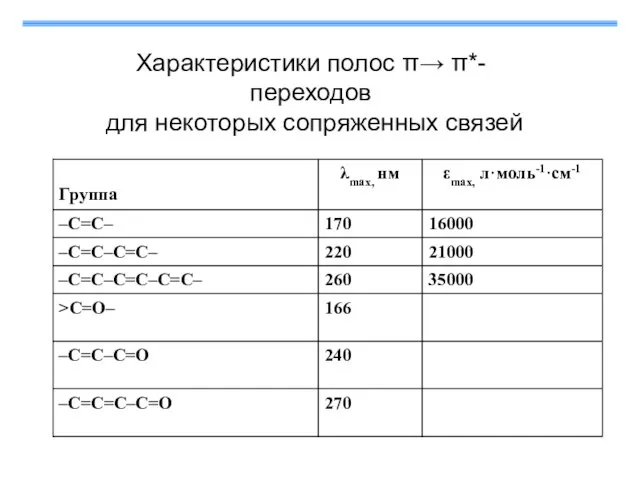
- 11. Характеристики полос π→ π*-переходов для некоторых сопряженных связей
- 12. Испытания на подлинность Нахождение в спектре λmax и λmin и сравнение с аналогичными характеристиками, приведенными в
- 13. Испытания на подлинность
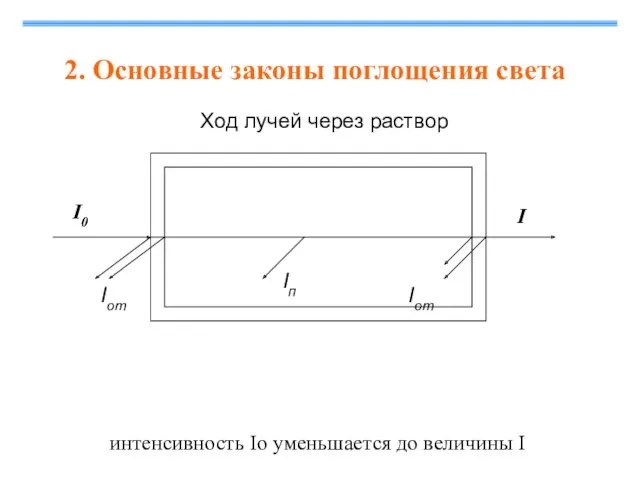
- 14. Ход лучей через раствор I 2. Основные законы поглощения света интенсивность Iо уменьшается до величины I
- 15. Оптическая плотность, поглощение, экстинкция А — это величина, равная Отношение интенсивностей прошедшего и падающего света I/I0
- 16. поглощение потока электромагнитного излучения зависит от природы поглощающего вещества, толщины поглощающего слоя и прямо пропорционально его
- 17. Объединенный закон Бугера - Ламберта - Бера Соблюдение основного закона светопоглощения
- 18. Закон Бугера – Ламберта - Бера строго справедлив лишь по отношению к разбавленным растворам и при
- 19. Причинами несоблюдения закона Бугера - Ламберта - Бера могут быть химические и инструментальные факторы. Химические причины
- 20. Например, салициловая кислота в зависимости от рН раствора способна образовывать с ионами Fe3+ комплексы различных состава
- 21. Сущностью закона аддитивности является независимость поглощения индивидуального вещества от наличия других веществ, обладающих собственным поглощением, или
- 22. Анализ смесей Анализ смесей без разделения на компоненты возможен в том случае, если компоненты смеси имеют
- 23. - для исследуемого раствора для стандартного раствора Отсюда Метод сравнения оптических плотностей стандартного и исследуемого окрашенных
- 24. По данным, полученным для стандартных растворов, рассчитывают среднее значение молярного коэффициента светопоглощения: Зная значения оптической плотности
- 25. Метод градуировочного графика При выборе интервала концентраций стандартных растворов руководствуются следующими положениями: а) он должен охватывать
- 26. Метод добавок Определение концентрации раствора методом добавок основано на сравнении оптической плотности исследуемого раствора и того
- 27. Графический метод добавок
- 28. Кривые светопоглощения веществ перекрываются по всему спектру Рассмотрим двухкомпонентную систему. В этом случае концентрации С1 и
- 29. Фотометрическое титрование Фотометрическое титрование основано на регистрации изменения поглощения (или пропускания) анализируемого раствора по мере прибавления
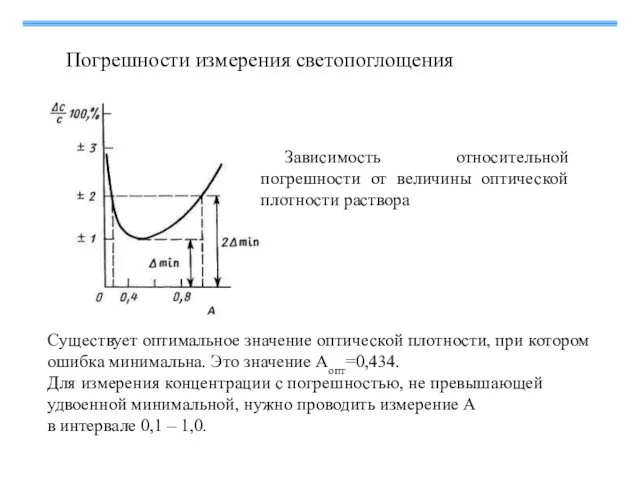
- 30. Погрешности измерения светопоглощения Зависимость относительной погрешности от величины оптической плотности раствора Cуществует оптимальное значение оптической плотности,
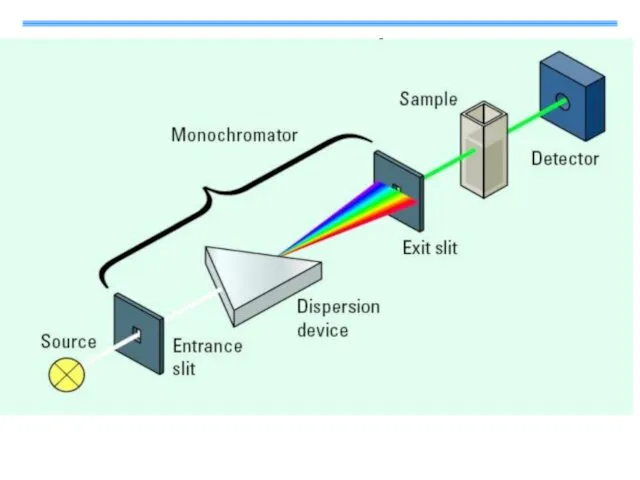
- 31. 4. Приборы и оборудование полихроматический источник спектра, монохроматор (в основном дифракционные решетки), кювету с исследуемым образцом,
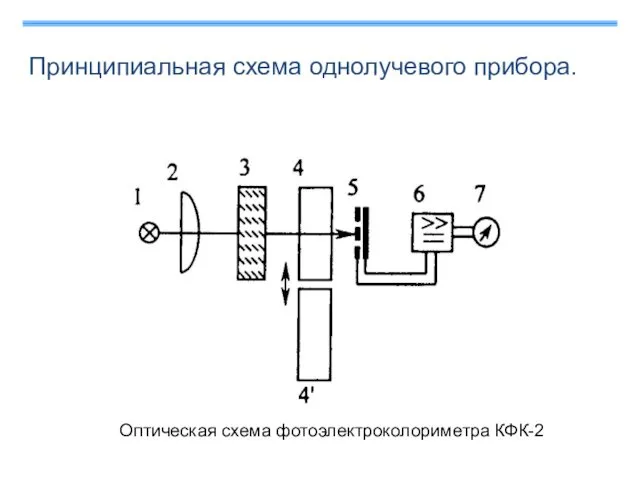
- 33. Принципиальная схема однолучевого прибора. Оптическая схема фотоэлектроколориметра КФК-2
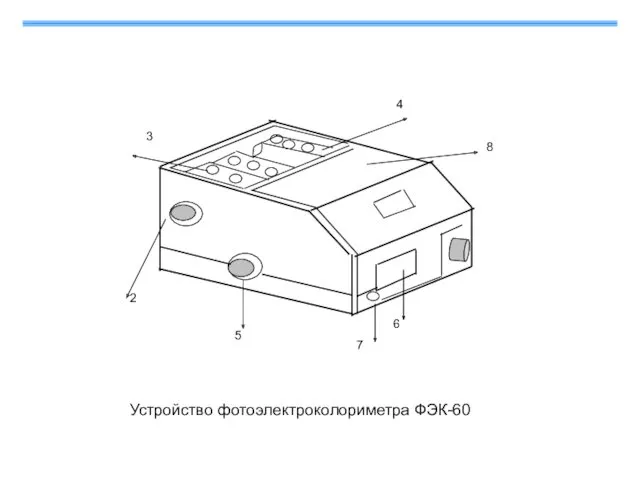
- 35. Устройство фотоэлектроколориметра ФЭК-60
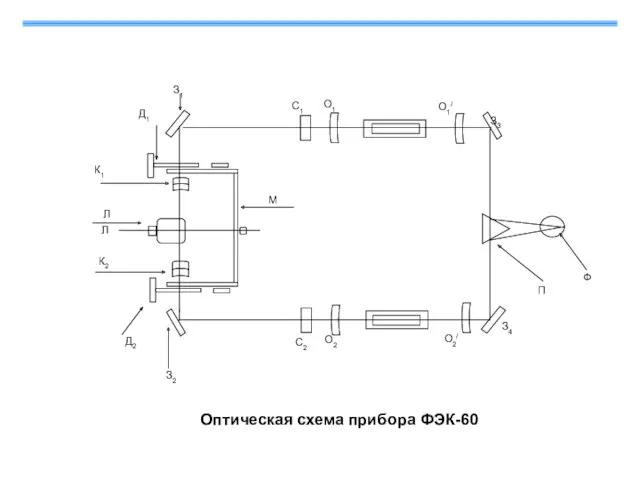
- 36. Оптическая схема прибора ФЭК-60
- 37. Внешний вид спектрофотометра Helios Alfa
- 38. Особенности конструкции Helios Alpha: – Двухлучевая оптическая схема – Кварцевое покрытие оптических элементов, установленных на литом
- 39. Примеры решения задач Пример 1. Рассчитать наименьшую концентрацию вещества, которую можно определить фотоколориметрическим методом, если известно,
- 40. Решение. Чтобы выразить концентрацию определяемого компонента (иона) в микрограммах на миллилитры, нужно умножить полученную величину на
- 41. Примеры решения задач Пример 2. Найти оптимальную толщину поглощающего слоя (кювету) для фотометрирования окрашенного раствора соли
- 42. Решение. 1. Для концентрации 2 мг железа: 2. Для концентрации 0,05 мг железа:
- 43. Примеры решения задач Пример 3. Определить кажущийся молярный коэффициент светопоглощения окрашенного соединения железа, если известно, что
- 44. Решение. ;
- 45. Примеры решения задач Пример 4. Исследуемый раствор имеет оптическую плотность 0,9 при измерении в кювете с
- 46. Решение. Следовательно, для сравниваемых растворов можно написать: Разделив одно равенство на другое, получим:
- 47. Примеры решения задач Пример 5. При определении железа в виде моносульфосалицилата оптическая плотность раствора, содержащего 0,23
- 48. Решение. Из уравнения основного закона светопоглощения известно, что: Концентрацию железа определяют по формуле: Затем определяют ε:
- 49. Примеры решения задач Пример 6. Навеску стали 0,1 г растворили в 100 мл кислоты. Аликвотную часть
- 50. Решение. Процентное содержание никеля aNi определяют по формуле: (V2 = 50 мл в расчете не используется,
- 51. Примеры решения задач Пример 7. Оптическая плотность раствора трисульфосалицилата железа, измеренная при λ= 433 нм в
- 53. Скачать презентацию






































 Физические явления языком литературы (в рамках общешкольного проекта Слово в итегрированом пространстве изучаемых наук)
Физические явления языком литературы (в рамках общешкольного проекта Слово в итегрированом пространстве изучаемых наук) Конденсатор
Конденсатор Расчет системы общего искусственного освещения
Расчет системы общего искусственного освещения Кроссворд Лесенка. (физика, 7 кл.)
Кроссворд Лесенка. (физика, 7 кл.) Решение задач Закон Ома для участка цепи, последовательное и параллельное соединение проводников
Решение задач Закон Ома для участка цепи, последовательное и параллельное соединение проводников Голография и ее применение
Голография и ее применение Динамика. Законы Ньютона
Динамика. Законы Ньютона Хроника космической эры
Хроника космической эры Активні компоненти
Активні компоненти Основные положения МКТ. Термодинамические параметры
Основные положения МКТ. Термодинамические параметры Быстрое преобразование Фурье. (Лекция 12)
Быстрое преобразование Фурье. (Лекция 12) Бытовая швейная машина. Практическая работа
Бытовая швейная машина. Практическая работа Механика грунтов и подземных сооружений. Лекция 1
Механика грунтов и подземных сооружений. Лекция 1 Электроемкость. Конденсаторы. Энергия заряженного конденсатора
Электроемкость. Конденсаторы. Энергия заряженного конденсатора Технологии выполнения технического обслуживания и ремонта автосцепных
Технологии выполнения технического обслуживания и ремонта автосцепных Своя игра. Простые механизмы
Своя игра. Простые механизмы Равномерное движение по окружности. Решение задач.
Равномерное движение по окружности. Решение задач. Разработка рекомендаций по снижению величины основного сопротивления движения автосамосвала и увеличения сцепления с дорогой
Разработка рекомендаций по снижению величины основного сопротивления движения автосамосвала и увеличения сцепления с дорогой Исследование ударно-волновой картины в воздухозаборнике двигателя ГЛА
Исследование ударно-волновой картины в воздухозаборнике двигателя ГЛА Расчет количества теплоты при нагревании и охлаждении. Удельная теплоемкость
Расчет количества теплоты при нагревании и охлаждении. Удельная теплоемкость Аналіз лінійних кіл постійного струму при безпосередньому застосуванні законів Кірхгофа
Аналіз лінійних кіл постійного струму при безпосередньому застосуванні законів Кірхгофа Суперпозиция принципі. Нүктелік зарядтың кернеулігі. Зарядталған шардың, жазық пластинаның кернеулігі
Суперпозиция принципі. Нүктелік зарядтың кернеулігі. Зарядталған шардың, жазық пластинаның кернеулігі Кейс-технологии на уроках физики
Кейс-технологии на уроках физики Презентация Викторина. Экология и физика
Презентация Викторина. Экология и физика Петрофизика. Фазовая проницаемость горных пород
Петрофизика. Фазовая проницаемость горных пород Контроль параметрів радіовипромінювання. Радіоперешкоди
Контроль параметрів радіовипромінювання. Радіоперешкоди Разработка технологического процесса ремонта одного из заданных контсруктивных элементов воздушного судна
Разработка технологического процесса ремонта одного из заданных контсруктивных элементов воздушного судна Колебания. Виды колебаний
Колебания. Виды колебаний