Содержание
- 2. ТЕМА ЛЕКЦИИ. ОБЩАЯ ХАРАКТЕРИСТИКА инструментальных методов анализа спектроскопические МЕТОДЫ анализа
- 3. План лекции: 1.ВВЕДЕНИЕ.Особенности и области применения физико-химических методов анализа 2.КЛАССИФИКАЦИЯ СПЕКТРОСКОПИ-ЧЕСКИХ МЕТОДОВ 3. Аналитический сигнал. Методы
- 4. Физико-химические методы анализа Применение подходов физической химии для целей качественного и количественного химического анализа (аналитической химии)
- 5. Физико-химические методы анализа Определение: Методы, использующие для получения химической информации физические явления.
- 6. Инструментальные методы анализа Спектроскопические Хроматографические Электрохимические Радиометрические Термические Масс-спектрометрические
- 7. 1. Особенности и области применения физико-химических методов анализа
- 8. Особенности и области применения физико-химических методов анализа 1.Очень низкий предел обнаружения. 2. Экспрессность, т.е. высокий темп
- 9. А) Спектральные и другие оптические методы; Атомно-абсорбционная спектроскопия; Атомно-эмиссионная спектроскопия; Инфракрасная (ИК-) спектроскопия; Спектрофотометрия (в видимой
- 10. 2.КЛАССИФИКАЦИЯ СПЕКТРОСКОПИ-ЧЕСКИХ МЕТОДОВ
- 11. СПЕКТРОСКОПИЯ Спектроскопия – (от лат. spectrum – образ, представление, skopeo – смотрю) – наука о спектрах
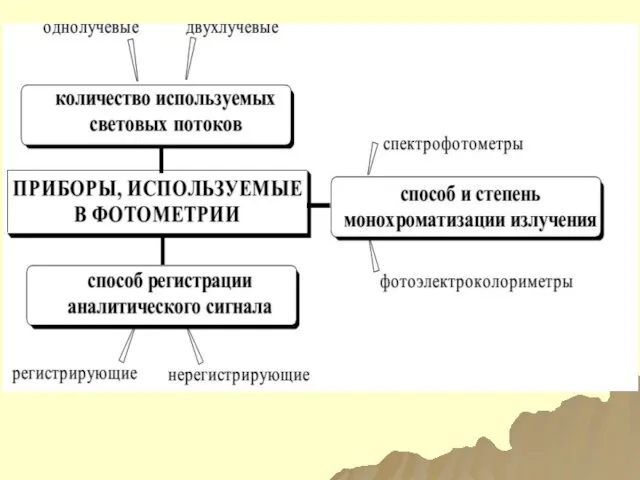
- 12. СПЕКТРОМЕТРИЯ Спектрофотометрия – теория и практика измерения соответствующей интенсивности линии при определенной длине волны, более часто
- 13. ПО ТИПУ ВзаимодействиЯ излучения с веществом 1. С поглощением излучения (ААС,ИК,КР, УФ) 2. С испусканием излучения
- 14. КЛАССИФИКАЦИЯ ПО ТИПУ ЧАСТИЦ АТОМНАЯ АБСОРБЦИЯ– ААС; ЭМИССИЯ - АЭС МОЛЕКУЛЯРНАЯ АБСОРБЦИЯ – ИК, КР, УФ+ВИД,
- 15. Спектроскопия с поглощением излучения Методы атомной спектроско-пии - ААС, (ЯМР, ЭПР) Методы молекуляр-ной спектроско-пии: УФ+вид- ИК-
- 16. Природа электро-магнитного излучения любой физический объект может быть описан как с использованием математического аппарата, основанного на
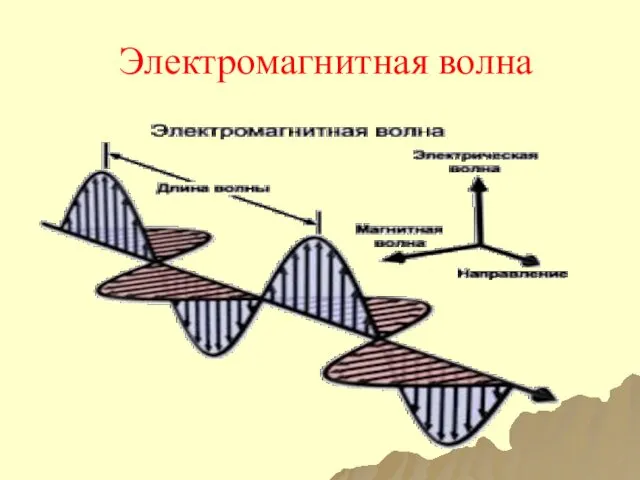
- 17. Электромагнитная волна
- 18. Основные параметры ЭМВ Длина волны (λ) ̶ расстояние, которое проходит волна за один период ее колебаний;
- 19. Основные параметры ЭМВ
- 20. Основные параметры ЭМВ
- 21. Взаимосвязь между волновой и корпускулярной природой ЭМИ
- 22. Длина волны для волнового числа 3330 см-1
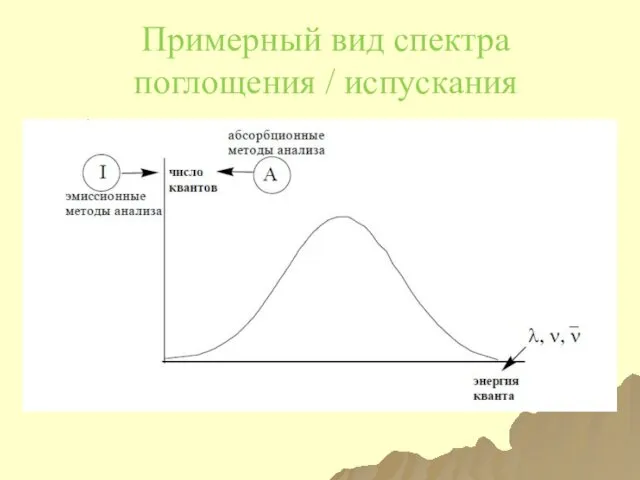
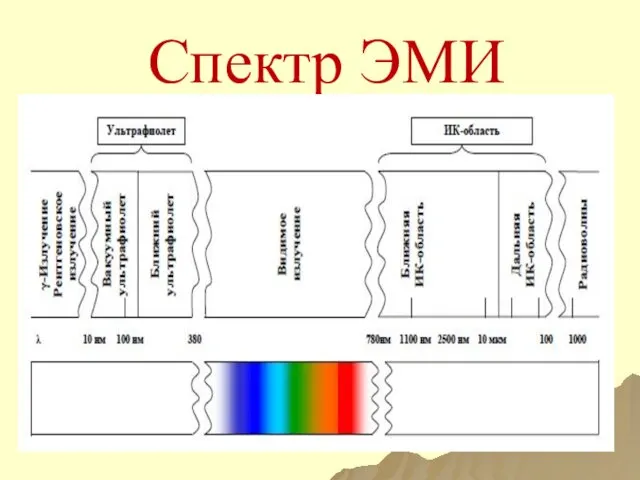
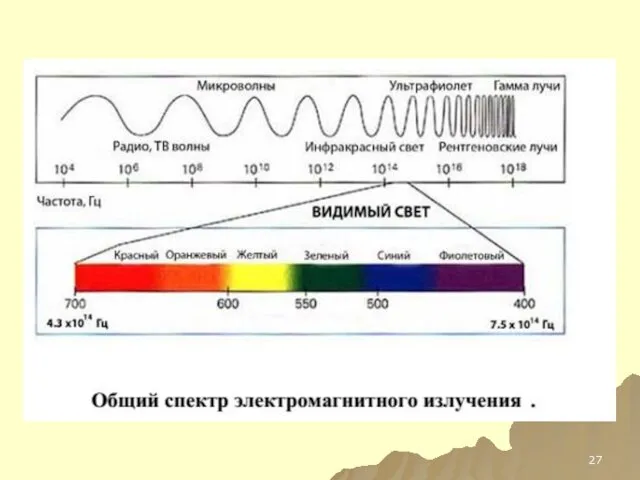
- 24. Спектр Электромагнитный спектр ̶ совокупность всех энергий ЭМИ. Спектр (спектроскопические методы анализа) ̶ зависимость между энергией
- 25. Примерный вид спектра поглощения / испускания
- 26. Спектр ЭМИ
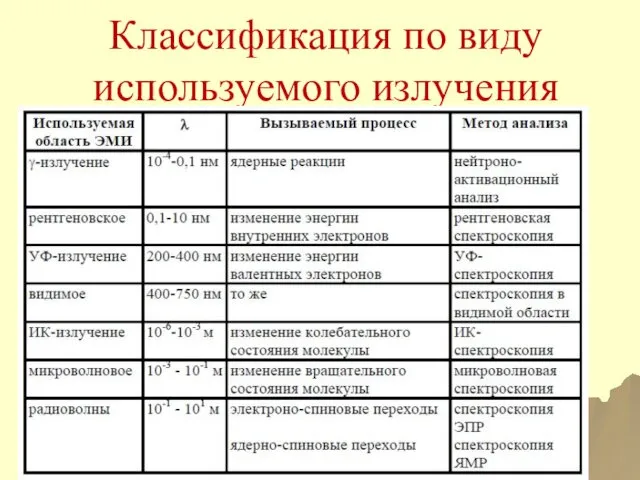
- 28. Классификация по виду используемого излучения
- 29. Классификация по виду частиц, взаимодействующих с ЭМИ. Атомные спектроскопические МА Молекулярные спектроскопические МА
- 30. Виды спектров Линейчатые Полосатые Непрерывные
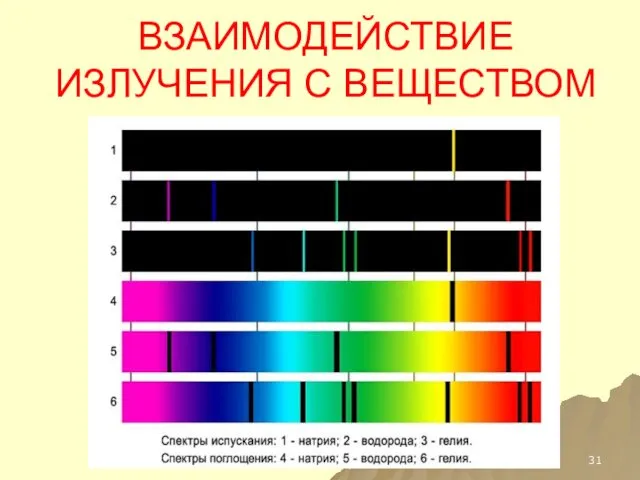
- 31. ВЗАИМОДЕЙСТВИЕ ИЗЛУЧЕНИЯ С ВЕЩЕСТВОМ
- 32. Методы атомной спектроскопии Поглощение (абсорбция) излучения - ААС Эмиссия излучения АЭС
- 33. ЯМР - КРАТКО ЯДЕРНЫЙ МАГНИТНЫЙ РЕЗОНАНС, СПИН НЕЙТРОНА И ПРОТОНА КАК ЭЛЕМЕНТАРНЫХ ЧАСТИЦ = 1/2, .
- 34. Томограф
- 35. Методы атомной спектроскопии
- 36. Методы атомной спектроскопии Поглощение (абсорбция) излучения - ААС Эмиссия излучения АЭС
- 37. ТЕМА ЛЕКЦИИ. АТОМНО-АБСОРБЦИОННАЯ СПЕКТРОМЕТРИЯ ПРИМЕНЕНИЕ В ФАРМАЦЕВТИЧЕСКОМ АНАЛИЗЕ
- 40. Соотношение числа атомов в основном и возбужденном состояниях – РАСПРЕДЕЛЕНИЕ БОЛЬЦМАНА
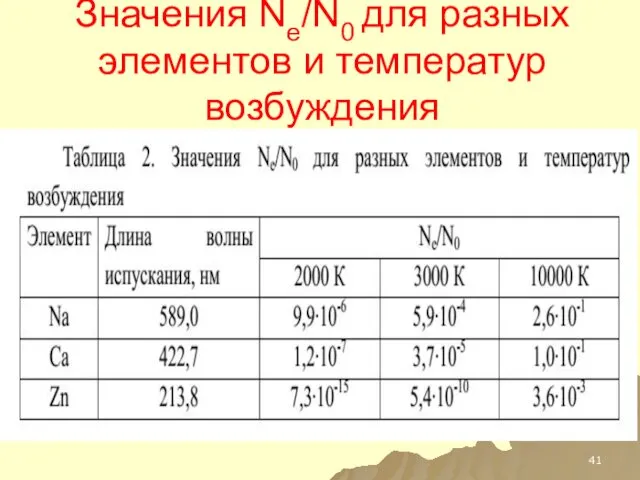
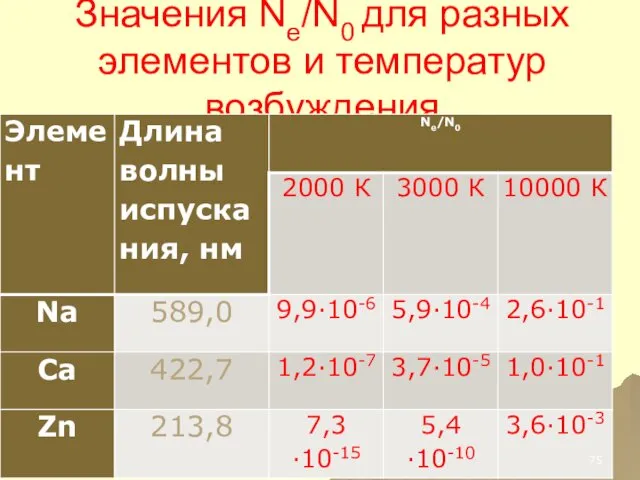
- 41. Значения Ne/N0 для разных элементов и температур возбуждения
- 42. ВЫВОД ЛИШЬ ОЧЕНЬ НЕБОЛЬШАЯ ЧАСТЬ АТОМОВ НАХОДИТСЯ В ВОЗБУЖДЕННОМ СОСТОЯНИИ
- 43. РЕЗОНАНСНАЯ ЛИНИЯ НАИБОЛЕЕ ИНТЕНСИВНАЯ ЛИНИЯ В СПЕКТРЕ ИСПУСКАЯНИЯ НАЗЫВАЕТСЯ РЕЗОНАНСНОЙ, КАК ПРАВИЛО, ЭЛЕМЕНТ ИМЕЕТ НЕСКОЛЬКО ЛИНИЙ,
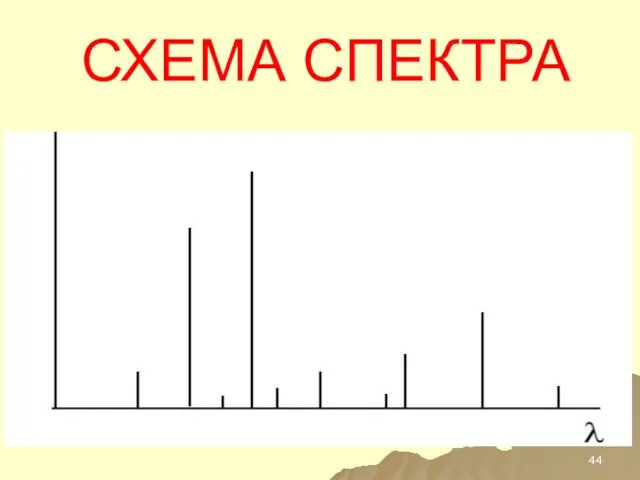
- 44. СХЕМА СПЕКТРА
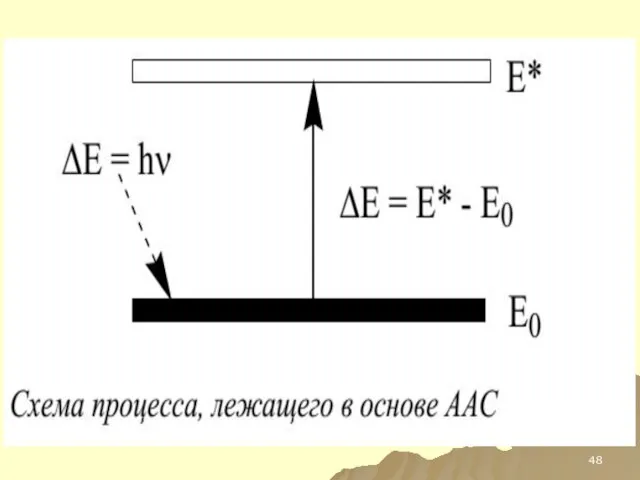
- 45. ААС И АЭС ОБЩЕЕ – ЭЛЕКТРОННЫЕ ПЕРЕХОДЫ В АТОМЕ МЕЖДУ РАЗНЫМИ ЭНЕРГЕТИЧЕСКИМИ УРОВНЯМИ; РАЗЛИЧИЕ - В
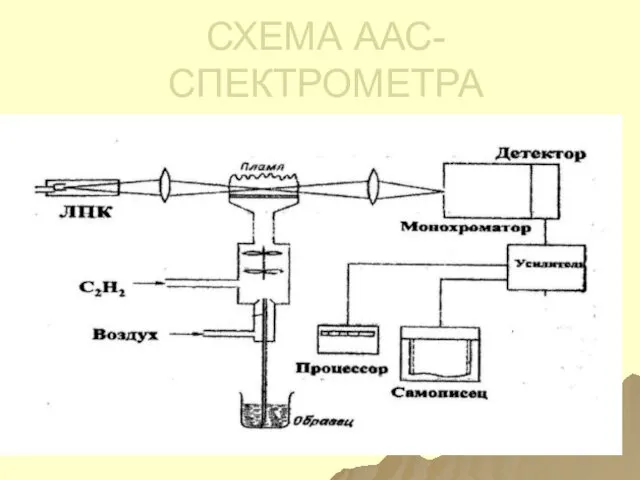
- 47. СХЕМА ААС- СПЕКТРОМЕТРА
- 49. Атомизаторы
- 50. ПЛАМЕННЫЙ АТОМИЗАТОР ИСПОЛЬЗУЕТСЯ ПЛАМЯ, ДОСТАТОЧНОЕ ДЛЯ ПОЛУЧЕНИЯ АТОМНОГО ПАРА ВЕЩЕСТВА, НО ТЕМПЕРАТУРА ПЛАМЕНИ НЕ ДОЛЖНА ВЫЗЫВАТЬ
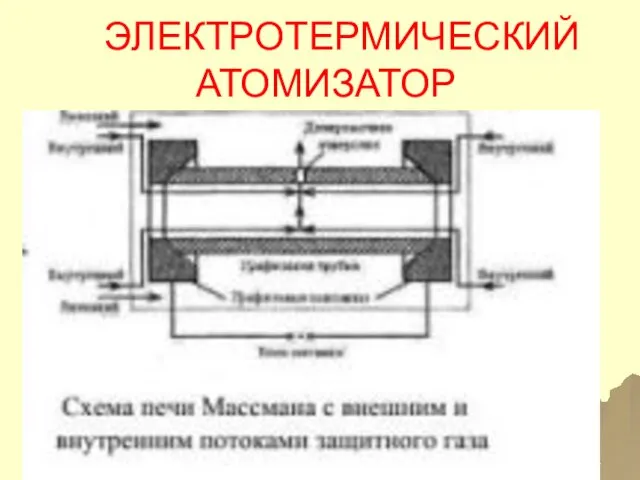
- 51. ЭЛЕКТРОТЕРМИЧЕСКИЙ АТОМИЗАТОР
- 52. ПРОЦЕССЫ В ЭЛЕКТРОТЕРМИЧЕСКОМ АТОМИЗАТОРЕ КАПЛЯ РАСТВОРА ИЛИ ТВЕРДЫЙ ОБРАЗЕЦ ПОДАЮТСЯ В ОТВЕРСТИЕ ГРАФИТОВОЙ ЛОДОЧКИ, ВЫСУШИВАЕТСЯ ПРИ
- 53. ИСТОЧНИКИ ИЗЛУЧЕНИЯ
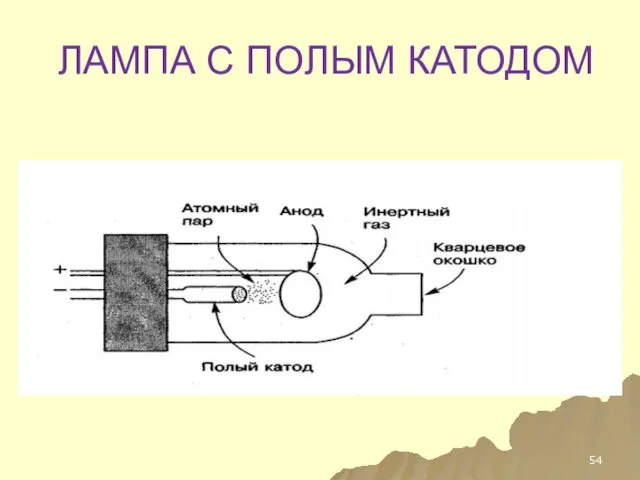
- 54. ЛАМПА С ПОЛЫМ КАТОДОМ
- 55. ВНЕШНИЙ ВИД ЛАМПЫ
- 58. ВВОД ПРОБЫ
- 59. УСТРОЙСТВО ВВОДА ПРОБЫ ДЛЯ ПЛАМЕННОЙ ГОРЕЛКИ
- 60. ГОРЕЛКА БОЙЛИНГА
- 61. ЭФФЕКТ ВЕНТУРИ
- 63. МЕТОД «ХОЛОДНОГО ПАРА» СОЕДИНЕНИЯ РТУТИ ПРВРАЩАЮТ В МЕТАЛЛИЧЕСКУЮ РТУТЬ, ЗАТЕМ ЕЕ ОТГОНЯЮТ ПРИ КОМНАТНОЙ ТЕМТЕРАТУРЕ
- 65. ГЕНЕРАЦИЯ ГИДРИДОВ
- 66. ПОМЕХИ В МЕТОДЕ ААС
- 67. ПОМЕХИ В МЕТОДЕ ААС СПЕКТРАЛЬНЫЕ; ФИЗИЧЕСКИЕ; ХИМИЧЕСКИЕ
- 68. КАЧЕСТВЕННЫЙ И КОЛИЧЕСТВЕННЫЙ АНАЛИЗ В ААС
- 69. КАЧЕСТВЕННЫЙ В ААС ПОСКОЛЬКУ ОПРЕДЕЛЯЕМЫЙ ЭЛЕМЕНТ ЗАДАЕТСЯ ВЫБОРОМ ЛАМПЫ, МЕТОД ААС НЕ ЯВЛЯЕТСЯ МЕТОДОМ КАЧЕСТВЕННОГО АНАЛИЗА
- 70. КОЛИЧЕСТВЕННЫЙ АНАЛИЗ В ААС 1) МЕТОД ОДНОГО СТАНДАРТА;; 2) МЕТОД ДВУХ СТАНДАРТОВ; 3) МЕТОД ДОБАВОК.
- 71. ФАРМ. ПРИМЕНЕНИЕ
- 72. МЕТОД ААС ИСПОЛЬЗУЕТСЯ ДЛЯ ОПРЕДЛЕНИЯ СЛЕДОВЫХ КОЛИЧЕСТВ БОЛЕЕ 70 ЭЛЕМЕНТОВ, В ТОМ ЧИСЛЕ И НЕКОТОРЫХ НЕМЕТАЛЛОВ
- 74. Атомно-эмиссионная спектрометрия
- 75. Значения Ne/N0 для разных элементов и температур возбуждения
- 76. Атомно-эмиссионная спектрометрия Спектрометрический метод анализа, основанный на измерении электромагнитного излучения оптического диапазона, испускаемого термически возбужденными свободными
- 77. ААС И АЭС ОБЩЕЕ – ЭЛЕКТРОННЫЕ ПЕРЕХОДЫ В АТОМЕ МЕЖДУ РАЗНЫМИ ЭНЕРГЕИЧЕСКИМИ УРОВНЯМИ; РАЗЛИЧИЕ - В
- 78. Атомизаторы (источники возбуждения)
- 79. Виды атомизаторов в атомно-эмиссионной спектрометрии 1.Пламя, 2.электрическая дуга, 3.электрическая искра, 4.атомизатор с индуктивно связанной плазмой.
- 80. Пламенная фотометрия (фотометрия пламени) Вариант атомно-эмиссионной спектрометрии с пламенной атомизацией.
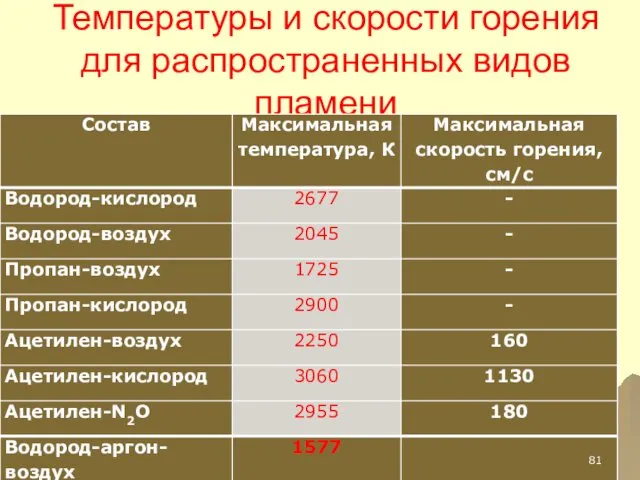
- 81. Температуры и скорости горения для распространенных видов пламени
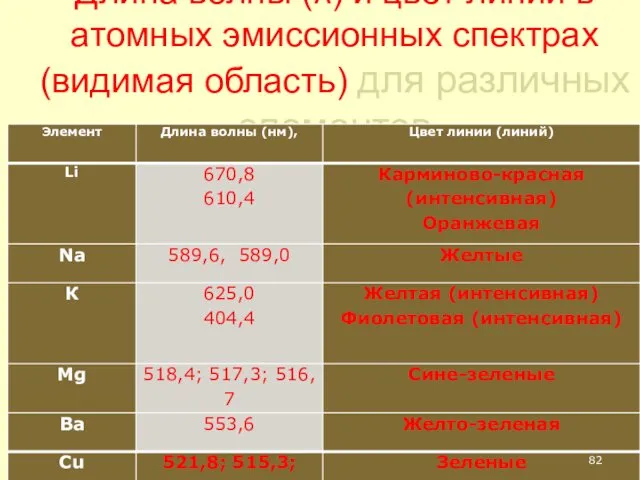
- 82. Длина волны (λ) и цвет линий в атомных эмиссионных спектрах (видимая область) для различных элементов
- 83. ЭЛЕКТРИЧЕСКАЯ ИСКРА При электрическом разряде развивается температура 7000оС-10000оС, что приводит к возбуждению всех элементов. При необходимости
- 84. ЭЛЕКТРИЧЕСКАЯ ДУГА
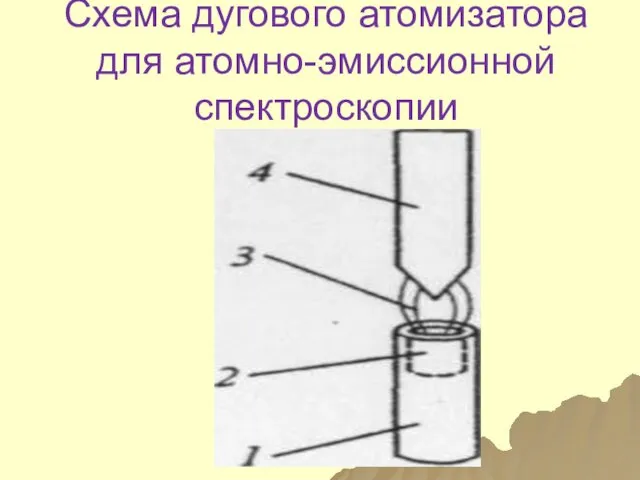
- 85. Схема дугового атомизатора для атомно-эмиссионной спектроскопии
- 86. Составные части 1- нижний электрод 2-углубление для пробы 3-зона электрического разряда 4-верхний электрод
- 87. ОПРЕДЕЛЕНИЕ ПЛАЗМЫ ПЛАЗМА – ОСОБОЕ АГРЕГАТНОЕ СОСТОЯНИЕ ВЕЩЕСТВА, ПРЕДСТАВЛЯЕТ СОБОЙ ЧАСТИЧНО ИЛИ ПОЛНОСТЬЮ ИОНИЗИРОВАННЫЙ ГАЗ, ИЗ
- 88. ТЕМПЕРАТУРА ПЛАЗМЫ E~kT В зависимости от условий возбуждения ~104 К
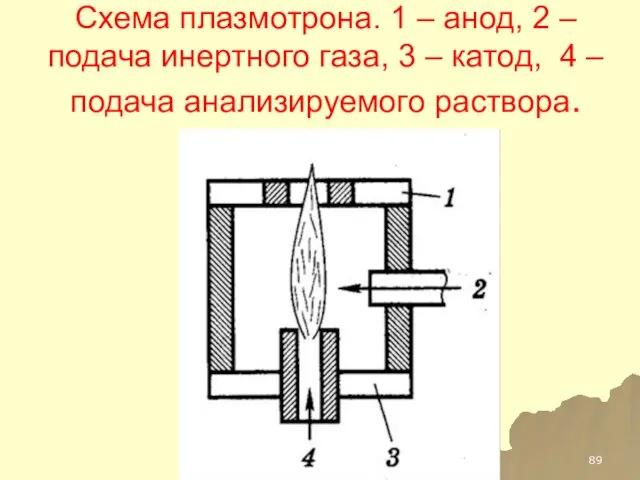
- 89. Схема плазмотрона. 1 – анод, 2 – подача инертного газа, 3 – катод, 4 – подача
- 90. атомизатор с индуктивно связанной плазмой.
- 91. Составные части 1- зона наблюдения 2- индукционная катушка 3- кварцевая горелка 4 – поток охлаждающего газа
- 92. Внешний вид пламени в ICP
- 93. ПРЕИМУЩЕСТВА АЭС ИСП -одновременный многоэлементный анализ - гибкость в выборе из нескольких различных длин волн эмиссии
- 94. КОЛИЧЕСТВЕННЫЙ АНАЛИЗ В АЭС ОСНОВАН НА УРАВНЕНИИ ЛОМАКИНА - ШАЙБЕ
- 95. УРАВНЕНИЕ ЛОМАКИНА - ШАЙБЕ
- 96. ЛОРАФМИЧЕСКАЯ ФОРМА
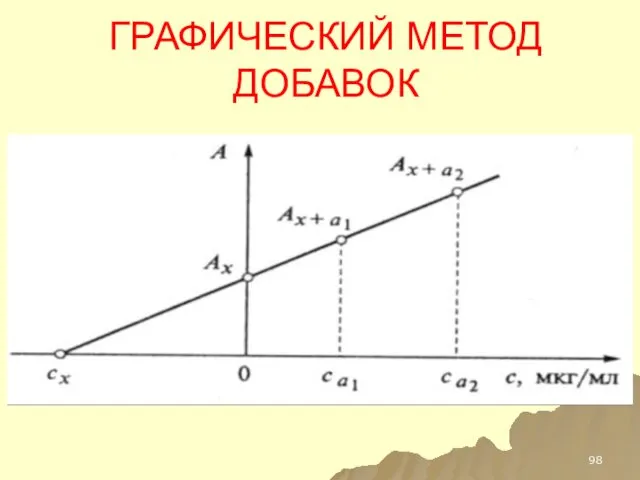
- 97. РАСЧЕТНЫЙ МЕТОД ДОБАВОК
- 98. ГРАФИЧЕСКИЙ МЕТОД ДОБАВОК
- 99. СМЫСЛ ЭМПИРИЧЕСКИХ КОЭФФИЦИЕНТОВ a и b - эмпирические константы, которые характеризуют процессы, происходящие на поверхности электродов
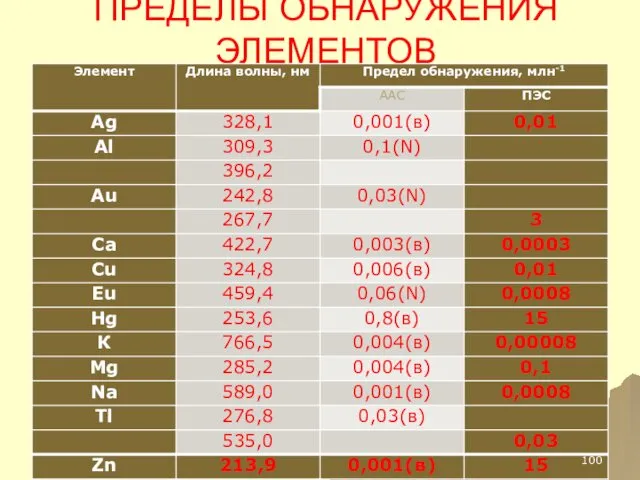
- 100. ПРЕДЕЛЫ ОБНАРУЖЕНИЯ ЭЛЕМЕНТОВ
- 101. Применение методов эмиссионной спектроскопии для фармацевтического анализа (УИРС-3)
- 102. МОЛЕКУЛЯРНАЯ СПЕКТРО - СКОПИЯ
- 103. МОЛЕКУЛЯРНАЯ Абсорбционная спектроскопия (УФ-ВИД (УВИ) и ИК-спектроскопия). Применение в фарм.анализе
- 104. План лекции: Электронная (УФ-видимая) спектроскопия 1.1 УФ-сигнал, 1.2. Сдвиги и эффекты в спектрах, 1.3. полосы поглощения,
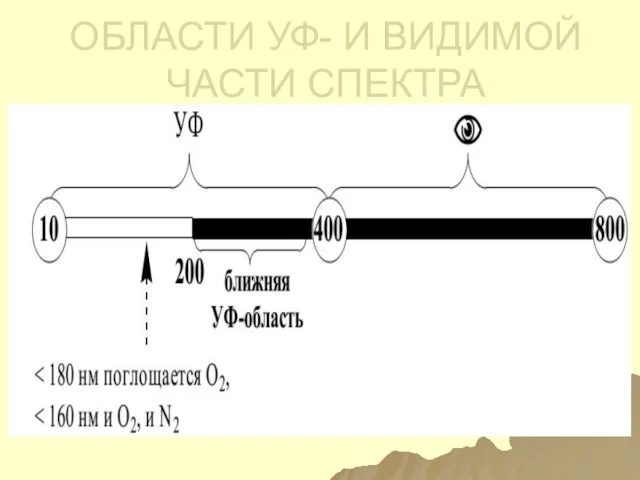
- 105. ИСПОЛЬЗУЕМЫЕ ОБЛАСТИ ЭМИ 1) СПЕКТРОСКОПИЯ (СПЕКТРОФОТОМЕТРИЯ) В УВИ ОБЛАСТИ СПЕКТРА: ближняя УФ – 200 – 400
- 106. ОБЛАСТИ УФ- И ВИДИМОЙ ЧАСТИ СПЕКТРА
- 107. УФ-спектроскопия (синонимы) Поскольку происходят электронные переходы в УФ- и видимой областях, ранее УФ-вид- спектроскопию называли также
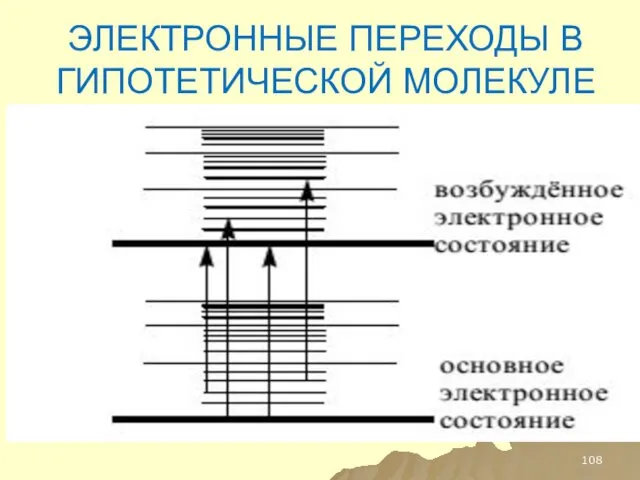
- 108. ЭЛЕКТРОННЫЕ ПЕРЕХОДЫ В ГИПОТЕТИЧЕСКОЙ МОЛЕКУЛЕ
- 109. ТАКИМ ОБРАЗОМ КАЖДОМУ ЭЛЕКТРОННОМУ УРОВНЮ СООТВЕСТВУЕТ НЕСКОЛЬКО КОЛЕБАТЕЛЬНЫХ УРОВНЕЙ ЭНЕРГИИ, ТЕ, В СВОЮ ОЧЕРЕДЬ, ИМЕЕТ ПО
- 110. ЭНЕРГИИ ПЕРЕХОДОВ
- 111. ДВА ВИДА СПЕКТРОСКОПИИ УВИ- СПЕКТРО-СКОПИЯ (ЭЛЕКТРОННЫЕ ПЕРЕХОДЫ) ИК- - СПЕКТРО-СКОПИЯ (ВАЛЕНТНЫЕ КОЛЕБАНИЯ)
- 112. ДВА ВАРИАНТА ИЗМЕРЕНИЯ ПОГЛОЩЕНИЯ ЭМИ 1) ВО ВСЕМ ДИАПАЗОНЕ УВИ; I=f(λ) – СПЕКТРОФОТОМЕТРИЯ; 2) В ЗАДАННОЙ
- 113. ОСНОВНЫЕ И ДОПОЛНИТЕЛЬНЫЕ ЦВЕТА ЦВЕТ ПРОЗРАЧНОЙ ПОГЛОЩАЮЩЕЙ СРЕДЫ ОБУСЛОВЛЕН ПОГЛОЩЕНИЕМ ЭМИ ОПРЕДЕЛЕННОЙ ДЛИНЫ ВОЛНЫ, ТОГДА ОКРАСКА
- 114. Цвета и интервалы длин волн в спектре поглощения белого света (Г. Кристиан, том1)
- 115. ОСНОВНОЙ ЗАКОН СВЕТО-ПОГЛОЩЕНИЯ – БУГЕРА-ЛАМБЕРТА-БЕРА
- 116. В ЛОГАРИФМИЧЕСКОЙ ФОРМЕ В ЭКСПОНЕНЦИАЛЬНОЙ ФОРМЕ
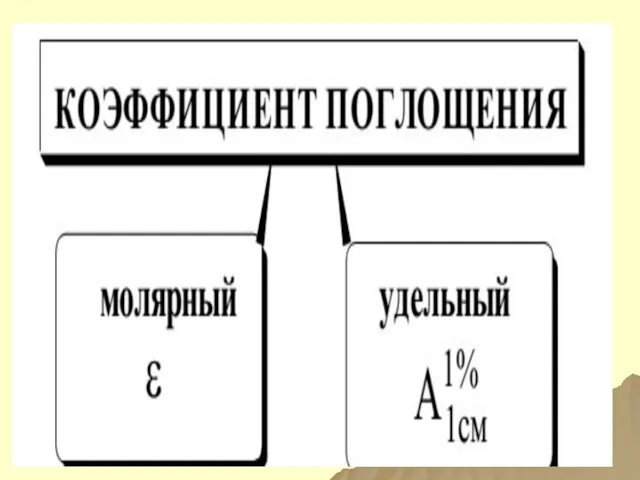
- 118. МОЛЯРНЫЙ КОЭФФИЦИЕНТ ПОГЛОЩЕНИЯ ε
- 119. КОЭФФИЦИЕНТЫ ПОГЛОЩЕНИЯ МОЛЯРНЫЙ УДЕЛЬНЫЙ
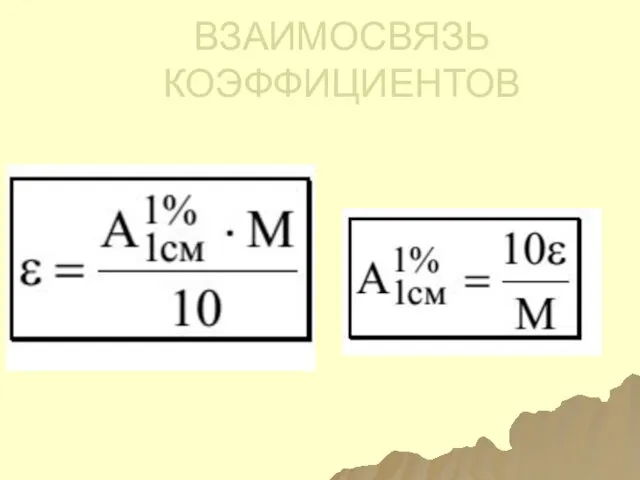
- 120. ВЗАИМОСВЯЗЬ КОЭФФИЦИЕНТОВ ПОГЛОЩЕНИЯ
- 121. ПЕРЕВОД КОНЦЕНТРАЦИЙ
- 122. ПЕРЕВОД КОНЦЕНТРАЦИЙ
- 123. ВЗАИМОСВЯЗЬ КОЭФФИЦИЕНТОВ
- 124. ЗАКОН БУГЕРА-ЛАМБЕРТА-БЕРА УВИ (МАС) ЯВЛЯЕТСЯ БЕЗЭТАЛОННЫМ МЕТОДОМ, Т.Е. МОЖНО РАССЧИТЫВАТЬ КОНЦЕНТРАЦИИ БЕЗ СТАНДАРТА, А ПО ЗНАЧЕНИЯМ
- 125. ПРИРОДА ПОГЛОЩЕНИЯ ЭМИ ВЕЩЕСТВОМ
- 126. Интенсивность переходов ε Критерий – молярный коэффициент поглощения ε (ε π---π-* )=1000 - 100000 (ε n
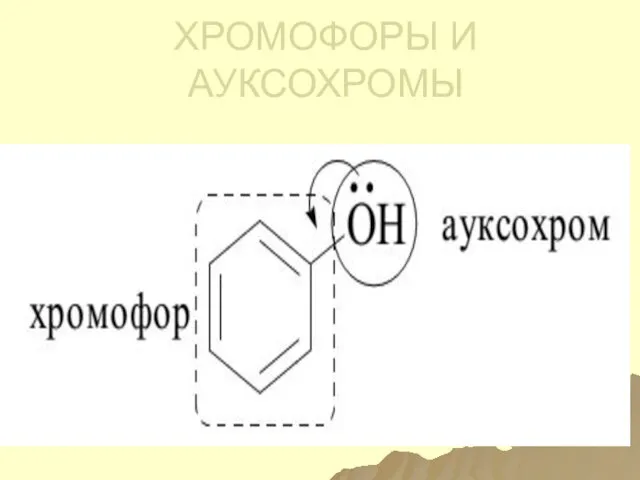
- 127. Поглощение УФ-вид излучения Поглощающие группы – хромофоры. Поглощающие молекулы- хромогены. Ауксохромы – сами не поглощают излучения,
- 128. Ауксохромы – А - гидроксильные группы, аминогруппы, атомы галогенов (n --- π- сопряжение)
- 129. ХРОМОФОРЫ И АУКСОХРОМЫ
- 130. ЭФФКТЫ АУКСОХРОМОВ ГИПЕРХРОМНЫЙ – ГИПОХРОМНЫЙ ЭФФЕКТ ГИПСОХРОМНЫЙ, БАТОХРОМНЫЙ СДВИГ
- 131. Сдвиг максимума поглощения Батохромный сдвиг – в сторону более длинных волн (в красную область); Гипсохромный сдвиг
- 132. Спектр электромагнитного излучения
- 133. Эффекты ауксохромов Гиперхромный эффект– ε увеличивается Гипохромный эффект - ε уменьшается
- 134. Поглощение изолированных хромофоров Если хромофоры разделены двумя (и более) одинарными связями – их поглощение независимо и
- 135. Поглощение сопряженными хромофорами (=-=-=-) Батохромный сдвиг Гиперхромный эффект
- 136. Поглощение хромофорами
- 137. Поглощение ароматичес-кими системами
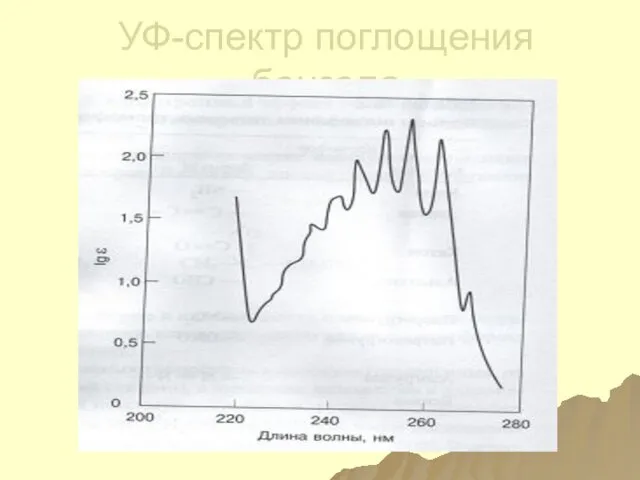
- 138. Поглощение бензола С6Н6 –(λ=200нм, ε=69000) интенсивная + +(λ=230-270нм, ε=170) слабая полоса с тонкой структурой, обусловленная разрешенными
- 139. УФ-спектр поглощения бензола
- 140. Поглощение ароматическими системами (производными бензола, сопряженными системами) (-ОН) , (-ОСН3), (-NH2), (-NO2) (альдегидная –СНО) – батохромный
- 141. Поглощение индикаторов Сопряженная система – следовательно сдвиг в «красную сторону», т.е. поглощают в видимой области. Присоединение
- 142. Поглощение излучения неорганическими хелатами
- 143. Комплексы с переносом заряда Перенос электрона с лиганда на металл или наоборот, т.е.внутрикомплексная ОВР. Комплексы интенсивно
- 144. ФОТОМЕТРИЯ ПРЯМАЯ ФОТО – МЕТРИЧЕС-КИЕ РЕАКЦИИ
- 145. ТРЕБОВАНИЯ В ФОТОМЕТР.РЕАКЦИЯМ
- 146. ФОТОМЕТРИЧЕСКИЕ РЕАКЦИИ ФОТО-МЕТРИЧЕС-КИЕ РЕАКЦИИ ЭКСТРАК- ЦИОННАЯ ФОТОМЕТРИЯ – РЕАКЦИЯ +ЭКСТРАКЦИЯ
- 147. КОЛИЧЕСТВЕННЫЙ АНАЛИЗ ОСНОВАН ЗА ЗАКОНЕ БУГЕРА-ЛАМБЕТРА-БЕРА МЕТОДО ОДНОГО СТАНДАРТА; МЕТОД ДОБАВОК; ИЗМЕРЕНИЕ ОТНОСИТЕЛЬНОЙ ОПТИЧЕСКОЙ ПЛОТНОСТИ
- 150. МЕТОД ФИРОРДТА
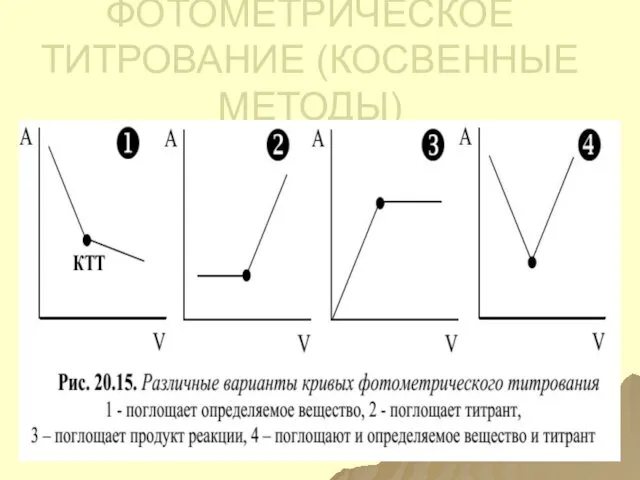
- 151. ФОТОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ (КОСВЕННЫЕ МЕТОДЫ)
- 152. ОТНОСИТЕЛЬНАЯ ОПТИЧЕСКАЯ ПЛОТНОСТЬ
- 153. МЕТОДЫ РАСЧЕТА КОНЦЕНТРАЦИЙ 1) ГРАФИЧЕСКИЙ; 2) РАСЧЕТНЫЙ
- 154. Фармацевтический анализ (УФ-спектроскопия)
- 155. Применяется в клиническом анализе Барбитураты в щелочном растворе (λ=252нм) NADH (λ=340нм) Креатитнин крови в щелочном растворе
- 156. Ограничения закона Бугера-Ламберта-Бера. 1. Справедлив для монохроматического света 2. Коэффициент ε зависит от показателя преломления среды
- 157. ЛЮМИНЕСЦЕНЦИЯ ЭМИССИОННАЯ МОЛЕКУЛЯРНАЯ СПЕКТРОСКОПИЯ
- 158. Определение люминесценции Люминесценция – это излучение, превышающее тепловое при данной температуре и имеющее длительность послесвечения много
- 159. Люминесценция Испускание ЭЛЕКТРОМАГНИТНОГО излучения оптического диапазона, возникающие в результате электронного перехода при их возвращении из возбужденного
- 160. Люминесцентная спектрометрия Группа эмиссионных спектроскометрических методов анализа, основанных на явлении люминесценции
- 161. Люминофоры Кристаллофосфорами называют сложные неорганические кристаллы, способные люминесцировать.
- 162. ИЗЛУЧАТЕЛЬНЫЕ ПЕРЕХОДЫ Переходы при излучении атомов
- 163. По длительности послесвечения люминеценция делится Флуоресценция, т.е. затухание люминесценции происходит очень быстро. Фосфоресценция, в этом случае
- 164. Причина различий – механизм возбуждения атомов Квантовые числа электронов в атоме: n, l, m, s. S
- 165. Флуоресценция Излучательный переход между состояниями, имеющими одинаковую мультиплетность.
- 166. Время жизни триплетного состояния Время жизни триплетного состояния – 10-3-102сек. Следова-тельно - можно наблюдать невооруженным глазом.
- 167. Фосфоресценция Излучательный переход между состояниями, имеющими разную мультиплетность.
- 168. БЕЗ-ИЗЛУЧАТЕЛЬНЫЕ ПЕРЕХОДЫ Переходы при излучении атомов
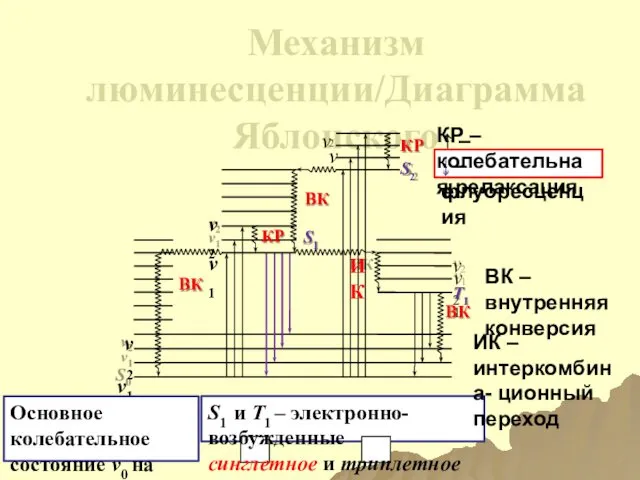
- 169. Механизм люминесценции/Диаграмма Яблонского ν2 ν1 S0 КР S2 ВК ИК КР ВК 2 ν 1 ν
- 170. Основные виды люминесценции по способу возбуждения атомов
- 171. Фотолюминесценция – возбуждение происходит в результате поглощения молекулами или атомами вещества электромагнитной энергии.
- 172. Катодолюминесценция – возбуждение производится электронным ударом по атомам или молекулам вещества (наблюдается в кинескопах, электронно-лучевых трубках
- 173. Электролюминесценция – возбуждение атомов и молекул производится электрическим полем.
- 174. Рентгенолюминесценция возбуждение производится рентгеновскими лучами
- 175. –. Хемилюминесценция в результате химической реакции между молекулами А и В образуется их соединение АВ* в
- 176. Биолюминесценция – возбуждение молекул происходит в результате биохимических реакций, протекающих в живом организме.
- 177. Тушение флуоресценции – ТЕМПЕРАТУРНОЕ И КОНЦЕНТРАЦИОННОЕ
- 178. Основные законы люминесценции
- 179. Правило М.Каши Спектр люминесценции не зависит от длины волны возбуждающего света
- 180. Правило Стокса-Ломмеля Как правило, спектр люминесценции в целом и его максимум всегда сдвинуты по сравнению со
- 181. Правило В.Л.Левшина Для многих веществ нормированные спектры поглощения (только самая длинноволновая полоса) и флуоресценции, изображенные в
- 182. Правило Левшина Важной характеристикой спектров возбуждающего и люминесцирующего излучений является их зеркальная симметрия (правило Левшина). Положение
- 183. Уравнение Ломакина-Шайбе Зависимость между интенсивностью атомно-эмиссионных спектральных линий и концентрацией элемента в пробе: I = aCb
- 184. Эффект Шпольского Превращение спектра флуоресценции органического вещества в линейчатый при помещении флуоресцирующего вещества в специальную среду
- 185. Энергетические характеристики эмиссии
- 186. Квантовый выход Отношение числа испускаемых фотонов к числу поглощаемых.
- 187. Энергетический выход Отношение энергии излучаемого света к энергии поглощаемого
- 188. Применение методов эмиссионной спектроскопии для фармацевтического анализа (УИРС-3)
- 189. Люминесцентное титрование Люминесцентное титрование как отдельный вид титрования не существует, он относится к одному из видов
- 190. Достоинства метода Высокая специфичность по отношению к данной реакции. Высокая селективность Простота методик Относительная дешевизна реактивов
- 191. Люминесцентное титрование Хемилюминесцентные индикаторы излучают собственный свет в процессе окислительно-восстановительных реакций, при реакциях нейтрализации. Удобны при
- 192. ПРИМЕР Хорошие результаты получены при титровании в присутствии хемилюминесцентных индикаторов. В щелочной среде люцигенин ( диметилакридиния
- 193. ПРИМЕР В аналитической практике хемилюминесцентные реакции используют: 1) для установления точки эквивалентности при титровании мутных или
- 194. Иодометрическое титрование сульфитов изучено наиболее полно и широко применяется. Кольтгоф рекомендует приливать раствор сульфита к раствору
- 195. Хемилюминесцентные индикаторы могут быть использованы для определения содержания кислот в темноокрашенных жирах и маслах, для аргeнтометрич.
- 197. Скачать презентацию






































































































































































 Заломлення світла
Заломлення світла Ходова частина БТР-80
Ходова частина БТР-80 Прогнозирование отбраковки авиационных пар трения
Прогнозирование отбраковки авиационных пар трения Физические основы архитектурной светотехники
Физические основы архитектурной светотехники Тепловые явления. Температура. Урок физики. 8 класс
Тепловые явления. Температура. Урок физики. 8 класс Дифракция света
Дифракция света Статическое электричество
Статическое электричество Что называют волнами?
Что называют волнами? Кинематические характеристики движения точки
Кинематические характеристики движения точки Презентация по теме Разделы механики для 10 класса
Презентация по теме Разделы механики для 10 класса Оружие ведущее к победе
Оружие ведущее к победе Применение интерференции в технике
Применение интерференции в технике Экологические проблемы работы АЭС
Экологические проблемы работы АЭС Роль испарения и конденсации в природе, в жизни человека и животных
Роль испарения и конденсации в природе, в жизни человека и животных Презентация к уроку Исследование капиллярных свойств столовых салфеток. Урок-контрольная закупка.
Презентация к уроку Исследование капиллярных свойств столовых салфеток. Урок-контрольная закупка. История связи. Виды телеграфной связи и основные этапы ее развития
История связи. Виды телеграфной связи и основные этапы ее развития Ремонтный процесс Standox Nissan KAB Ultimate Metal Silver. Тренинговая информация
Ремонтный процесс Standox Nissan KAB Ultimate Metal Silver. Тренинговая информация Кинематика тела. Лекция 7
Кинематика тела. Лекция 7 Качество электрической энергии
Качество электрической энергии Биологические мембраны. Биоэлектрогенез
Биологические мембраны. Биоэлектрогенез Презентация Материальная точка. Система отсчёта
Презентация Материальная точка. Система отсчёта Электрические тали
Электрические тали Динамика. Классическая механика. Законы Ньютона
Динамика. Классическая механика. Законы Ньютона Звуковые волны
Звуковые волны Переменный ток
Переменный ток Технологический процесс ремонта КПП М16А автомобиля Suzuki Liana
Технологический процесс ремонта КПП М16А автомобиля Suzuki Liana Электрические цепи постоянного тока. Лекция 1
Электрические цепи постоянного тока. Лекция 1 Устройство механической коробки передач
Устройство механической коробки передач