Содержание
- 2. Демокрит 460–370 гг. до н.э. Говорил, что существует предел деления — атом.
- 3. Аристотель 384–322 гг. до н.э. Считал, что делимость вещества бесконечна.
- 4. События, послужившие толчком к подробному изучению строение атома Открытие в 1895 году рентгеновского излучения. Открытие радиоактивности
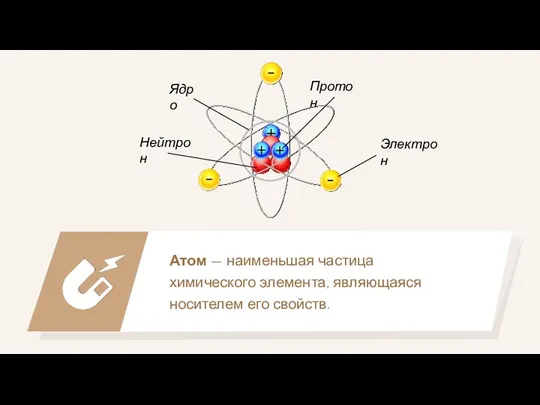
- 5. Атом — наименьшая частица химического элемента, являющаяся носителем его свойств. Ядро Электрон Протон Нейтрон
- 6. - + 1,6 ∙ 10-19 Кл
- 7. где — число протонов Zp Ee № = = Zp — число электронов Ee — порядковый
- 8. Джозеф Джон Томсон 1856–1940 гг. Английский физик. Предложил первую модель атома.
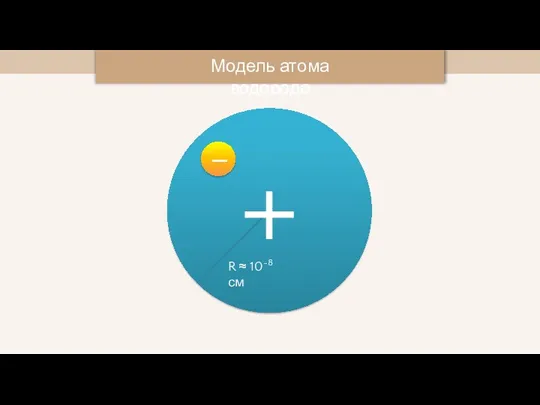
- 9. + Модель атома водорода R ≈ 10-8 см
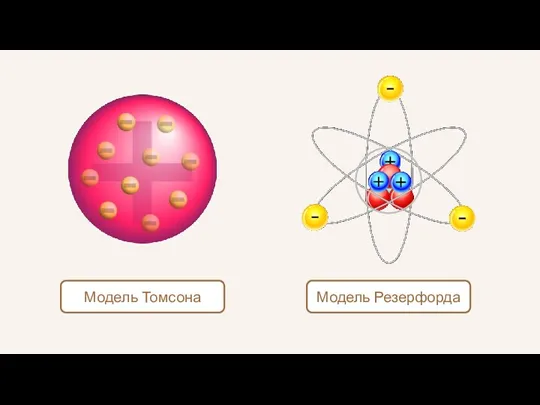
- 10. Джозеф Джон Томсон 1856–1940 гг. Модель атома Томсона оказалась в полном противоречии с опытами по исследованию
- 11. Эрнест Резерфорд 1871–1937 гг. Великий английский физик. Своими экспериментальными открытиями заложил основы современного учения о строении
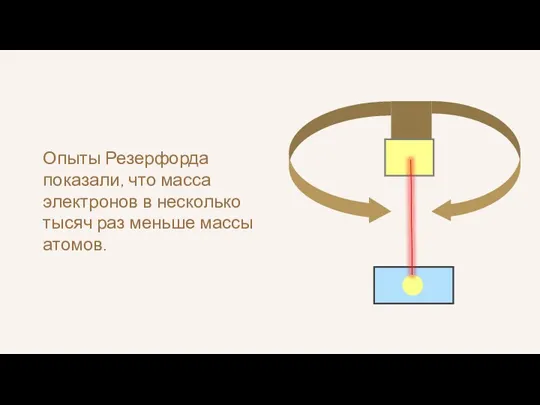
- 12. Опыты Резерфорда показали, что масса электронов в несколько тысяч раз меньше массы атомов.
- 13. Эрнест Резерфорд 1871–1937 гг. В 1906 году предложил применить зондирование атома с помощью α-частиц для экспериментального
- 14. Радий Их масса примерно в 8000 раз больше массы электрона, а положительный заряд равен по модулю
- 15. Скорость α-частиц
- 16. Опыт Резерфорда с α-частицами Фотографии люминесцирующего экрана при отсутствии золотой фольги в потоке α-частиц и при
- 17. Эрнест Резерфорд 1871–1937 гг. Продолжая опыты, Резерфорд и его помощники обнаружили, что какая-то часть α-частиц отклоняется
- 18. Эрнест Резерфорд 1871–1937 гг. Обобщая результаты своих опытов, предложил ядерную (планетарную) модель строения атома. Ядро Электрон
- 19. Модель Томсона Модель Резерфорда
- 20. Максимальная сила отталкивания определяется по закону Кулона. Закон Кулона
- 21. + Атомное ядро — тело малых размеров, в котором сконцентрированы почти вся масса и весь положительный
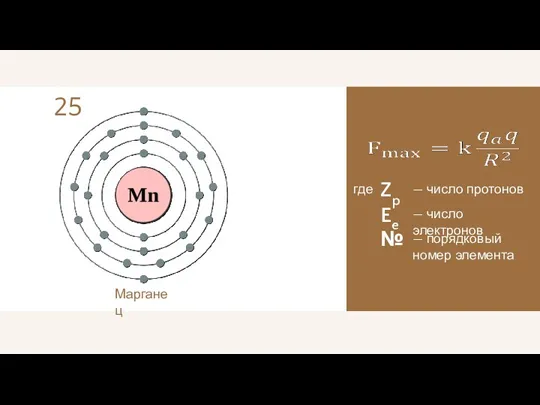
- 22. 25 Марганец где — число протонов Zp — число электронов Ee — порядковый номер элемента №
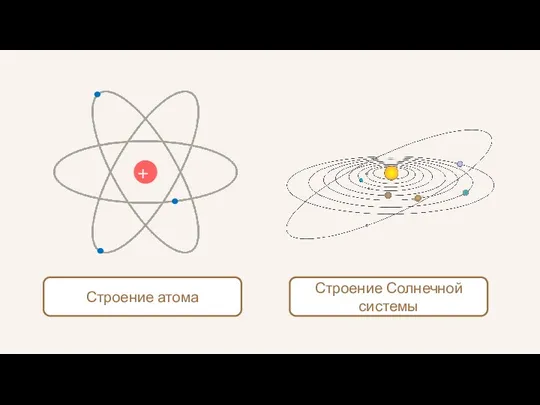
- 23. + Строение атома Строение Солнечной системы
- 24. Водород Ядро атома водорода имеет положительный заряд, равный по модулю заряду электрона, и массу, примерно в
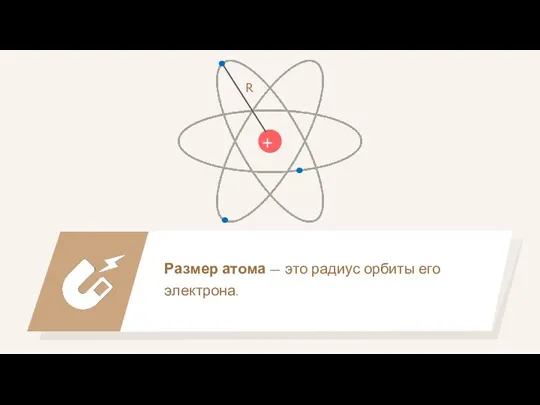
- 25. Размер атома — это радиус орбиты его электрона. + R
- 27. Скачать презентацию
















 От полевого аппарата до мобильной связи. История телефона
От полевого аппарата до мобильной связи. История телефона Диффузия
Диффузия Влияние солнца на организм человека
Влияние солнца на организм человека Коэффициент полезного действия (КПД) механизма
Коэффициент полезного действия (КПД) механизма Законы Ньютона
Законы Ньютона Закат как физическое явление
Закат как физическое явление Виды теплопередачи. Теплопроводность. Конвекция. Излучение
Виды теплопередачи. Теплопроводность. Конвекция. Излучение Урок в 9 классе Импульс
Урок в 9 классе Импульс Корпускулярно-волновой дуализм
Корпускулярно-волновой дуализм Причины выхода из строя подшипников качения
Причины выхода из строя подшипников качения Телеграф и перевернутая пирамида
Телеграф и перевернутая пирамида Основы технической механики. Связи и их реакции. Тема 2
Основы технической механики. Связи и их реакции. Тема 2 Теплотехника. Термодинамика
Теплотехника. Термодинамика Синтез высокооктановых компонентов топлива
Синтез высокооктановых компонентов топлива Презентации 7 класс: ВВЕДЕНИЕ
Презентации 7 класс: ВВЕДЕНИЕ Законы постоянного тока. 10 класс
Законы постоянного тока. 10 класс Выставка удивительных вещей (Шуточная экспозиция на физическую тему)
Выставка удивительных вещей (Шуточная экспозиция на физическую тему) Электромагнитные явления. Магнитное поле и его свойства. (8 класс)
Электромагнитные явления. Магнитное поле и его свойства. (8 класс) Три состояния вещества
Три состояния вещества Ядерный реактор
Ядерный реактор Проблемы энергосбережения и ресурсосбережения в теплоэнергетике. Оребрение стенок
Проблемы энергосбережения и ресурсосбережения в теплоэнергетике. Оребрение стенок Энергия электрического поля
Энергия электрического поля Ядерный реактор
Ядерный реактор Вихревое электрическое поле. 11 класс
Вихревое электрическое поле. 11 класс Сила Лоренца и её применение
Сила Лоренца и её применение Энергия. Потенциальная и кинетическая энергия тел
Энергия. Потенциальная и кинетическая энергия тел Реферат вол.гравит. Сидоров1РФ41
Реферат вол.гравит. Сидоров1РФ41 Что такое сила?
Что такое сила?