Содержание
- 2. Список литературы Теплотехника. Учебник для ВУЗов. / Под ред. А.П. Баскакова . М., Энергоатомиздат. 1991. –
- 3. Основные понятия термодинамики Техническая термодинамика изучает закономерности взаимного превращения тепловой и механической энергии и свойства тел,
- 4. Термодинамическая система Термодинамическая система представляет собой совокупность материальных тел, находящихся в механическом и тепловом взаимодействиях друг
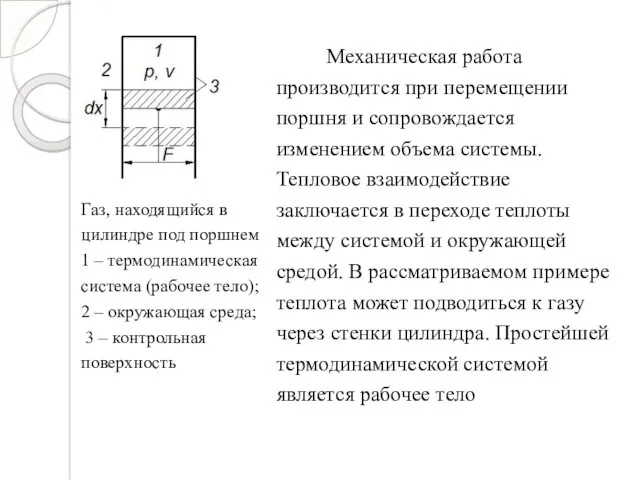
- 5. Газ, находящийся в цилиндре под поршнем 1 – термодинамическая система (рабочее тело); 2 – окружающая среда;
- 6. ПАРАМЕТРЫ СОСТОЯНИЯ Свойства каждой системы характеризуются рядом величин, которые принято называть термодинамическими параметрами. Рассмотрим некоторые из
- 7. ДАВЛЕНИЕ В Международной системе единиц (СИ) давление выражается в паскалях 1 Па=1 Н/м2. Удобнее использовать 1
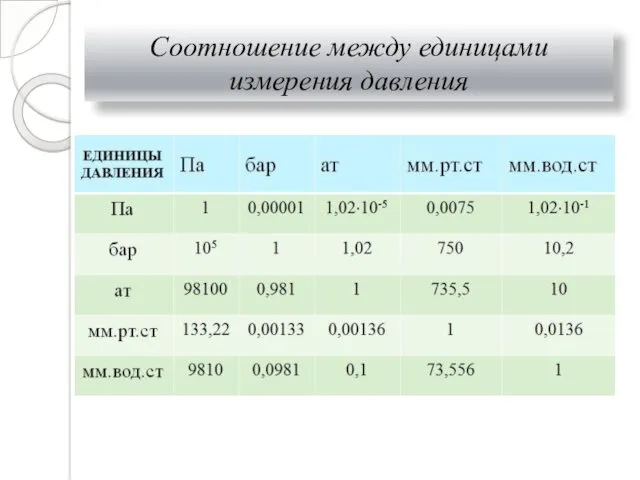
- 8. Соотношение между единицами измерения давления
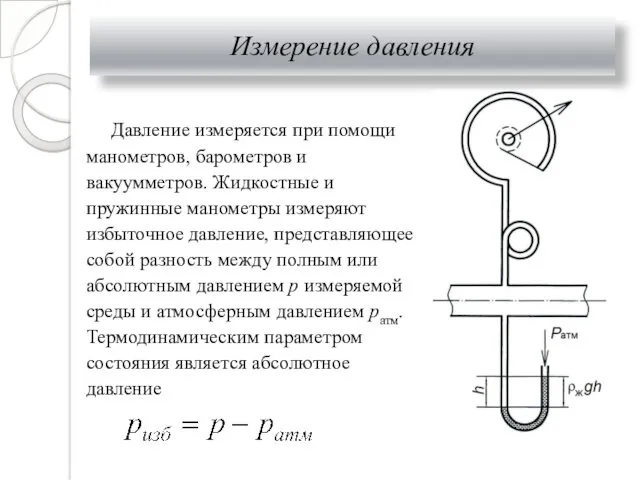
- 9. Измерение давления Давление измеряется при помощи манометров, барометров и вакуумметров. Жидкостные и пружинные манометры измеряют избыточное
- 10. Температура Температурой называется физическая величина, характеризующая степень нагретости тела. Если две системы находятся в тепловом контакте,
- 11. УДЕЛЬНЫЙ ОБЪЕМ V – ЭТО ОБЪЕМ ЕДИНИЦЫ МАССЫ ВЕЩЕСТВА. Если однородное тело массой М занимает объем
- 12. Уравнение состояния Основные параметры: удельный объем, температура и давление простейших систем, которыми являются газы, пары или
- 13. Газовая постоянная В соответствии с законом Авогадро (1811 г.) объем 1 моля, одинаковый в одних и
- 14. Термодинамический процесс Изменение состояния термодинамической системы во времени называется термодинамическим процессом. Так, при перемещении поршня в
- 15. Внутренняя энергия ВНУТРЕННЯЯ ЭНЕРГИЯ U, ДЖ В дальнейшем под внутренней энергией будем понимать энергию хаотического движения
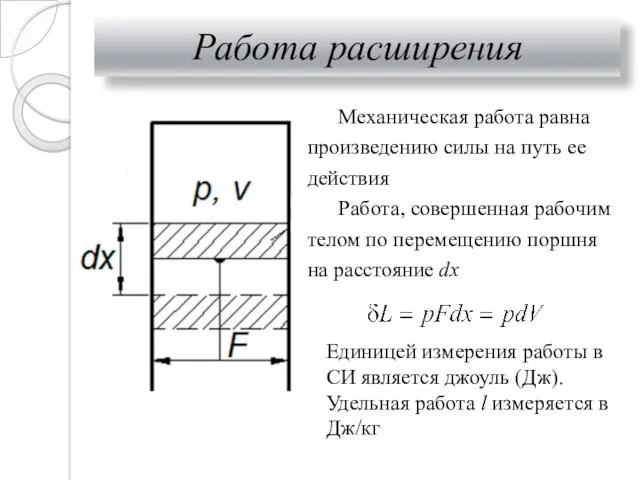
- 16. Работа расширения Механическая работа равна произведению силы на путь ее действия Работа, совершенная рабочим телом по
- 17. Работа расширения Таким образом, работа изменения объема эквивалентна площади под кривой процесса в диаграмме р, v.
- 18. Теплота Помимо макрофизической формы передачи энергии – работы существует также и микрофизическая, т.е. осуществляемая на молекулярном
- 19. Теплота, внутренняя энергия, работа ВНУТРЕННЯЯ ЭНЕРГИЯ – это свойство самой системы, она характеризует состояние системы. ТЕПЛОТА
- 20. Первое начало термодинамики Теплота, сообщаемая закрытой системе, идет на приращение ее внутренней энергии И на совершение
- 21. Теплоемкость ТЕПЛОЕМКОСТЬЮ С тела называют количество теплоты, которое нужно затратить в данном процессе, чтобы нагреть тело
- 22. Теплоемкость Изменение температуры тела при одном и том же количестве сообщаемой теплоты зависит от характера происходящего
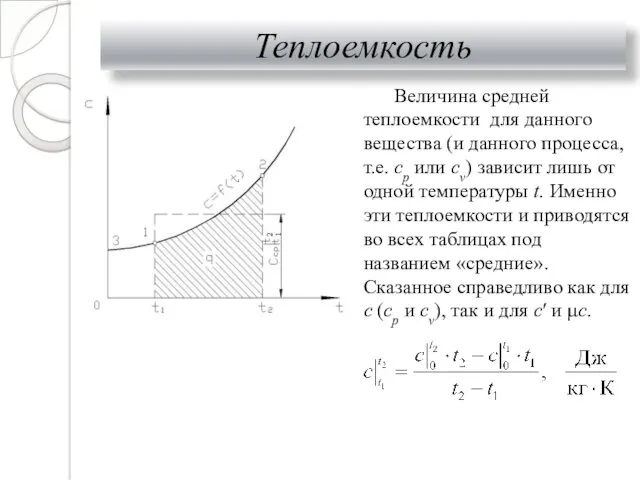
- 23. Теплоемкость Величина средней теплоемкости для данного вещества (и данного процесса, т.е. ср или cv) зависит лишь
- 24. Энтальпия В термодинамике важную роль играет сумма внутренней энергии системы U и произведения давления системы р
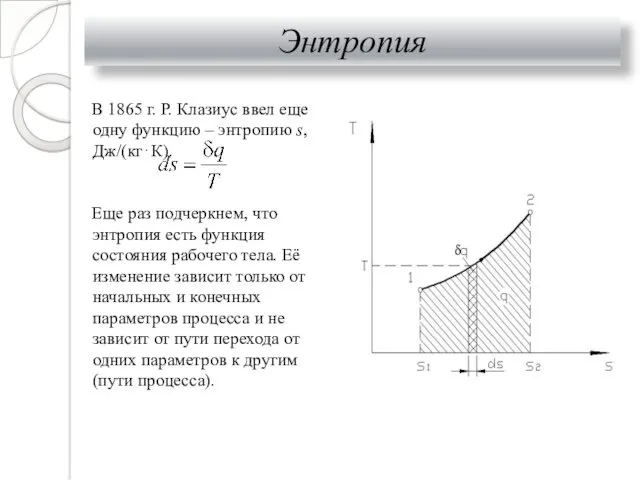
- 25. Энтропия В 1865 г. Р. Клазиус ввел еще одну функцию – энтропию s, Дж/(кг⋅К). Еще раз
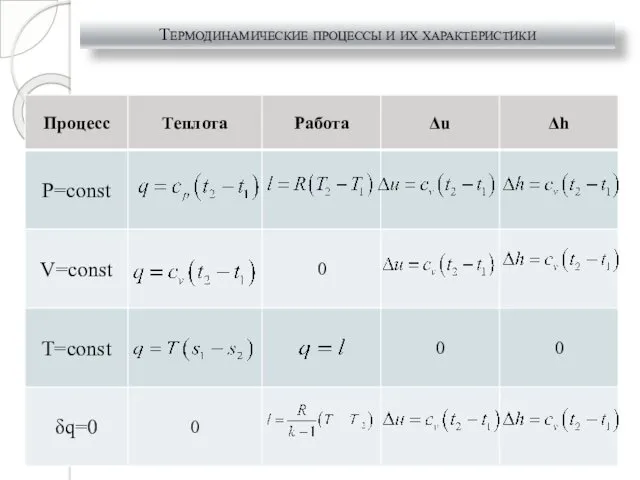
- 26. Термодинамические процессы и их характеристики
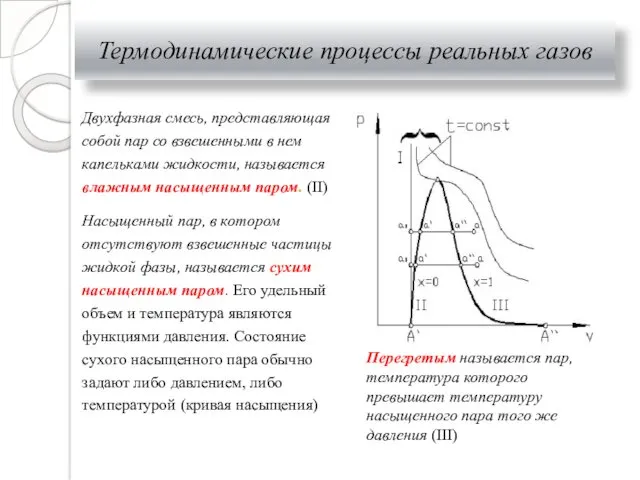
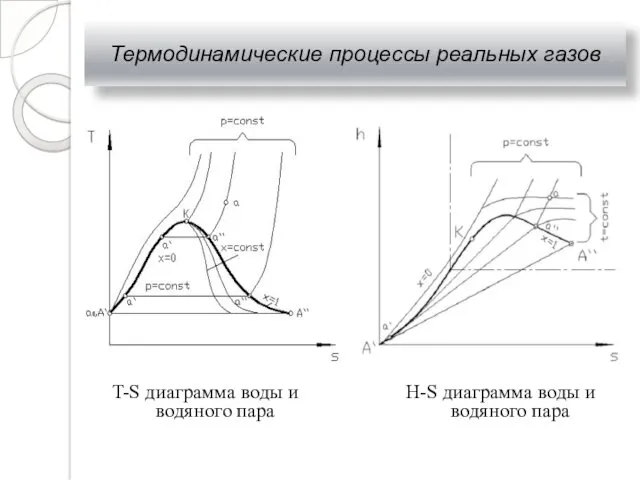
- 27. Термодинамические процессы реальных газов Двухфазная смесь, представляющая собой пар со взвешенными в нем капельками жидкости, называется
- 28. Термодинамические процессы реальных газов T-S диаграмма воды и водяного пара H-S диаграмма воды и водяного пара
- 29. Термодинамические процессы реальных газов Для воды параметры критической точки К составляют: ркр = 221,29⋅105 Па; tкр
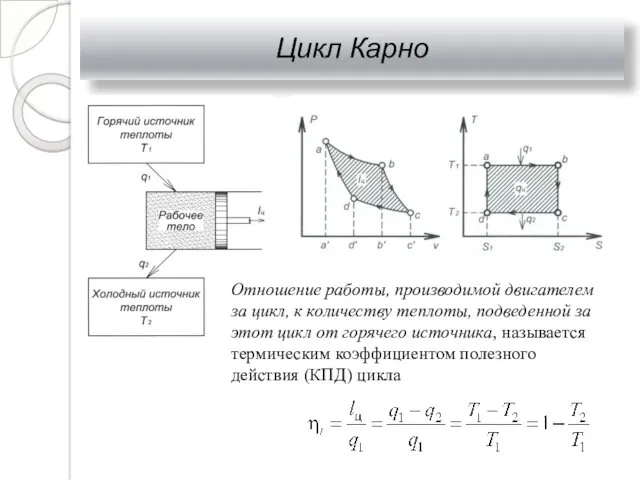
- 30. Цикл Карно Отношение работы, производимой двигателем за цикл, к количеству теплоты, подведенной за этот цикл от
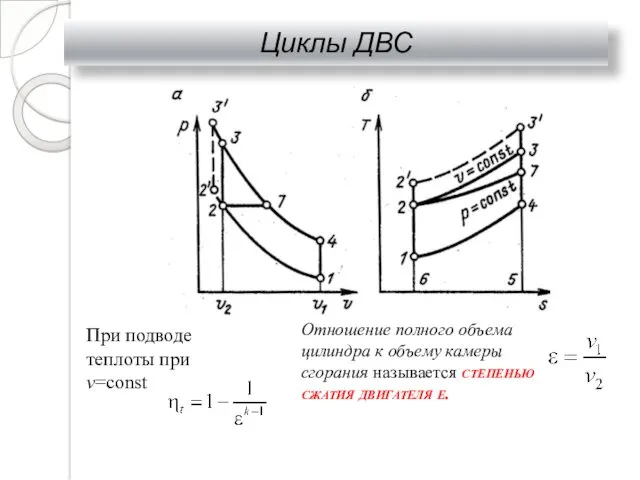
- 31. Циклы ДВС При подводе теплоты при v=const Отношение полного объема цилиндра к объему камеры сгорания называется
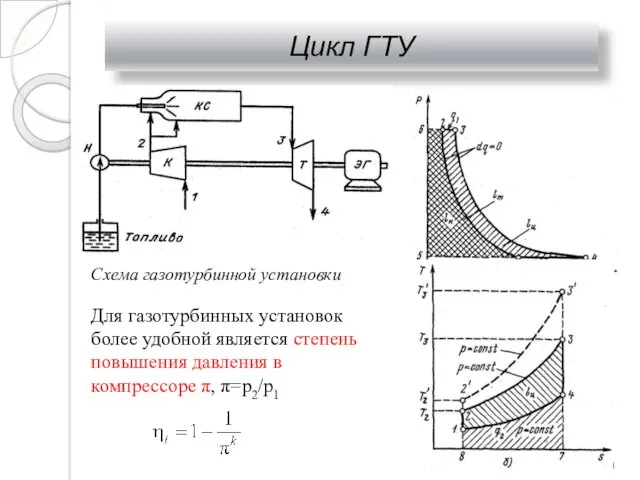
- 32. Цикл ГТУ Схема газотурбинной установки Для газотурбинных установок более удобной является степень повышения давления в компрессоре
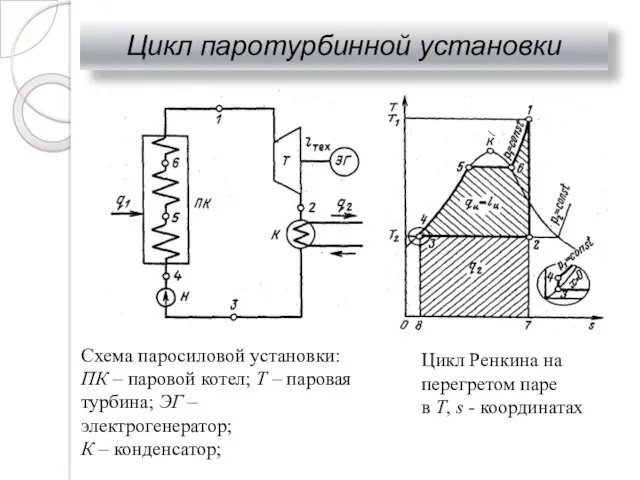
- 33. Цикл паротурбинной установки Схема паросиловой установки: ПК – паровой котел; Т – паровая турбина; ЭГ –
- 34. Цикл паротурбинной установки КПД идеального цикла Ренкина определяется значениями энтальпий пара до турбины h1 и после
- 36. Скачать презентацию




















 Сообщающиеся сосуды
Сообщающиеся сосуды Молекулярная физика и основы термодинамики
Молекулярная физика и основы термодинамики Молекулярно-кинетическая теория (МКТ)
Молекулярно-кинетическая теория (МКТ) Общий осмотр автомобиля ВАЗ 2106
Общий осмотр автомобиля ВАЗ 2106 Закони збереження
Закони збереження Явления переноса в газах. (Лекция 3)
Явления переноса в газах. (Лекция 3) Геометрическая и волновая оптика. Геометрическая оптика. Линзы. Оптическая система глаза
Геометрическая и волновая оптика. Геометрическая оптика. Линзы. Оптическая система глаза История полетов в космос
История полетов в космос Потенциал. Решение задач
Потенциал. Решение задач Испарение и конденсация. Насыщенные и ненасыщенные пары. Влажность воздуха
Испарение и конденсация. Насыщенные и ненасыщенные пары. Влажность воздуха Электромагнитная индукция
Электромагнитная индукция презентация к лабораторной работе по физике
презентация к лабораторной работе по физике Ракетные двигатели
Ракетные двигатели Урок повторения и обобщения 7 класс по теме: Давление
Урок повторения и обобщения 7 класс по теме: Давление Механика. Механическое движение
Механика. Механическое движение Методическая разработка по методике В.Ф. Шаталова для организации учебной деятельности учащихся по физике
Методическая разработка по методике В.Ф. Шаталова для организации учебной деятельности учащихся по физике Стандартные настройки САР и их применение
Стандартные настройки САР и их применение Теория линейных электрических цепей
Теория линейных электрических цепей Закон Ома для участка цепи, последовательное и параллельное соединение проводников. Физический диктант
Закон Ома для участка цепи, последовательное и параллельное соединение проводников. Физический диктант Закон Архимеда
Закон Архимеда Бытовая швейная машина
Бытовая швейная машина Решение задач по теме Геометрическая оптика
Решение задач по теме Геометрическая оптика Самофокусировка света: физическая картина
Самофокусировка света: физическая картина ур 5..Работа. Мощность
ур 5..Работа. Мощность Гравитационное притяжение эллипсоидов
Гравитационное притяжение эллипсоидов Тренажёр по формулам по физике. (7 класс)
Тренажёр по формулам по физике. (7 класс) Способы уменьшения и увеличения давления
Способы уменьшения и увеличения давления Силы в природе
Силы в природе