Содержание
- 2. Реальные газы Для реальных газов наблюдается отклонение от закона Клапейрона-Менделеева, кроме того, при некоторых значениях внешних
- 3. Переход идеального газа из неравновесных состояний в равновесное происходит благодаря так называемым явлениям переноса — 1)диффузии,
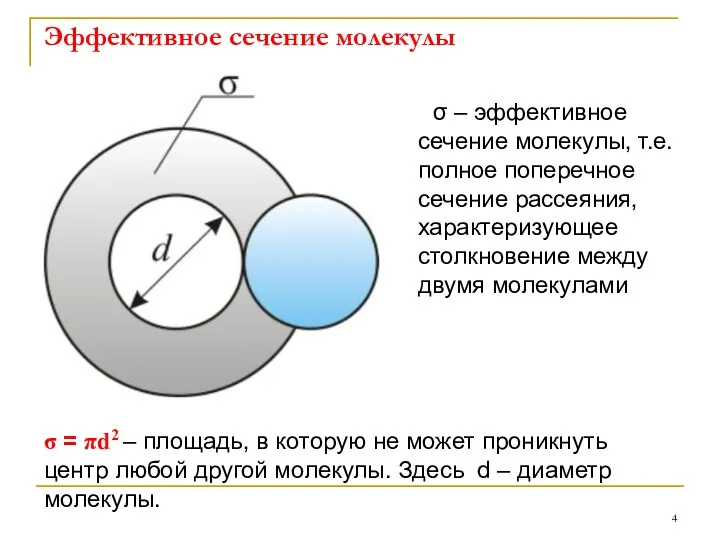
- 4. Эффективное сечение молекулы σ – эффективное сечение молекулы, т.е. полное поперечное сечение рассеяния, характеризующее столкновение между
- 5. Найдем среднее число столкновений, испытываемых одной молекулой в единицу времени. Представим молекулу в виде шара диаметром
- 6. Число столкновений в единицу времени n – число частиц в единице объема длина свободного пробега равна
- 7. Явления переноса в газах Молекулы газа при хаотическом движении, взаимодействуют друг с другом, перемещаются на значительные
- 8. Т.о. за единицу времени переносится величина Изменение величины Н на единице длины dx (dH/dx) называется градиентом
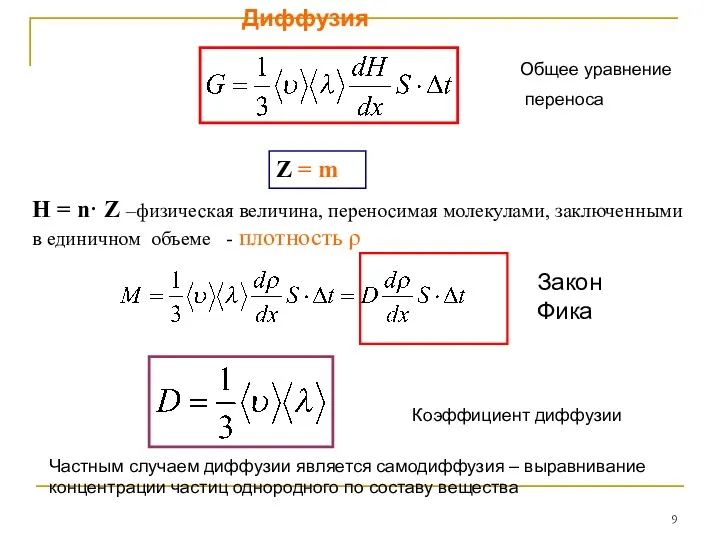
- 9. Диффузия Z = m Н = n· Z –физическая величина, переносимая молекулами, заключенными в единичном объеме
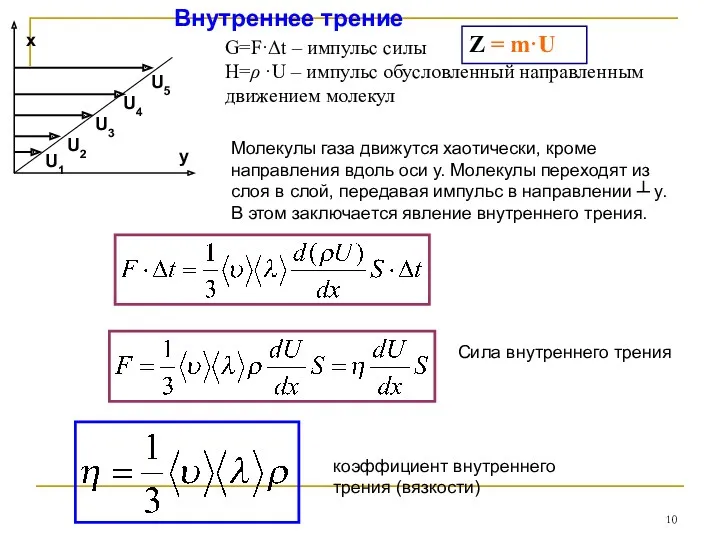
- 10. Внутреннее трение Молекулы газа движутся хаотически, кроме направления вдоль оси у. Молекулы переходят из слоя в
- 11. Межмолекулярное взаимодействие Межмолекулярные силы притяжения Поляризационные силы обусловлены несимметричностью распределения зарядов в нейтральной в целом молекуле
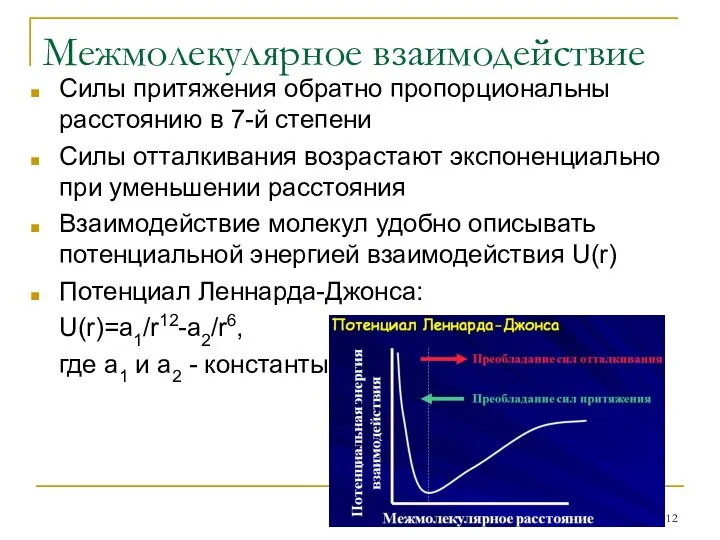
- 12. Межмолекулярное взаимодействие Силы притяжения обратно пропорциональны расстоянию в 7-й степени Силы отталкивания возрастают экспоненциально при уменьшении
- 13. Межмолекулярное взаимодействие В уравнении Ван-дер-Ваальса применяется более грубая аппроксимация – молекулы считаются абсолютно твёрдыми шарами с
- 14. Уравнение Ван-дер-Ваальса Учтём влияние сил отталкивания. Конечный объём молекул приводит к уменьшению доступного объёма и увеличению
- 15. Уравнение Ван-дер-Ваальса Теперь учтём влияние сил притяжения. Оно проявляется в появлении избыточного давления: P+Pi=n⋅k⋅T, где Pi
- 16. Уравнение Ван-дер-Ваальса
- 17. Уравнение Ван-дер-Ваальса Учитывая совместное действие сил притяжения и отталкивания получим окончательно уравнение Ван-дер-Ваальса: (P+a/V2)⋅(V-b)=R⋅T для ν
- 19. Другие уравнения состояния Уравнение Дитеричи: P⋅(V-b)=R⋅T⋅exp(-a/[R⋅T⋅V]) в пределе b
- 20. Другие уравнения состояния Уравнение Бертло: (P+a/(Т⋅V2))⋅(V-b)=R⋅T Уравнение Клаузиуса: здесь улучшение достигается за счёт введения третьего параметра
- 21. Другие уравнения состояния Уравнение Камерлинг-Оннеса: P⋅V=R⋅T(1+B2(T)/V+B3(T)/V2+…), где В2, В3, …- второй, третий и т.д. вириальные коэффициенты
- 22. Изотермы Ван-дер-Ваальса Уравнение Ван-дер-Ваальса можно привести к виду: P⋅V3-(R⋅T+P⋅b)⋅V2+a⋅V-a⋅b=0 (*) это кубическое уравнение относительно V при
- 23. Изотермы Ван-дер-Ваальса Приравнивая коэффициенты при одинаковых степенях V, получим: Рк⋅Vк3=a⋅b, 3Рк⋅Vк2=a, 3Рк⋅Vк=R⋅Tк+Pк⋅b Из этих трёх уравнений
- 24. Изотермы Ван-дер-Ваальса Расхождение экспериментальных и теоретических значений свидетельствует о неточности уравнения Ван-дер-Ваальса.
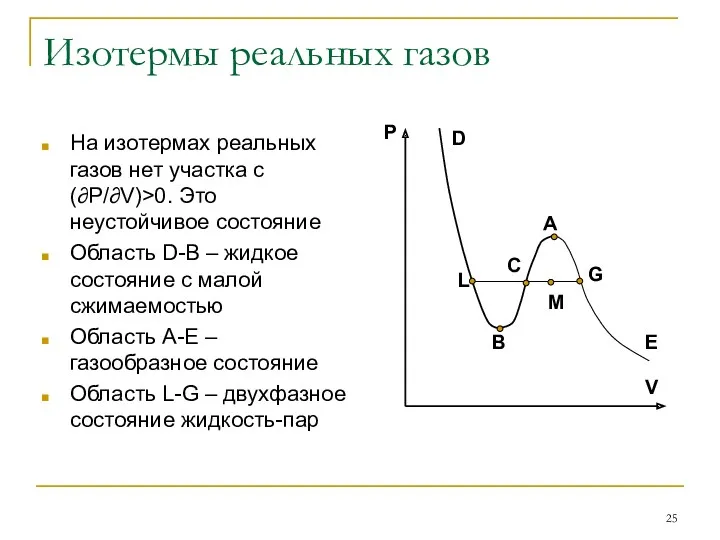
- 25. Изотермы реальных газов На изотермах реальных газов нет участка с (∂P/∂V)>0. Это неустойчивое состояние Область D-B
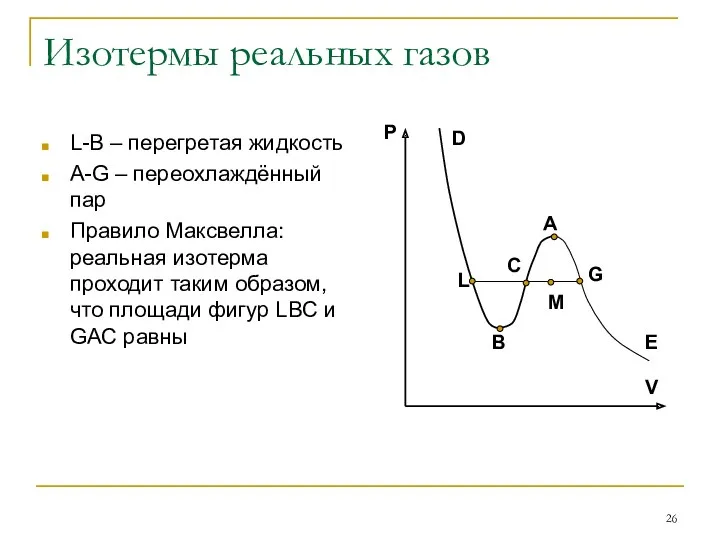
- 26. Изотермы реальных газов L-B – перегретая жидкость A-G – переохлаждённый пар Правило Максвелла: реальная изотерма проходит
- 27. Перегретая жидкость
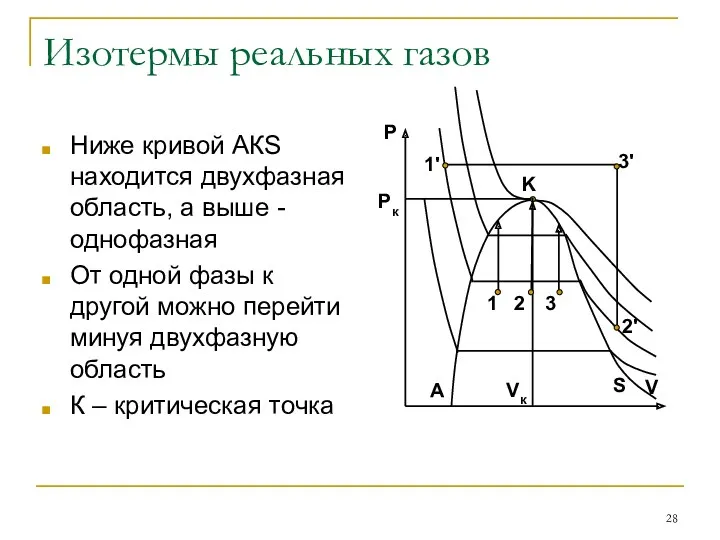
- 28. Изотермы реальных газов Ниже кривой АКS находится двухфазная область, а выше - однофазная От одной фазы
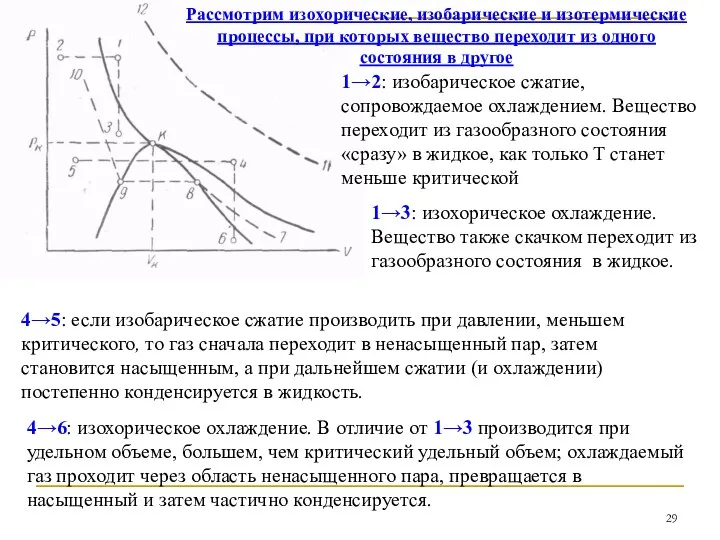
- 29. Рассмотрим изохорические, изобарические и изотермические процессы, при которых вещество переходит из одного состояния в другое 1→2:
- 30. 7→8 →9 →10: изотермический процесс. 7 имеется ненасыщенный пар 8 насыщенное состояние, в которое путем сжатия
- 31. Критическое состояние
- 32. Впервые явление критического состояния вещества было обнаружено в 1822 году Шарлем Каньяром де Ла-Туром, а в
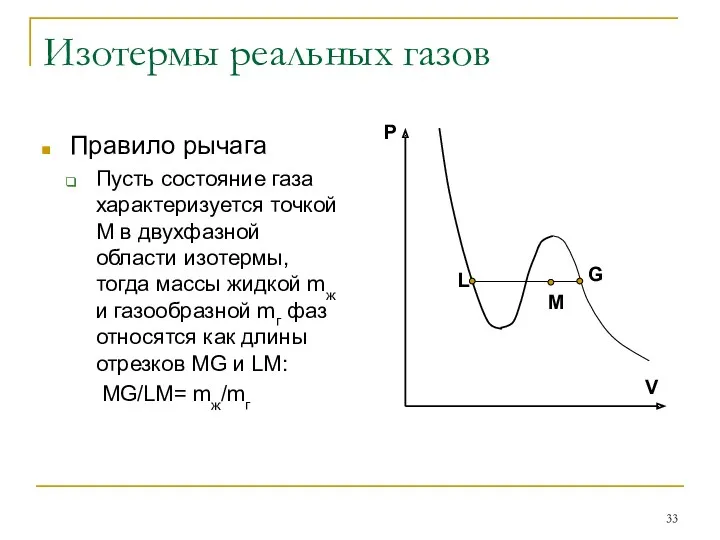
- 33. Изотермы реальных газов Правило рычага Пусть состояние газа характеризуется точкой М в двухфазной области изотермы, тогда
- 34. Внутренняя энергия газа Ван-дер-Ваальса. Для однофазных состояний: Потенциальная энергия межмолекулярных сил Взаимодействия вычисляется как работа, которую
- 35. Эффект Джоуля-Томсона Эффект Джоуля-Томсона заключается в изменении температуры газа при его прохождении через малое отверстие (дросселировании)
- 36. Эффект Джоуля-Томсона При b=0, а≠0 газ всегда охлаждается При b≠0, а=0 – всегда нагревается Существует температура
- 37. Методы получения низких температур Испарение жидкости Эффект Джоуля-Томсона Адиабатическое расширение газа Растворение одного вещества в другом
- 39. Скачать презентацию













![Другие уравнения состояния Уравнение Дитеричи: P⋅(V-b)=R⋅T⋅exp(-a/[R⋅T⋅V]) в пределе b](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/370434/slide-18.jpg)













 Електромагнітні хвилі
Електромагнітні хвилі Основные понятия и законы динамики
Основные понятия и законы динамики Mechanical System
Mechanical System Архимедова сила. Подготовка к ГИА
Архимедова сила. Подготовка к ГИА Introduction & overview
Introduction & overview Формирование регулятивных универсальных учебных действий на уроках физики при проведении лабораторной работы
Формирование регулятивных универсальных учебных действий на уроках физики при проведении лабораторной работы Конструкції кип’ятильників і водонагрівальних пристроїв
Конструкції кип’ятильників і водонагрівальних пристроїв Использование полного внутреннего отражения
Использование полного внутреннего отражения Механика, оның бөлімдері және қозғалысты оқып үйренуде қолданылатын абстракциялық ұғымдар
Механика, оның бөлімдері және қозғалысты оқып үйренуде қолданылатын абстракциялық ұғымдар Вынужденные колебания
Вынужденные колебания Физические основы гемодинамики
Физические основы гемодинамики Изобретение электричества. История, применение, получение
Изобретение электричества. История, применение, получение 1949 – 1989 - 1991
1949 – 1989 - 1991 Энергия связи. Дефект масс
Энергия связи. Дефект масс Открытие нейтрона
Открытие нейтрона Электроспиннинг
Электроспиннинг Состояние электронов в атоме
Состояние электронов в атоме Механические свойства материалов. Диаграммы растяжения и сжатия. (Лекция 4)
Механические свойства материалов. Диаграммы растяжения и сжатия. (Лекция 4) Проявление сил тяжести и упругости живой природе
Проявление сил тяжести и упругости живой природе Від рівноважного випромінювання до лазера
Від рівноважного випромінювання до лазера Распиливание и припасовка
Распиливание и припасовка Исследовательский проект Машина Голдберга Разбивалка яйиц
Исследовательский проект Машина Голдберга Разбивалка яйиц презентация Обнаружение магнитного поля по его действию на электрический ток
презентация Обнаружение магнитного поля по его действию на электрический ток Определение перемещений в плоских стержневых конструкциях
Определение перемещений в плоских стержневых конструкциях Механика. Механическое движение
Механика. Механическое движение Кинематика точки
Кинематика точки Влияние наушников на слух человека
Влияние наушников на слух человека Обобщающий урок по теме Движение и взаимодействие тел
Обобщающий урок по теме Движение и взаимодействие тел