Техническая термодинамика. Термодинамичекие потенциалы. Эффект Джоуля-Томсона. (Лекция 5) презентация
Содержание
- 2. Описание равновесных термодинамических процессов может быть выполнено с помощью метода термодинамических потенциалов, разработанного в 1873 -
- 3. В зависимости от выбора двух независимых параметров можно ввести термодинамические потенциалы, дифференцирование которых дает возможность определить
- 4. Использование в качестве независимых параметров V и S не очень удобно, так как величина энтропии не
- 5. Если процесс происходит при постоянном давлении (P = const), то учитывая формулу TdS = δQ, имеем
- 6. 3 Если в качестве независимых параметров выбрать объем V и температуру T Термодинамический потенциал Ψ(V,T) называется
- 7. Термодинамические потенциалы При описании необратимого процесса необходимо применять неравенство Если в системе происходит необратимый процесс, при
- 8. 4 При выборе в качестве независимых переменных давления P и температуры T и введения функции состояния
- 9. Между термодинамическими потенциалами могут быть установлены соотношения, позволяющие выразить одни потенциалы через другие. Уравнение Гиббса-Гельмгольца: Связь
- 10. Кроме химического потенциала можно так же ввести удельный термодинамический потенциал, рассчитанный на единицу массы вещества в
- 11. При обратимом адиабатическом расширении температура газа изменяется в соответствии с уравнением адиабаты. Для идеального газа: Эффект
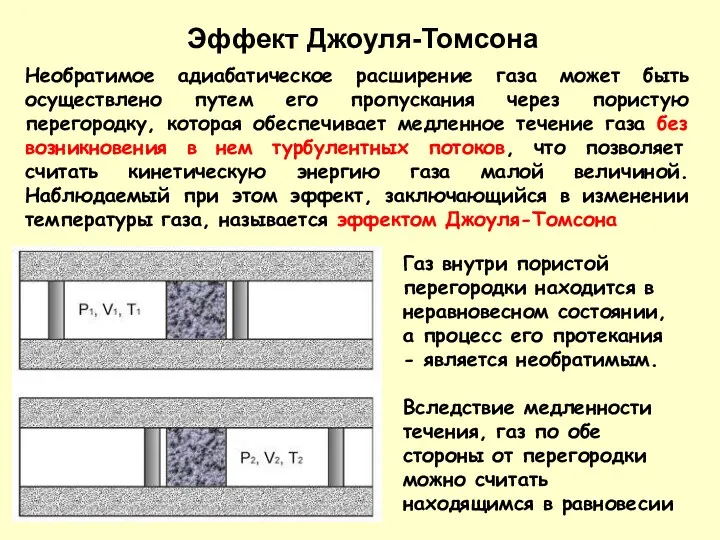
- 12. Необратимое адиабатическое расширение газа может быть осуществлено путем его пропускания через пористую перегородку, которая обеспечивает медленное
- 13. Давления P1 и P2 в обеих частях цилиндрической трубки поддерживались постоянными. Пусть при протекании через пористую
- 14. Из 1-го закона термодинамики, учитывая постоянство Р1 и Р2: Следовательно, рассматриваемый процесс является не только адиабатическим,
- 15. Полный дифференциал энтальпии: Тогда: Эффект Джоуля-Томсона Отсюда:
- 16. Из определений потенциала Гиббса: или для бесконечно малого изменения давления Подставляя полученные соотношения в выражение для
- 17. Если использовать идеальный газ, описываемый уравнением Клапейрона-Менделеева, то имеем: Следовательно, для идеального газа ΔT/ΔP = 0
- 18. Уравнение Ван-дер-Ваальса Рассмотрим применение в опыте Джоуля-Томсона газа Ван-дер-Ваальса, уравнение для одного моля которого имеет вид:
- 19. Выражая P из формулы уравнения В-д-В и подставляя в полученное выражение с последующим пренебрежением малыми слагаемыми
- 20. Эффект Джоуля-Томсона Процесс охлаждения газа может быть реализован так же с помощью обратимого адиабатического расширения. При
- 21. Эффект Джоуля-Томсона С учетом полученных выше можно записать: Для газов характерно изобарическое расширение при их нагревании.
- 23. Скачать презентацию



















 Припои и флюсы
Припои и флюсы Физика. Электростатика (продолжение)
Физика. Электростатика (продолжение) теоретические основы метрологического обеспечения
теоретические основы метрологического обеспечения Закон Кулона
Закон Кулона Решение неоднородного уравнения теплопроводности
Решение неоднородного уравнения теплопроводности Ременные передачи
Ременные передачи Использование системно-деятельностного подхода в преподавании физики
Использование системно-деятельностного подхода в преподавании физики Рупорные антенны. (Лекция 12)
Рупорные антенны. (Лекция 12) Основні положення теорії надійності. (Лекція 6)
Основні положення теорії надійності. (Лекція 6) Кинематический и силовой расчет привода винтового толкателя
Кинематический и силовой расчет привода винтового толкателя Элементы физики твердого тела. Статистика Бозе-Эйнштейна и Ферми-Дирака. Лекция 5
Элементы физики твердого тела. Статистика Бозе-Эйнштейна и Ферми-Дирака. Лекция 5 Дисперсия света
Дисперсия света Diesel and petrol power
Diesel and petrol power Строительная механика пластин. Изгиб пластин
Строительная механика пластин. Изгиб пластин Термодинамические системы и термодинамические параметры
Термодинамические системы и термодинамические параметры Оптика - раздел физики
Оптика - раздел физики РБМК (реактор большой мощности канальный). Лекция 8
РБМК (реактор большой мощности канальный). Лекция 8 Презентация по теме Внутренняя энергия и способы ее изменения8кл
Презентация по теме Внутренняя энергия и способы ее изменения8кл Обзор методов решения задач теплопроводности
Обзор методов решения задач теплопроводности Перемещение при прямолинейном движении
Перемещение при прямолинейном движении Нахождение удельной теплоты плавления льда в опытах по плавлению льда нагретыми металлическими цилиндрами
Нахождение удельной теплоты плавления льда в опытах по плавлению льда нагретыми металлическими цилиндрами Основы теории автоматического управления. Устойчивость САУ. Лекция 11
Основы теории автоматического управления. Устойчивость САУ. Лекция 11 КВН
КВН Структура и взаимодействие адронов
Структура и взаимодействие адронов Холодильные установки. Криогенные жидкости. Компрессоры
Холодильные установки. Криогенные жидкости. Компрессоры Кинематический расчет привода
Кинематический расчет привода Закон Паскаля. Сполучені посудини
Закон Паскаля. Сполучені посудини Сообщающиеся сосуды
Сообщающиеся сосуды