Содержание
- 2. В термодинамике важную роль играет сумма внутренней энергии системы U и произведения давления системы p на
- 3. Изменение энтальпии в любом процессе определяется только начальным и конечным состоянием системы и не зависит от
- 4. Выражение vdp называется элементарной технической работой А0: Энтальпия Для идеального газа с учетом, что cv =
- 5. Энтропия Энтропия – одностороннее изменение (греч.) δQ – не является полным дифференциалом. Необходимо знать p =
- 6. Введенная функция называется энтропией S, Дж/К Удельная энтропия s, Дж/(кг*К): Энтропия Аналитически энтропия определяется как: Значение
- 7. Теорема Нернста: По мере приближения температуры к 0 К энтропия всякой равновесной системы при изотермических процессах
- 8. Продифференцируем уравнение Клапейрона и разделим обе части уравнения на (pv) Энтропия Подставим выражение для dv/v в
- 9. Формулировка II-го закона: Энтропия закрытой системы не может убывать В обратимых процессах она (энтропия) остается постоянной,
- 10. Очевидно, что в TS диаграмме элементарная теплота процесса изображается площадкой с высотой Т и основанием ds.
- 11. С позиции кинетической теории газов: энтропия – мера неупорядоченности системы. Например, при отводе теплоты из системы
- 12. Термодинамическая вероятность показывает, какое число микросостояний в данной системе является наиболее вероятным. Природа стремится от менее
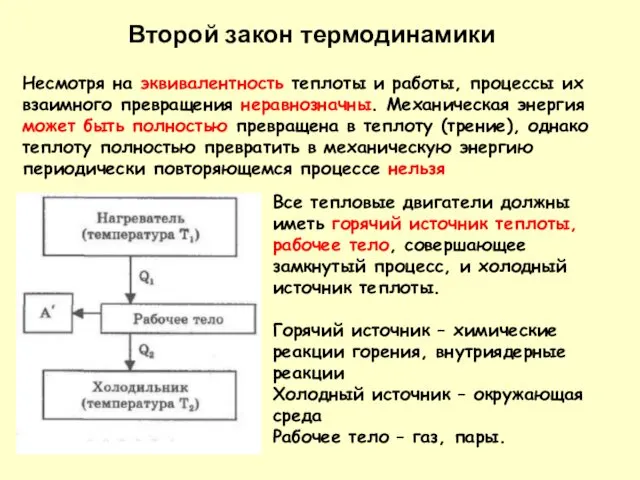
- 13. Все тепловые двигатели должны иметь горячий источник теплоты, рабочее тело, совершающее замкнутый процесс, и холодный источник
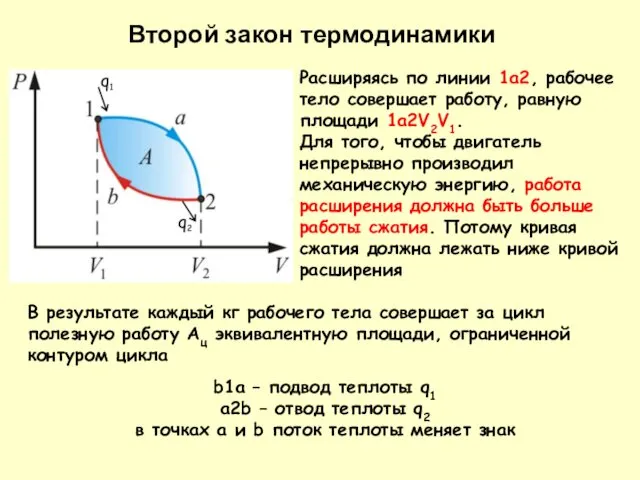
- 14. Расширяясь по линии 1а2, рабочее тело совершает работу, равную площади 1а2V2V1. Для того, чтобы двигатель непрерывно
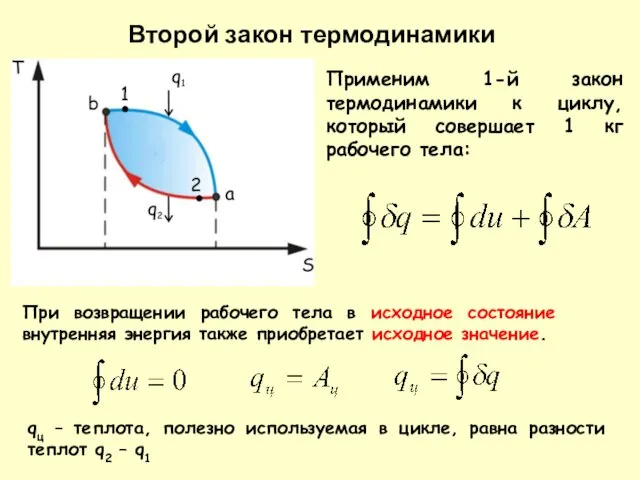
- 15. Применим 1-й закон термодинамики к циклу, который совершает 1 кг рабочего тела: При возвращении рабочего тела
- 16. Второй закон термодинамики КПД цикла: Данное соотношение является математическим выражением принципа эквивалентности тепловой и механической энергии
- 18. Скачать презентацию












 Презентация к уроку: Подвижная карта звездного неба, 9 класс
Презентация к уроку: Подвижная карта звездного неба, 9 класс Трактори та мінітрактори, які використовуються у лісовому господарстві. Лекція 1. Частина 2
Трактори та мінітрактори, які використовуються у лісовому господарстві. Лекція 1. Частина 2 Давление твердых тел, жидкостей и газов. Урок физики. 7 класс
Давление твердых тел, жидкостей и газов. Урок физики. 7 класс урок презентация по физике в 7 классе
урок презентация по физике в 7 классе Физика плазмы
Физика плазмы 7класс. Простые механизмы ( моя презентация)
7класс. Простые механизмы ( моя презентация) законы постоянного тока
законы постоянного тока Дифференциальная геометрия
Дифференциальная геометрия Испытания на сдвиг, методы определения модулей сдвига при кручении плоских образцов и пластин по периоду крутильных колебаний
Испытания на сдвиг, методы определения модулей сдвига при кручении плоских образцов и пластин по периоду крутильных колебаний Метрология, стандартизация и сертификация
Метрология, стандартизация и сертификация Равноускоренное движение. Ускорение
Равноускоренное движение. Ускорение Презентация к уроку 7 класса Агрегатные состояния вещества
Презентация к уроку 7 класса Агрегатные состояния вещества Эксперимент на уроках физики в основной школе как средство формирования УУД
Эксперимент на уроках физики в основной школе как средство формирования УУД Тесты по физике. Темы: Работа. Мощность. Энергия
Тесты по физике. Темы: Работа. Мощность. Энергия Отражение и преломление света. Закон преломления света. Полное отражение
Отражение и преломление света. Закон преломления света. Полное отражение Электрический ток в вакууме
Электрический ток в вакууме XWER381ADM0002070
XWER381ADM0002070 Своя игра по физике
Своя игра по физике Проектирование зоны ТО-1 грузовых автомобилей с выделением шиномонтажного участка, технологический процесс ремонта колес
Проектирование зоны ТО-1 грузовых автомобилей с выделением шиномонтажного участка, технологический процесс ремонта колес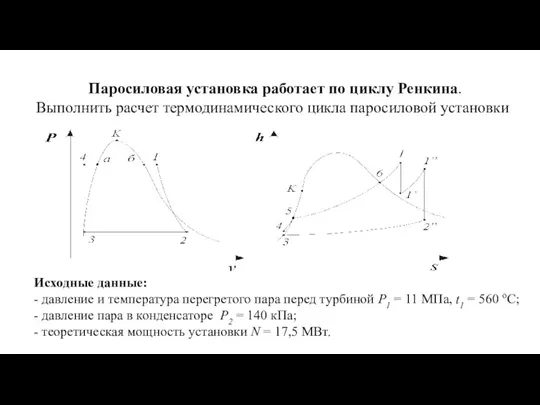 Расчет термодинамического цикла паросиловой установки
Расчет термодинамического цикла паросиловой установки Кинематика материальной точки
Кинематика материальной точки Домашняя лабораторная работа. Плотность куска мыла
Домашняя лабораторная работа. Плотность куска мыла Однородный полупроводник
Однородный полупроводник Рентгеновские аппараты. Цифровые рентгенодиагностические комплексы. (Лекция 10)
Рентгеновские аппараты. Цифровые рентгенодиагностические комплексы. (Лекция 10) Создание телефона
Создание телефона Оптические волокна
Оптические волокна Структура измерительных приборов и систем
Структура измерительных приборов и систем Оптика. Описание оптических систем. (Лекция 5)
Оптика. Описание оптических систем. (Лекция 5)