Содержание
- 2. ТМО Лекция 12 Энергосбережение и возобновляемые источники энергии Г.И.Пальчёнок Кипение и конденсация, Плавление и затвердевание (замерзание),
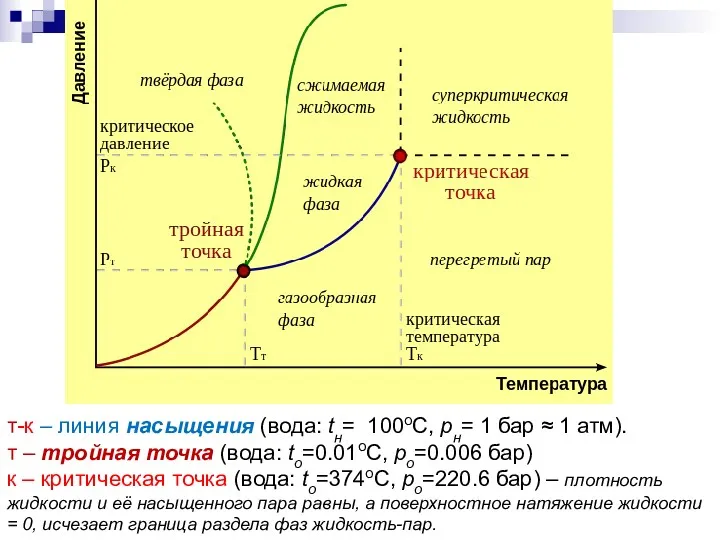
- 3. т-к – линия насыщения (вода: tн= 100oC, pн= 1 бар ≈ 1 атм). т – тройная
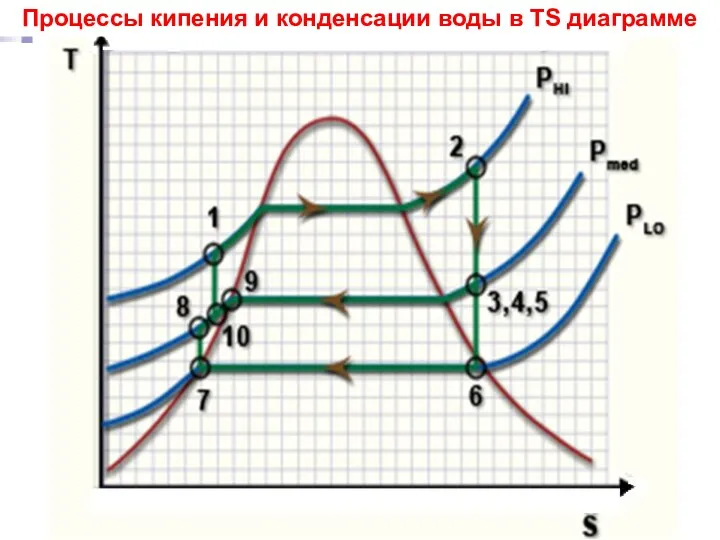
- 4. ТП Лекция 13 Процессы кипения и конденсации воды в ТS диаграмме
- 5. р,h – диаграмма хладагента R22 (Хлордифторметан, CHClF2) tкр= 96.00 °C, pкр= 49.774 бар, vкр= 0.00191 м3/кг
- 6. Тепломассообмен Лекция 13 СОСТОЯНИЕ НАСЫЩЕНИЯ Состояние равновесия жидкой и газообразной фаз (m = 2 ) одного
- 7. ТП Лекция 14 При кипении вещество переходит из жидкой фазы в газообразную при подводе к системе
- 8. Тепломассообмен Лекция 3 Кипение – процесс образования пара (в виде пузырьков или пленки) в жидкости или
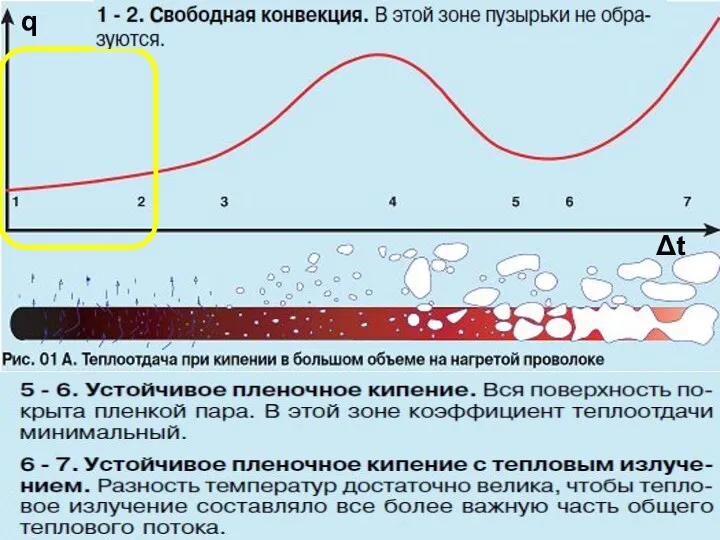
- 9. Тепломассообмен Лекция 13 Два основных режима поверхностного кипения 1. Пузырьковое кипение – на начальной стадии кипения
- 10. Δt q
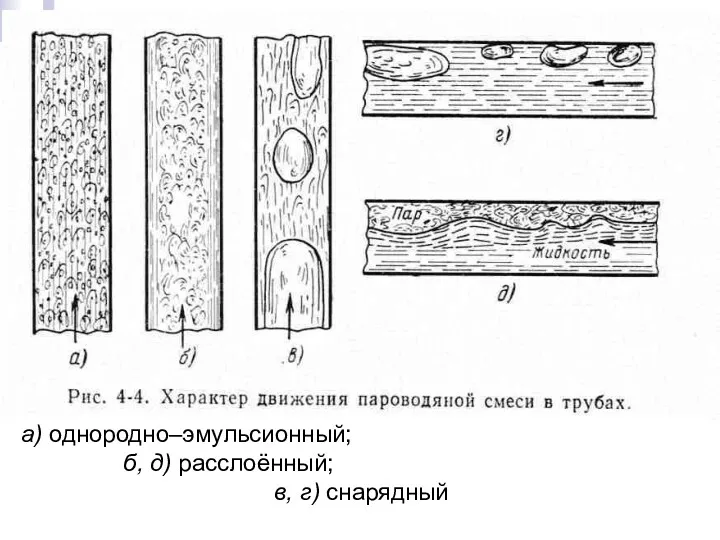
- 11. Тепломассообмен Лекция 13 а) однородно–эмульсионный; б, д) расслоённый; в, г) снарядный
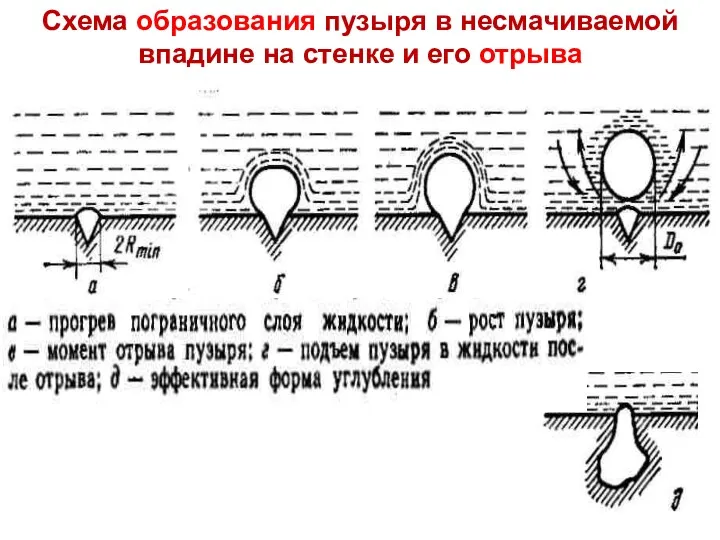
- 13. ТП Лекция 14 Схема образования пузыря в несмачиваемой впадине на стенке и его отрыва
- 14. – з-н Лапласа, σ – поверхностн. натяжение, Н/м; при меньшем Δр пузырек сконденсируется ТП Лекция 14
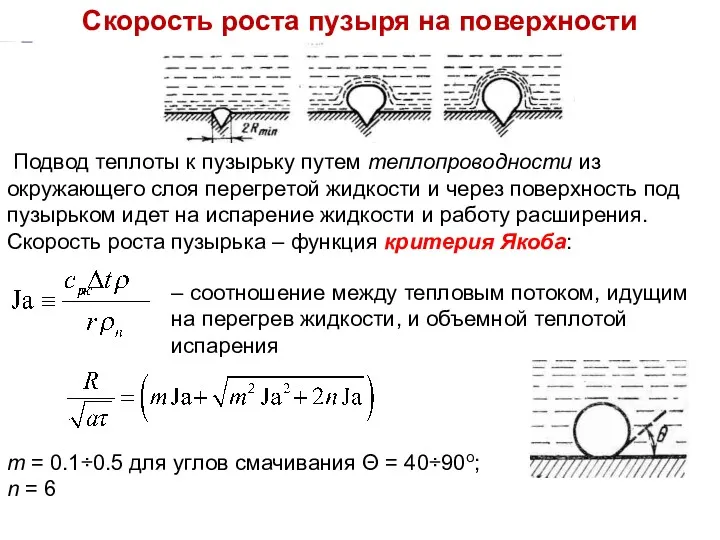
- 15. Подвод теплоты к пузырьку путем теплопроводности из окружающего слоя перегретой жидкости и через поверхность под пузырьком
- 16. ТМО Лекция 12 Диаметр и частота отрыва пузырей
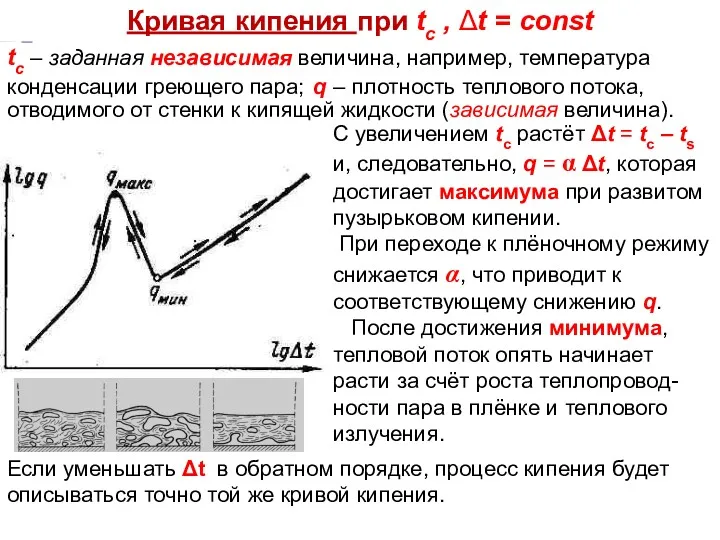
- 17. Тепломассообмен Лекция 13 Кривая кипения при tc , Δt = const С увеличением tc растёт Δt
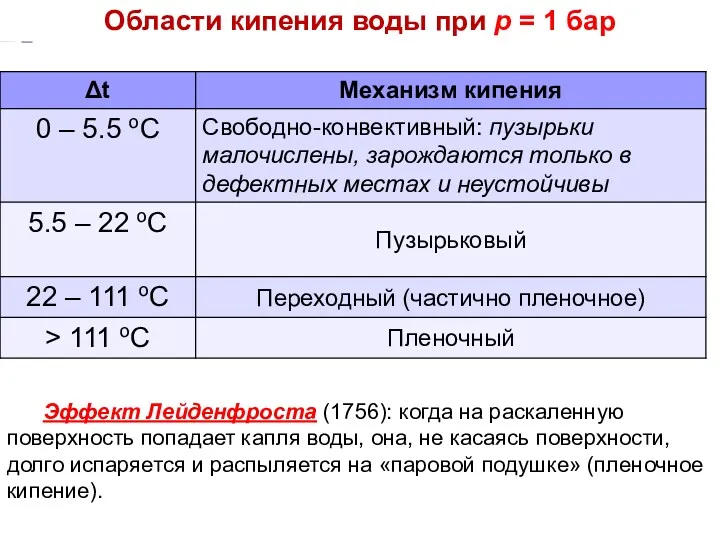
- 18. Эффект Лейденфроста (1756): когда на раскаленную поверхность попадает капля воды, она, не касаясь поверхности, долго испаряется
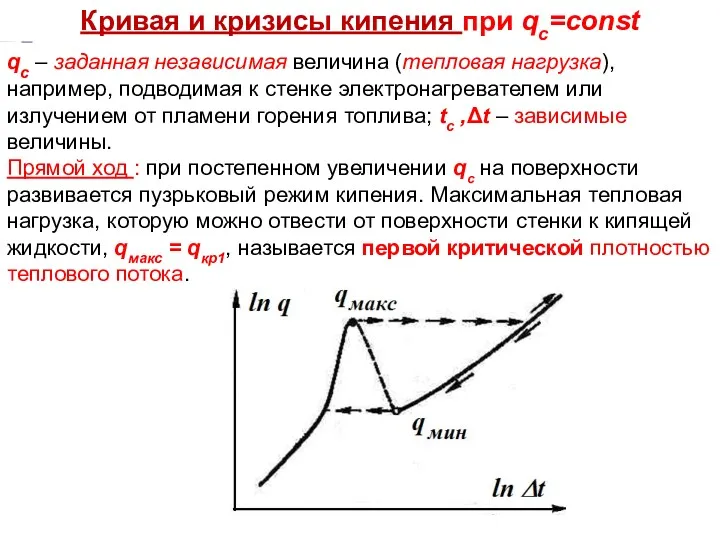
- 19. Тепломассообмен Лекция 13 Кривая и кризисы кипения при qс=const qс – заданная независимая величина (тепловая нагрузка),
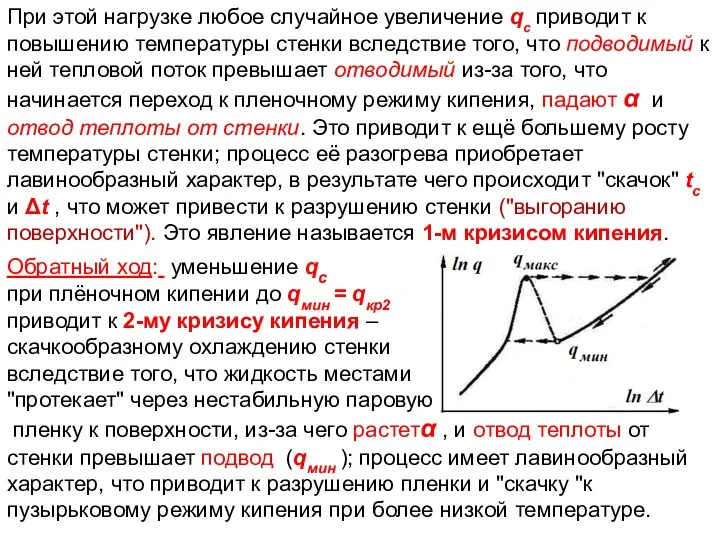
- 20. ТП Лекция 14 При этой нагрузке любое случайное увеличение qс приводит к повышению температуры стенки вследствие
- 21. ТМО Лекция 12 Энергосбережение и возобновляемые источники энергии Г.И.Пальчёнок Критическая плотность теплового потока Для воды
- 22. Тепломассообмен Лекция 13 Коэффициент теплоотдачи при пузырьковом кипении Опыт:
- 23. единицы СИ, кроме давления: [p] = бар (= 105 Па) α = 3.0 q 0.7p 0.15
- 24. Тепломассообмен Лекция 13 Сравнение коэффициентов теплоотдачи при конвекции и фазовых переходах, Вт/(м2К)
- 25. Тепломассообмен Лекция 13 Г.Н. Данилова: M – молекулярная масса; ркр [бар] и Ткр [К] – критические
- 26. Теоретические основы хладотехники. Тепломассообмен / С.Н.Богданов, Н.А. Бучко, Э.И. Гуйко и др.; Под ред. Э.И. Гуйко.
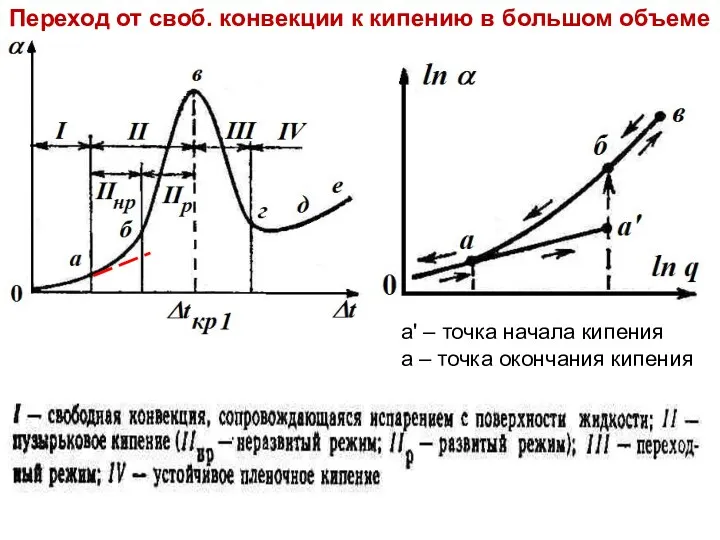
- 27. Тепломассообмен Лекция 13 а' – точка начала кипения а – точка окончания кипения Переход от своб.
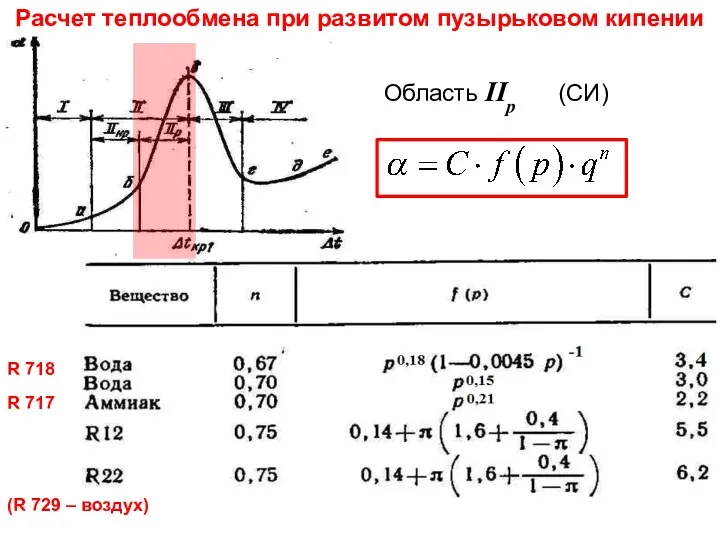
- 28. Тепломассообмен Лекция 13 Расчет теплообмена при развитом пузырьковом кипении Область IIр (СИ) R 718 R 717
- 29. Тепломассообмен Лекция 14 задана тепловая нагрузка q, Вт/м2 ls ~ (dкр ·Ja) – характ. масштаб длины
- 30. Тепломассообмен Лекция 12 Энергосбережение и возобновляемые источники энергии Г.И.Пальчёнок 2) задан температурный напор ∆t = tc
- 32. Скачать презентацию











![единицы СИ, кроме давления: [p] = бар (= 105 Па)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/21732/slide-22.jpg)





 Постоянный электрический ток
Постоянный электрический ток Отчет по учебной практике. Радарный уровнемер Saab TankRadar RTG 3920
Отчет по учебной практике. Радарный уровнемер Saab TankRadar RTG 3920 Электрические свойства кристаллов
Электрические свойства кристаллов Электризация тел при соприкосновении. Взаимодействие заряженных тел. Два рода электрических зарядов
Электризация тел при соприкосновении. Взаимодействие заряженных тел. Два рода электрических зарядов Мастер-класс : Формирование познавательных УУД на уроках физики и внеурочной деятельности Буданова Ольга Евгеньевна, учитель физики МБОУ СОШ №128.
Мастер-класс : Формирование познавательных УУД на уроках физики и внеурочной деятельности Буданова Ольга Евгеньевна, учитель физики МБОУ СОШ №128. Құрылыс материалдарының физикалық қасиеттері
Құрылыс материалдарының физикалық қасиеттері Давление. Физика, 7 класс
Давление. Физика, 7 класс Виды спектров. Спектральный анализ
Виды спектров. Спектральный анализ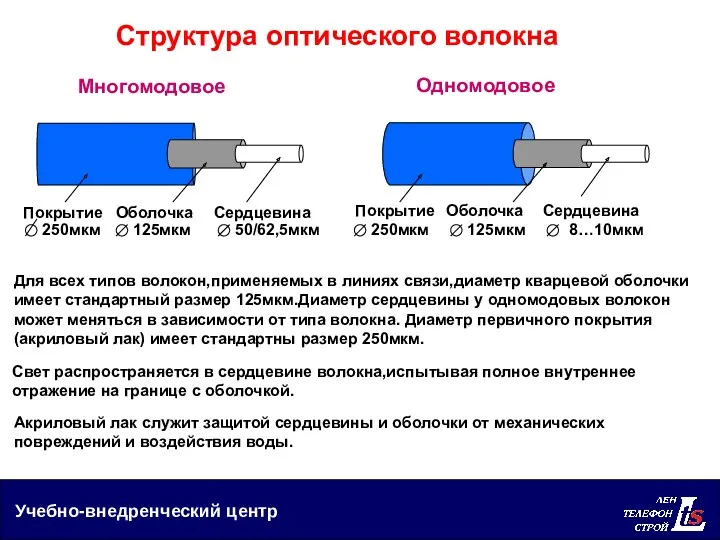 Структура оптического волокна
Структура оптического волокна Лопушнян Г.А.Теория света.
Лопушнян Г.А.Теория света.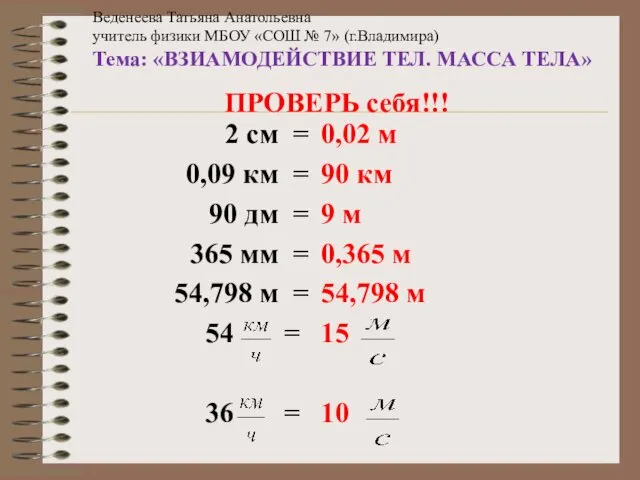 ВЗИАМОДЕЙСТВИЕ ТЕЛ. МАССА ТЕЛА
ВЗИАМОДЕЙСТВИЕ ТЕЛ. МАССА ТЕЛА ЛЕКЦИИ термех. модуль 1
ЛЕКЦИИ термех. модуль 1 Закон отражения света
Закон отражения света Тепловое излучение. Фотон. Внешний фотоэффект. Лекция № 5
Тепловое излучение. Фотон. Внешний фотоэффект. Лекция № 5 Ядерный реактор. Получение радиоактивных изотопов и их применение
Ядерный реактор. Получение радиоактивных изотопов и их применение Презентация к уроку в 9 классе на тему: Реактивное движение
Презентация к уроку в 9 классе на тему: Реактивное движение двигатель внутреннего сгорания
двигатель внутреннего сгорания Задачи на встречное движение
Задачи на встречное движение Получение материалов с заданными свойствами
Получение материалов с заданными свойствами Электроемкость. Конденсаторы
Электроемкость. Конденсаторы Колебательный контур. Электромагнитные колебания
Колебательный контур. Электромагнитные колебания Итоговая работа. Методология научного исследования. Исследование распространения звуковых волн в новых материалах
Итоговая работа. Методология научного исследования. Исследование распространения звуковых волн в новых материалах Антенны и распространение радиоволн
Антенны и распространение радиоволн Тепловые двигатели
Тепловые двигатели Электрический ток. Источники электрического тока
Электрический ток. Источники электрического тока Электрический ток в различных средах
Электрический ток в различных средах Diesel and petrol power
Diesel and petrol power Фізичні й хімічні явища у природі
Фізичні й хімічні явища у природі