Содержание
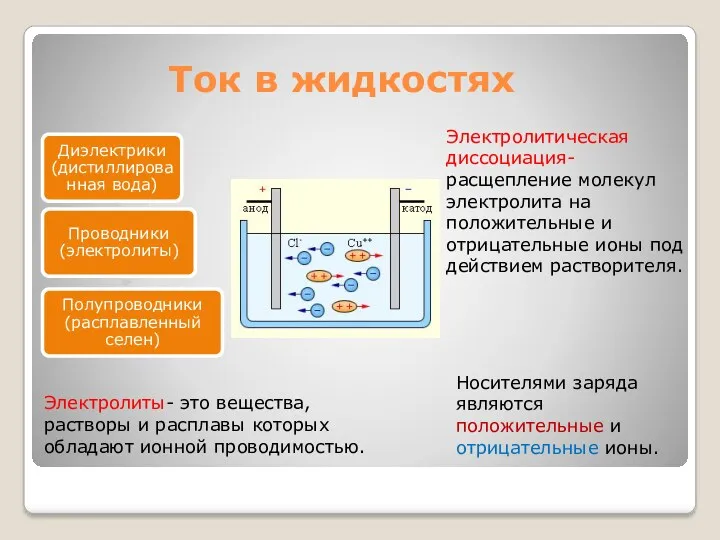
- 2. Ток в жидкостях Электролиты- это вещества, растворы и расплавы которых обладают ионной проводимостью. Носителями заряда являются
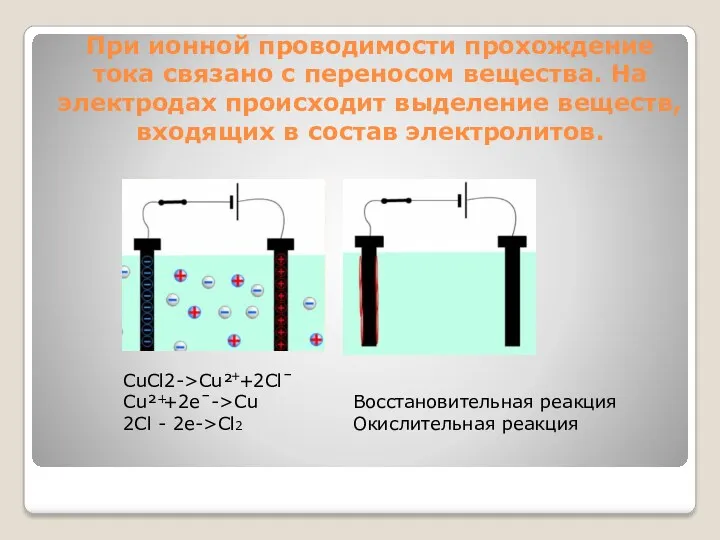
- 3. При ионной проводимости прохождение тока связано с переносом вещества. На электродах происходит выделение веществ, входящих в
- 4. Температурная зависимость сопротивления электролита объясняется в основном изменением удельного сопротивления. R=R0(1+αt) R=R0(1+αt) α‹0
- 5. Электролиз Электролиз-процесс выделения на электродах вещества, связанный с окислительно-восстановительной реакцией. От чего зависит масса вещества, выделившегося
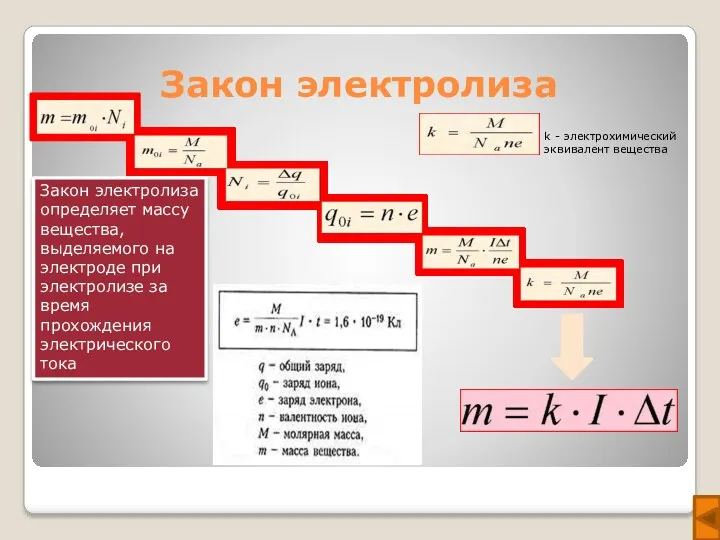
- 6. Закон электролиза Закон электролиза определяет массу вещества, выделяемого на электроде при электролизе за время прохождения электрического
- 7. Гальваностегия Гальваностегия - декоративное или антикоррозийное покрытие металлических изделий тонким слоем другого металла (никелирование, хромирование, омеднение,
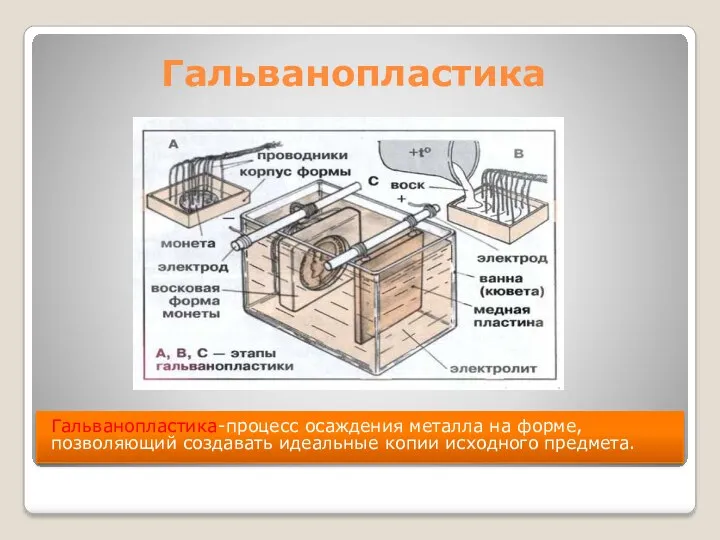
- 8. Гальванопластика Гальванопластика-процесс осаждения металла на форме, позволяющий создавать идеальные копии исходного предмета.
- 10. Скачать презентацию



 Плавання тіл. Закон Архімеда
Плавання тіл. Закон Архімеда Методы анализа переходных процессов в линейных цепях со сосредоточенными параметрами
Методы анализа переходных процессов в линейных цепях со сосредоточенными параметрами Масс-спектрометрия с индуктивно связанной плазмой (ИСП-МС)
Масс-спектрометрия с индуктивно связанной плазмой (ИСП-МС) Презентация к уроку Изменение агрегатных состояний вещества
Презентация к уроку Изменение агрегатных состояний вещества Лазеры и их применение
Лазеры и их применение Допоміжне устаткування холодильних машин
Допоміжне устаткування холодильних машин Тепловизоры. История создания тепловизора
Тепловизоры. История создания тепловизора Нарезание резьбы на металлических деталях
Нарезание резьбы на металлических деталях Магнитное поле тока
Магнитное поле тока Автосцепка. Назначение автосцепных устройств
Автосцепка. Назначение автосцепных устройств Предмет физика. Измерение физических величин. Погрешности
Предмет физика. Измерение физических величин. Погрешности Никола Тесла
Никола Тесла Методы электрофизической и электрохимической обработки поверхностей заготовок
Методы электрофизической и электрохимической обработки поверхностей заготовок Экспериментальные факты, лежащие в основе теории магнетизма
Экспериментальные факты, лежащие в основе теории магнетизма Законы постоянного тока. Законы Кирхгофа
Законы постоянного тока. Законы Кирхгофа Транспортирующие машины. (Лекция № 5)
Транспортирующие машины. (Лекция № 5) История создания швейной машинки
История создания швейной машинки Энергия. Работа. Мощность
Энергия. Работа. Мощность Правила по уходу за велосипедом
Правила по уходу за велосипедом Презентация по физике Реактивное движение. 9 класс
Презентация по физике Реактивное движение. 9 класс Методы наблюдения и регистрации элементарных частиц
Методы наблюдения и регистрации элементарных частиц Презентация Параллельное соединение проводников
Презентация Параллельное соединение проводников Урок - исследование. Воздух и его свойства. Воздушная оболочка Земли
Урок - исследование. Воздух и его свойства. Воздушная оболочка Земли Як був винайденний блискавковідвід
Як був винайденний блискавковідвід Теорема о кинетической энергии
Теорема о кинетической энергии Презентация к уроку Электрический ток
Презентация к уроку Электрический ток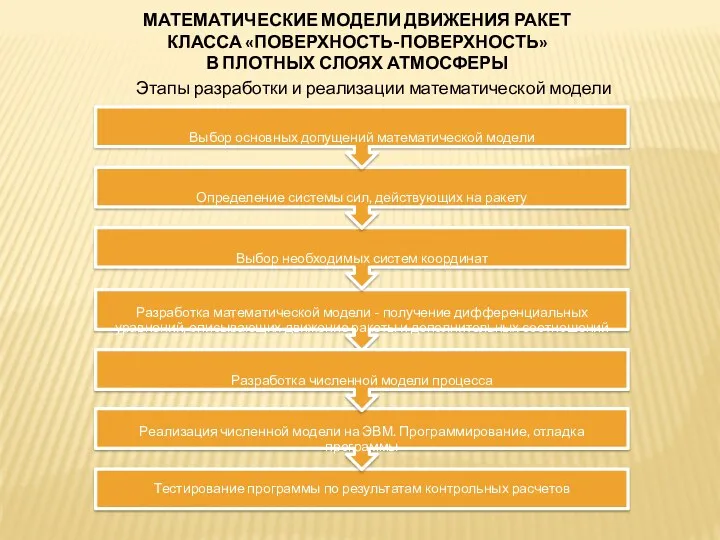 Математические модели движения ракет класса поверхность-поверхность в плотных слоях атмосферы
Математические модели движения ракет класса поверхность-поверхность в плотных слоях атмосферы Сопротивление в цепи переменного тока
Сопротивление в цепи переменного тока