Содержание
- 2. 1.Назови макроскопические параметры: Масса, давление, объем, температура давление, объем, температура
- 3. К макроскопическим параметрам идеального газа относятся: давление, объем и температура! P, V, T
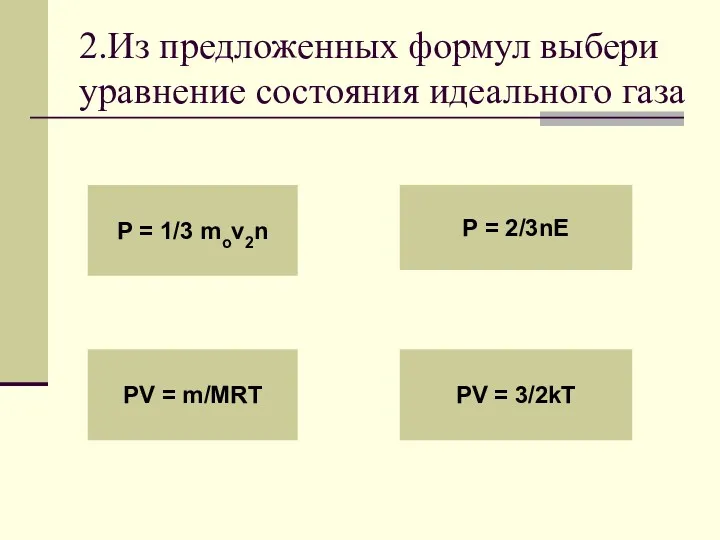
- 4. 2.Из предложенных формул выбери уравнение состояния идеального газа P = 1/3 mov2n PV = m/MRT P
- 5. Неправильно! Повтори теорию!
- 6. Молодец! Переходи к следующему вопросу
- 7. Неправильно! Повтори теорию!
- 8. Уравнением состояния идеального газа называется зависимость между макроскопическими параметрами: давлением, объемом и температурой! pv = m/MRT
- 9. Молодец! Переходи к следующему вопросу
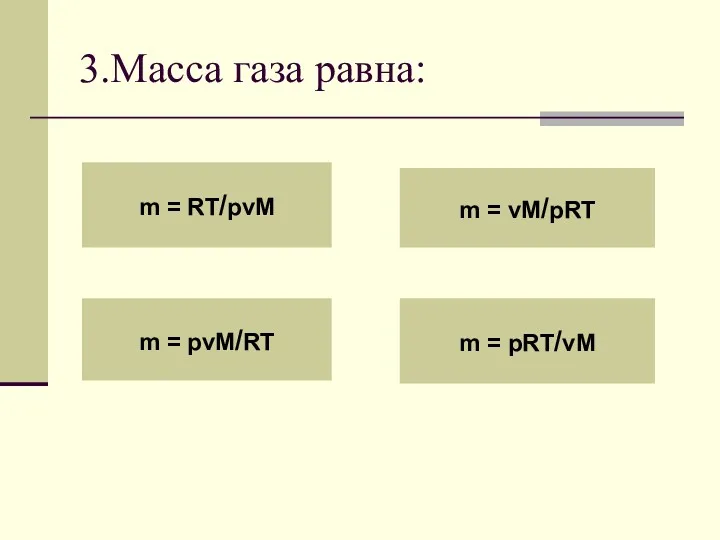
- 10. 3.Масса газа равна: m = RT/pvM m = pvM/RT m = vM/pRT m = pRT/vM
- 11. Молодец! Переходи к следующему вопросу
- 12. Неправильно! Повтори теорию!
- 13. Чтобы выразить неизвестную величину из уравнения Менделеева – Клапейрона, умножь левую и правую часть уравнения на
- 14. 4.Универсальная газовая постоянная равна: 6,022 *10 23 моль-1 1,38 * 10 – 23Дж/К 8,31 Дж/ (моль*К)
- 15. Неправильно! Повтори теорию!
- 16. Молодец! Переходи к следующему вопросу
- 17. Универсальной газовой постоянной называется произведение числа Авогадро и постоянной Больцмана: 6,02 * 1023 * 1,38 *
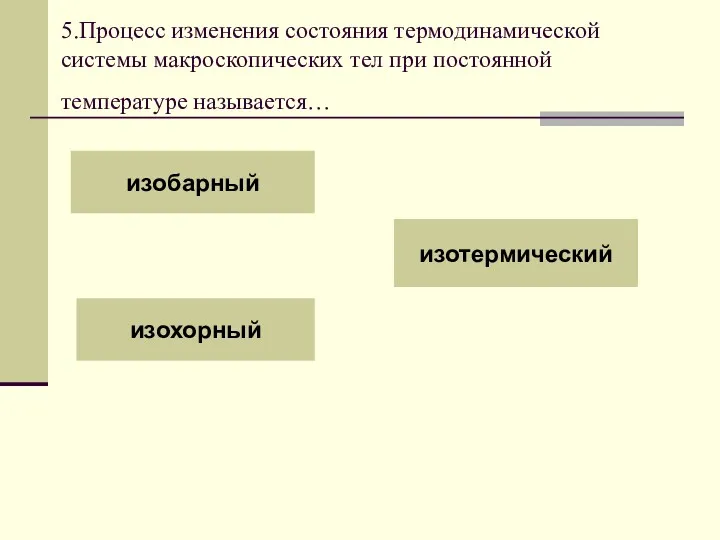
- 18. 5.Процесс изменения состояния термодинамической системы макроскопических тел при постоянной температуре называется… изобарный изохорный изотермический
- 19. Согласно уравнению состояния газа в любом состоянии с неизменной температурой произведение давления газа на его объем
- 20. Молодец! Переходи к следующему вопросу
- 21. Неправильно! Повтори теорию!
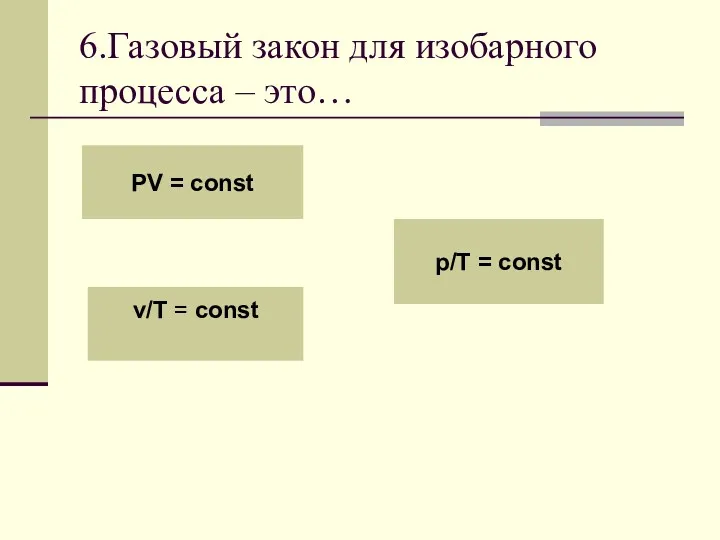
- 22. 6.Газовый закон для изобарного процесса – это… PV = const v/T = const p/T = const
- 23. Неправильно! Повтори теорию!
- 24. Молодец! Переходи к следующему вопросу
- 25. Для данной массы газа отношение объема к температуре постоянно, если давление газа не меняется. v/T =
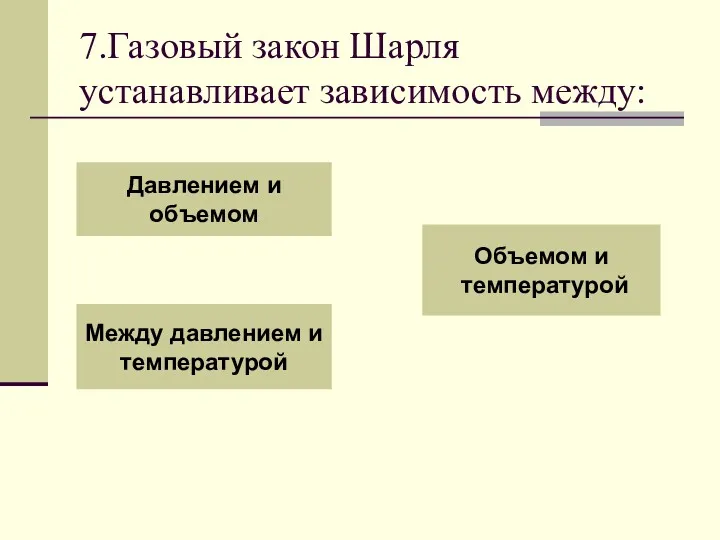
- 26. 7.Газовый закон Шарля устанавливает зависимость между: Давлением и объемом Между давлением и температурой Объемом и температурой
- 27. Повтори теорию! Неправильно!
- 28. Поздравляю! Переходи к следующему вопросу
- 29. Процесс изменения состояния термодинамической системы при постоянном объеме называют изохорным. Газовый закон Шарля. V = const.
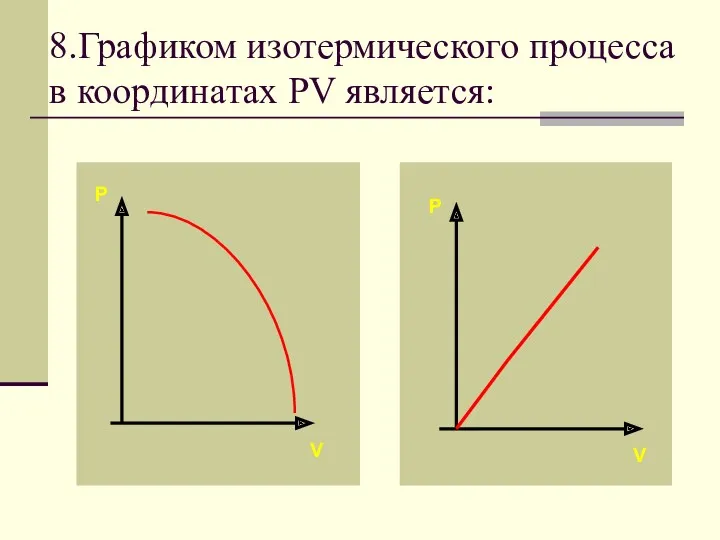
- 30. 8.Графиком изотермического процесса в координатах PV является: P P V V
- 31. Поздравляю! Переходи к следующему вопросу
- 32. Неправильно! Повтори теорию!
- 33. Зависимость между давлением и объемом в изотермическом процессе обратно пропорциональная. Графиком в координатах PV является изотерма
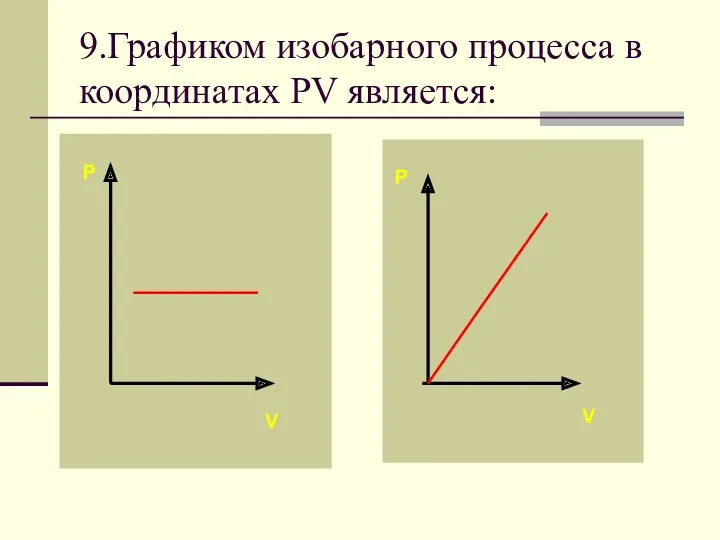
- 34. 9.Графиком изобарного процесса в координатах PV является: P V P V
- 35. Поздравляю! Переходи к следующему вопросу
- 36. Неправильно! Повтори теорию!
- 37. Если процесс изобарный давление постоянно, в координатах PV график прямая линия параллельная оси объема.
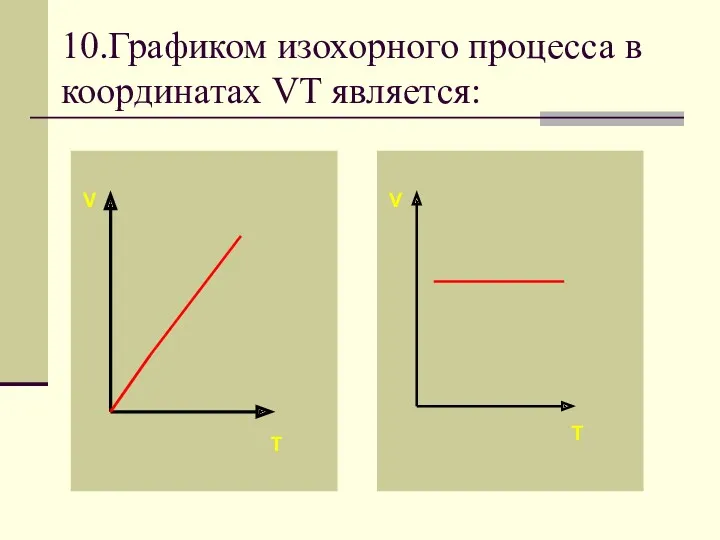
- 38. 10.Графиком изохорного процесса в координатах VT является: V V T T
- 39. Поздравляю! Переходи к следующему вопросу
- 40. Неправильно! Повтори теорию!
- 41. Если процесс изохорный объем постоянный, в координатах VT график - прямая линия параллельная оси температуры.
- 42. Реши задачу: Найди давление газа бутана (С4Н8) в баллоне для портативных газовых плит объемом 0,5 л
- 43. Поздравляю! Переходи к следующей задаче
- 44. Неправильно! Посмотри решение
- 45. Решение: Переведи единицы измерения объема, массы, температуры в СИ. Найди молярную массу бутана: M=(4*12 + 1*8)
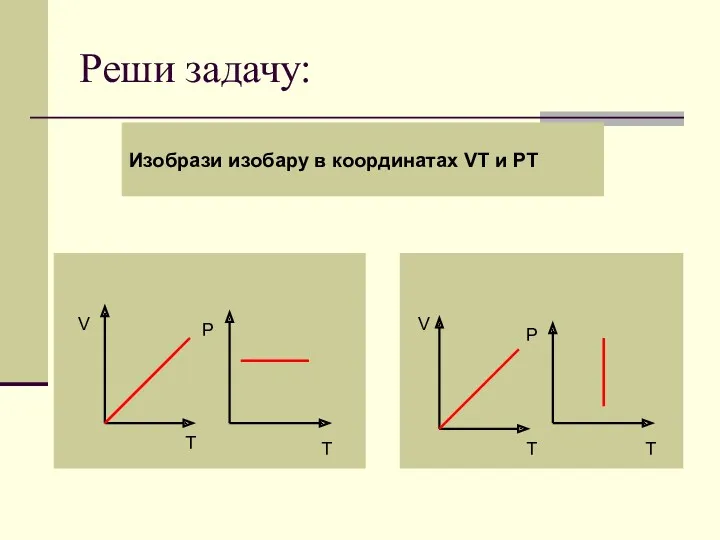
- 46. Реши задачу: Изобрази изобару в координатах VT и PT V T P T V T P
- 47. Поздравляю! Переходи к контрольному тесту
- 49. Скачать презентацию





































 Урок решения задач по теме: Механические колебания
Урок решения задач по теме: Механические колебания Көкөністерді жуу машиналары
Көкөністерді жуу машиналары Понятие и принципы построения математической модели физических систем
Понятие и принципы построения математической модели физических систем Облаштування бульдозерів і визначення їх продуктивності
Облаштування бульдозерів і визначення їх продуктивності Жалоба клиента
Жалоба клиента Подготовка к контрольной работе по теме Изменение агрегатных состояний вещества
Подготовка к контрольной работе по теме Изменение агрегатных состояний вещества Электрические провода
Электрические провода МЕТОДИКА ИЗУЧЕНИЯ СВОЙСТВ ВЕЩЕСТВА В КУРСЕ ФИЗИКИ В СИСТЕМЕ СРЕДНЕГО ОБРАЗОВАНИЯ ПРИ РЕАЛИЗАЦИИ ФГОС
МЕТОДИКА ИЗУЧЕНИЯ СВОЙСТВ ВЕЩЕСТВА В КУРСЕ ФИЗИКИ В СИСТЕМЕ СРЕДНЕГО ОБРАЗОВАНИЯ ПРИ РЕАЛИЗАЦИИ ФГОС Электромагниттік толқындар
Электромагниттік толқындар презентация Физические явления
презентация Физические явления Двигатель внутреннего сгорания
Двигатель внутреннего сгорания Инструментальные методы качественного анализа органических веществ
Инструментальные методы качественного анализа органических веществ Водомер Вентури
Водомер Вентури Комплексные частотные характеристики линейных электрических цепей
Комплексные частотные характеристики линейных электрических цепей Урок - исследование Тепловое действие тока
Урок - исследование Тепловое действие тока Давление. Открытый урок по физике в 7 классе
Давление. Открытый урок по физике в 7 классе Урок колебательный контур 11 класс.
Урок колебательный контур 11 класс. Сила давления жидкости на плоские и криволинейные стенки
Сила давления жидкости на плоские и криволинейные стенки Класифікація лісогосподарських машин. Лекція №2
Класифікація лісогосподарських машин. Лекція №2 Объемные ионизационные эффекты в ПП и ИС (ИЭТ) при воздействии импульсного ИИ
Объемные ионизационные эффекты в ПП и ИС (ИЭТ) при воздействии импульсного ИИ Химическая термодинамика и кинетика
Химическая термодинамика и кинетика Расчет температуры вспышки. Классификация горючести жидкости
Расчет температуры вспышки. Классификация горючести жидкости Наука в творчестве А.С.Пушкина
Наука в творчестве А.С.Пушкина Методы измерения по фазе
Методы измерения по фазе Презентация по физике для 9 класса на тему Реактивное движение. Ракеты.
Презентация по физике для 9 класса на тему Реактивное движение. Ракеты. Топ-5 перспективных разработок атомной энергетики
Топ-5 перспективных разработок атомной энергетики Резание тонколистового металла и проволоки. 5 класс
Резание тонколистового металла и проволоки. 5 класс Отношение сигнал-шум на выходе приёмника ЧМ сигнала
Отношение сигнал-шум на выходе приёмника ЧМ сигнала