Содержание
- 2. Уравнение состояния идеального газа
- 3. Цели урока: познакомиться с уравнением состояния идеального газа; записать это уравнение в классическом виде; рассмотреть следствия,
- 4. Величайшим достижением человеческого гения является то, что человек может понять вещи, которые он уже не в
- 5. Восстанови Формулу и запиши ее в тетрадь с названием и обозначениями букв.
- 6. Проверьте свои записи: 1.Зависимость внутренней энергии идеального газа от температуры. k=1,38-23 Дж/К – постоянная Больцмана. Т-темпертура,
- 7. Уравнение состояния вещества Уравнение, выражающее связь между макроскопическими параметрами состояния вещества (p,V и Т), называется уравнением
- 8. Уравнение состояния идеального газа
- 9. R=8,31 Дж / (моль·К) NA k = R Универсальная газовая постоянная - R
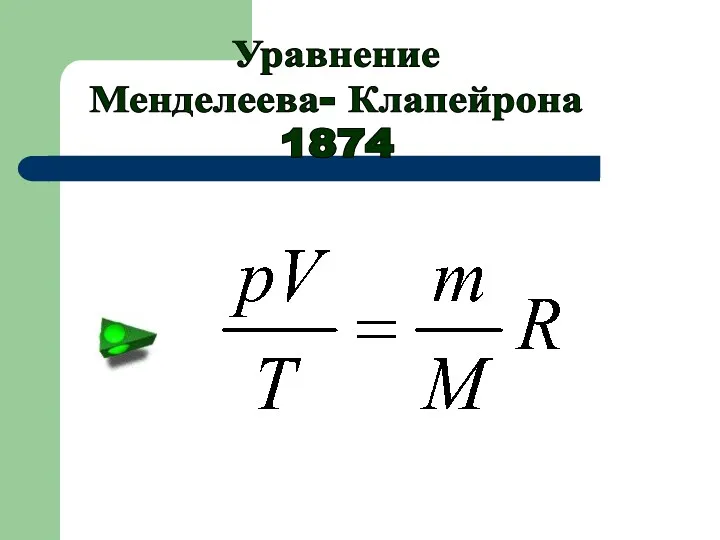
- 10. Уравнение Менделеева- Клапейрона 1874
- 11. Дмитрий Иванович Менделеев (1834 – 1907) Крупнейший химик мира, физик, педагог
- 12. Закон Авогадро 1811 При одинаковых температурах и давлениях в равных объемах любых идеальных газов содержится одинаковое
- 13. Закон Дальтона 1801 Давление смеси химически не взаимодействующих идеальных газов равно сумме парциальных давлений этих газов.
- 14. Отношение произведения давления и объема идеального газа к его абсолютной температуре есть величина постоянная для данной
- 15. p0, V0, T0 – параметры начального состояния газа, p, V, T - параметры конечного состояния газа
- 16. Во всем мне хочется дойти до самой сути…
- 17. Обратите внимание: Уравнение Менделеева - Клапейрона связывает между собой 5 физических величин, характеризующих состояние газа, -
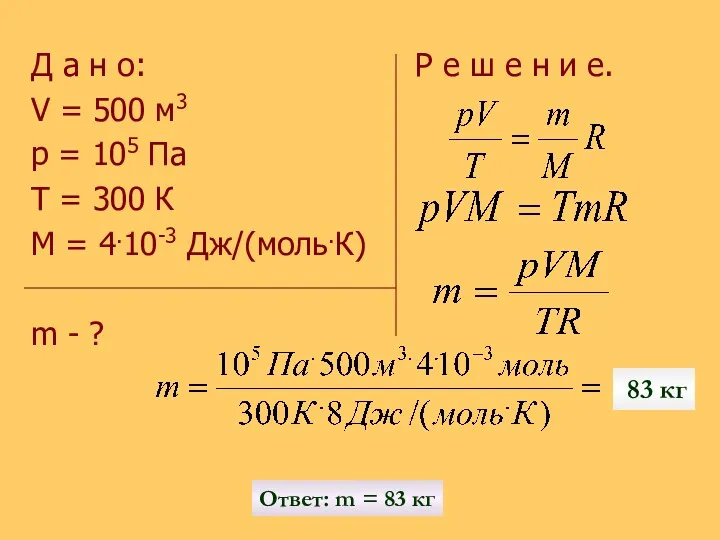
- 18. Р е ш и т ь з а д а ч у: Сколько гелия потребуется для
- 19. Д а н о: Р е ш е н и е. V = 500 м3 p
- 20. Какова плотность сжатого воздуха при 0 0С в камере шины автомобиля «Волга»? Давление 0,17 МПа. Р
- 21. Р е ш е н и е , где 2,17 кг/м3 Р е ш е н
- 23. Скачать презентацию


















 Импульс. Закон сохранения импульса.
Импульс. Закон сохранения импульса. Гидростатика. Давление в жидкости
Гидростатика. Давление в жидкости Архимедова сила
Архимедова сила Электрическое поле. (лекция 1а)
Электрическое поле. (лекция 1а) Механические передачи. Ременные передачи
Механические передачи. Ременные передачи Количество теплоты. Количество теплоты при нагревании и охлаждении
Количество теплоты. Количество теплоты при нагревании и охлаждении Электрический ток в полупроводниках
Электрический ток в полупроводниках Механика. Механическое движение
Механика. Механическое движение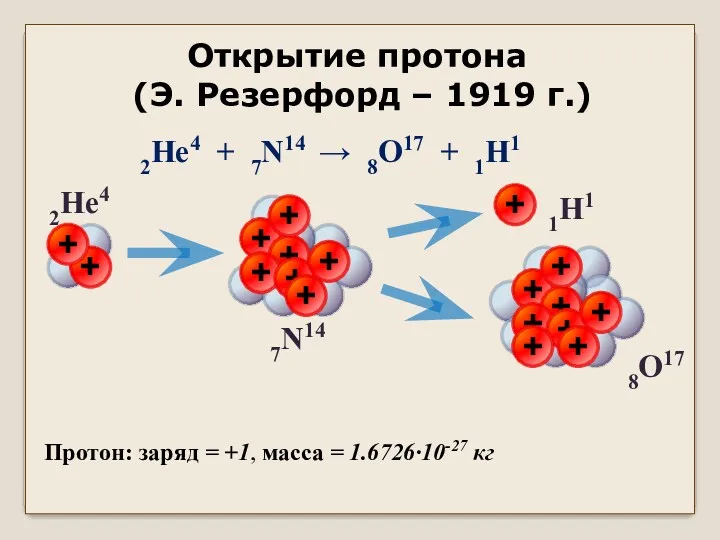 Открытие протона (Э. Резерфорд – 1919 г.)
Открытие протона (Э. Резерфорд – 1919 г.) Основной закон электростатики - закон Кулона
Основной закон электростатики - закон Кулона Резьбы. Резьбовые соединения
Резьбы. Резьбовые соединения Статистические и термодинамические свойства макросистем
Статистические и термодинамические свойства макросистем Типы двигателей
Типы двигателей Дополнительный материал по физике для 8 класса.
Дополнительный материал по физике для 8 класса. Волновая оптика
Волновая оптика Сопротивление материалов (часть I)
Сопротивление материалов (часть I) Постоянный электрический ток. (Лекция 6)
Постоянный электрический ток. (Лекция 6) Истечение жидкости через отверстия и насадки
Истечение жидкости через отверстия и насадки Заболевания молочных желёз. Взгляд гинеколога
Заболевания молочных желёз. Взгляд гинеколога Математические модели установившегося режима и методы решения. Общие сведения о схемах замещения
Математические модели установившегося режима и методы решения. Общие сведения о схемах замещения Дослідження стійкості руху автопоїзда
Дослідження стійкості руху автопоїзда Ремонт автомобилей. Технология восстановления деталей, узлов и приборов. (Тема 4.1)
Ремонт автомобилей. Технология восстановления деталей, узлов и приборов. (Тема 4.1) Электроматериаловедение. Назначение и классификация электротехнических материалов
Электроматериаловедение. Назначение и классификация электротехнических материалов Испарение и конденсация. Насыщенные и ненасыщенные пары. Влажность воздуха
Испарение и конденсация. Насыщенные и ненасыщенные пары. Влажность воздуха Бүгінгі таңдағы физикалық жетістіктер. Өзінің қолтаңбасын қалдырған ғалым
Бүгінгі таңдағы физикалық жетістіктер. Өзінің қолтаңбасын қалдырған ғалым Лекция № 1. Механические характеристики асинхронных электродвигателей
Лекция № 1. Механические характеристики асинхронных электродвигателей Методическая разработка по теме:Экологическое образование в процессе обучения физике
Методическая разработка по теме:Экологическое образование в процессе обучения физике Основные понятия и механизмы плазменного травления
Основные понятия и механизмы плазменного травления