Содержание
- 8. Уравнение состояния идеального газа
- 9. Цели урока: познакомиться с уравнением состояния идеального газа; записать это уравнение в классическом виде; рассмотреть следствия,
- 10. Модель «Идеальный газ» 9. Частицы колеблются около положений равновесия, взаимодействуя с ближайшими соседями. 1. В любом
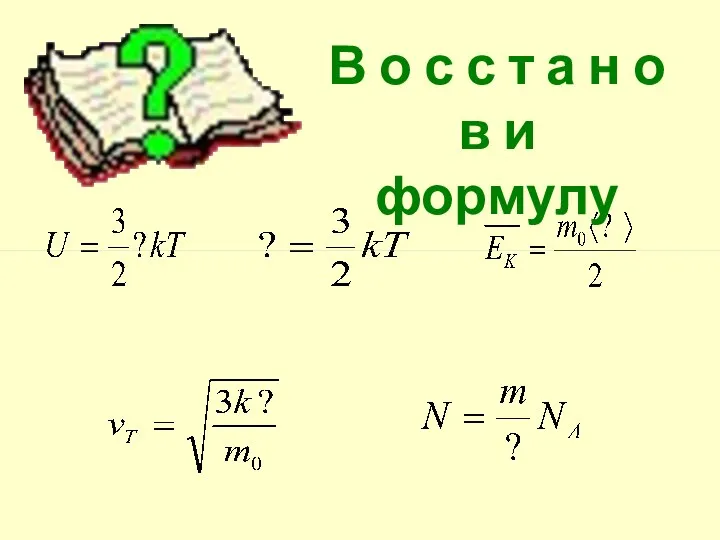
- 11. В о с с т а н о в и формулу
- 12. Проверьте знание формул! 2. Зависимость внутренней энергии идеального газа от температуры 3. Средняя кинетическая энергия поступательного
- 13. Уравнение состояния вещества Уравнение, выражающее связь между макроскопическими параметрами состояния вещества (p,V и Т), называется уравнением
- 14. Уравнение состояния идеального газа
- 15. R=8,31 Дж / (моль·К) NA k = R Универсальная газовая постоянная - R
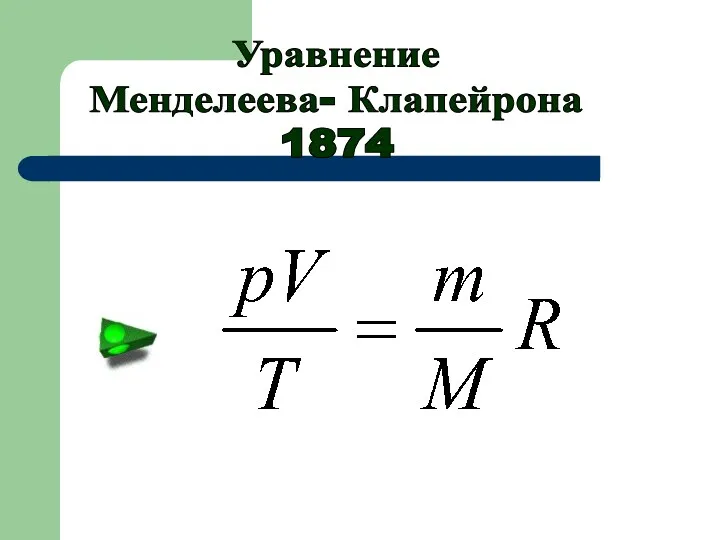
- 16. Уравнение Менделеева- Клапейрона 1874
- 17. Дмитрий Иванович Менделеев (1834 – 1907) Крупнейший химик мира, физик, педагог
- 18. Закон Авогадро 1811 При одинаковых температурах и давлениях в равных объемах любых идеальных газов содержится одинаковое
- 19. Закон Дальтона 1801 Давление смеси химически не взаимодействующих идеальных газов равно сумме парциальных давлений этих газов.
- 20. Отношение произведения давления и объема идеального газа к его абсолютной температуре есть величина постоянная для данной
- 21. p0, V0, T0 – параметры начального состояния газа, p, V, T - параметры конечного состояния газа
- 22. Во всем мне хочется дойти до самой сути…
- 23. Обратите внимание: Уравнение Менделеева - Клапейрона связывает между собой 5 физических величин, характеризующих состояние газа, -
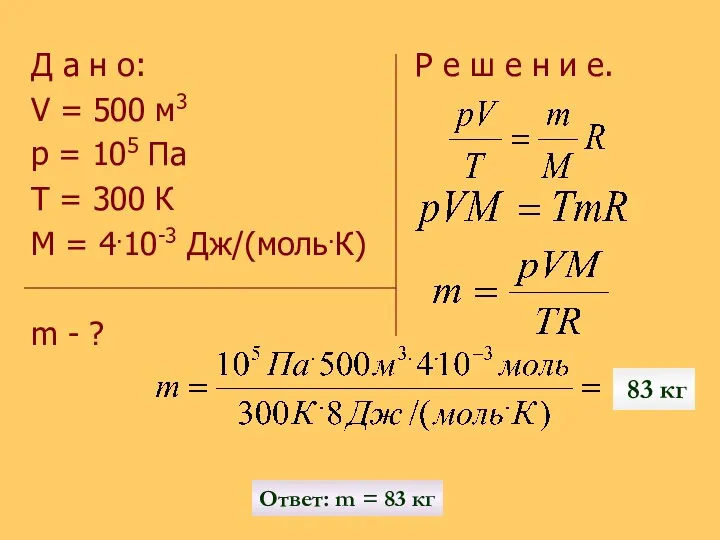
- 24. Р е ш и т ь з а д а ч у: Сколько гелия потребуется для
- 25. Д а н о: Р е ш е н и е. V = 500 м3 p
- 26. Какова плотность сжатого воздуха при 0 0С в камере шины автомобиля «Волга»? Давление 0,17 МПа. Р
- 27. Р е ш е н и е , где 2,17 кг/м3 Р е ш е н
- 28. Домашнее задание: § 68 Ответить на вопросы § 68 (на вопрос 2 – письменно) Упр. 13
- 30. Скачать презентацию
























 Закон сохранения и превращения механической энергии
Закон сохранения и превращения механической энергии Тектоника плит
Тектоника плит Электрический ток. Действия электрического тока
Электрический ток. Действия электрического тока Инфракрасная Фурье - спектроскопия
Инфракрасная Фурье - спектроскопия Рулевое управление. Назначение и основные части рулевого управления
Рулевое управление. Назначение и основные части рулевого управления Методическая разработка урока Диффузия 7 класс, презентация
Методическая разработка урока Диффузия 7 класс, презентация Радіоактивні перетворення
Радіоактивні перетворення Электролиз
Электролиз Основные понятия сопромата. Лекция 1
Основные понятия сопромата. Лекция 1 Средства механизации строительства
Средства механизации строительства Тепловое излучение. Фотон. Внешний фотоэффект. Лекция № 5
Тепловое излучение. Фотон. Внешний фотоэффект. Лекция № 5 Поршневые кольца
Поршневые кольца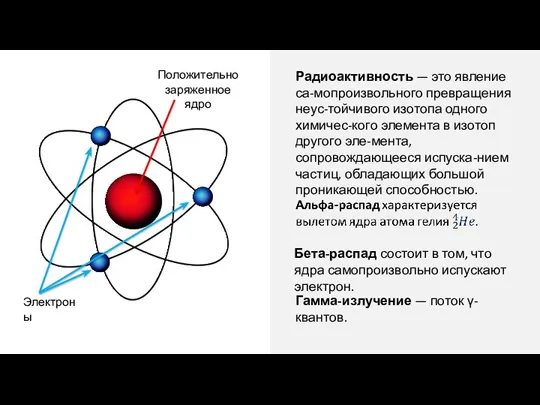 Экспериментальные методы исследования частиц
Экспериментальные методы исследования частиц Спектр атома водорода. (Лекция 7а)
Спектр атома водорода. (Лекция 7а) Презентация к уроку Количество теплоты, удельная теплоёмкость
Презентация к уроку Количество теплоты, удельная теплоёмкость 175678a84a142c1939e5ca3e409e1bc1
175678a84a142c1939e5ca3e409e1bc1 ТО и ремонт системы питания двигателя автомобиля УРАЛ-NEXT
ТО и ремонт системы питания двигателя автомобиля УРАЛ-NEXT Математическое моделирование и численное исследование актуальных проблем физики плазмы
Математическое моделирование и численное исследование актуальных проблем физики плазмы Ремонт и хранение бронетанкового вооружения и техники. Возможные неисправности трансмиссии. (Занятие 6)
Ремонт и хранение бронетанкового вооружения и техники. Возможные неисправности трансмиссии. (Занятие 6) Основные понятия об усталости металлов. Предел выносливости
Основные понятия об усталости металлов. Предел выносливости Радиоактивность. Урок физики 11 класс
Радиоактивность. Урок физики 11 класс Физический вечер 8кл
Физический вечер 8кл Перемещения при изгибе
Перемещения при изгибе Сила трения
Сила трения Формирование ключевых компетенций при решении творческих задач на уроках физики
Формирование ключевых компетенций при решении творческих задач на уроках физики Расчёт статически неопределимой рамы методом перемещений
Расчёт статически неопределимой рамы методом перемещений Элементы квантовой механики и физики атомов, молекул, твердых тел. Лекция № 3
Элементы квантовой механики и физики атомов, молекул, твердых тел. Лекция № 3 Оптические волокна
Оптические волокна