Содержание
- 2. Вопрос 1. Волновые свойства частиц вещества В 1923 г. французский физик Луи де Бройль выдвинул гипотезу
- 3. Согласно гипотезе де Бройля , корпускулярные и волновые характеристики микрообъектов связаны такими же соотношениями, как и
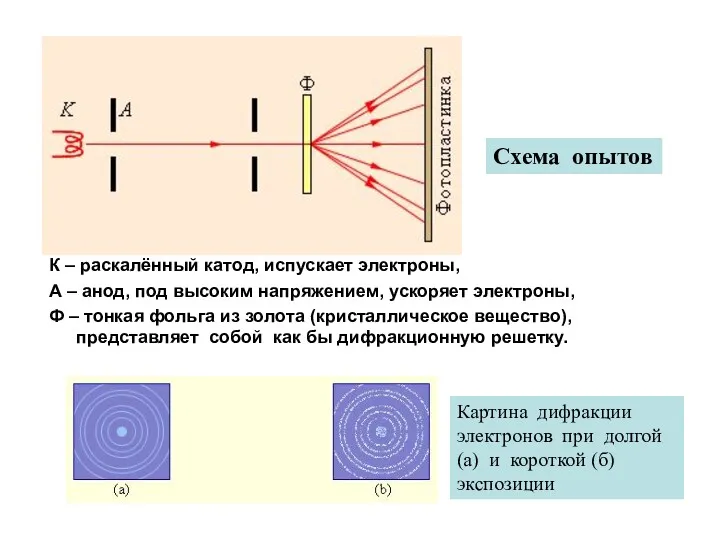
- 4. В 1927 г. Дэвиссон и Джермер обнаружили дифракцию электронов при рассеянии (отражении) электронных пучков от кристалла
- 5. К – раскалённый катод, испускает электроны, А – анод, под высоким напряжением, ускоряет электроны, Ф –
- 6. Что означают дифракционные максимумы и минимумы , возникшие на фотопластинке для электронов, проходящих сквозь тонкую фольгу
- 7. « Квадрат амплитуды волны де Бройля в данной точке пространства пропорционален вероятности обнаружения частицы в этой
- 8. Некоторые положения квантовой механики В квантовой механике все частицы являются носителями одновременно и корпускулярных, и волновых
- 9. Вопрос 2. Соотношение неопределённостей. В. Гейзенберг, 1927 г. Микрочастицы из-за наличия волновых свойств существенно отличаются от
- 10. «Микрочастица не может иметь одновременно и определённую координату ( x, y, z ) и определённую соответствующую
- 11. Вопрос 3. Волновая функция. Уравнение Шрёдингера В 1926 г. Макс Борн предположил, что по волновому закону
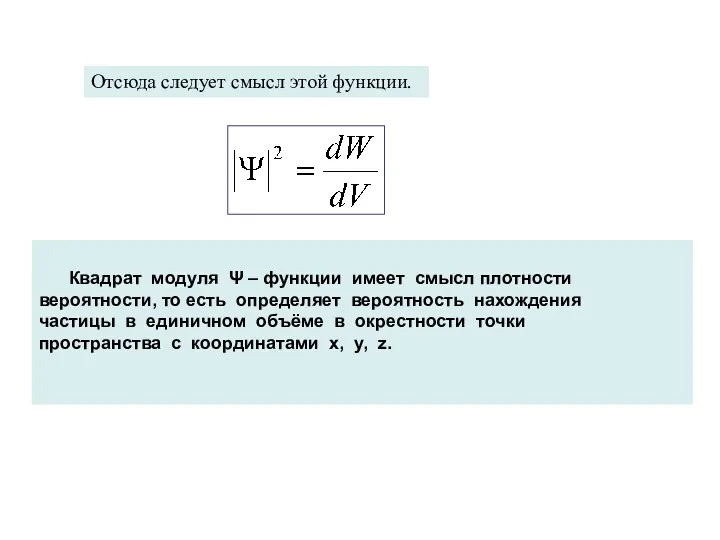
- 12. Квадрат модуля Ψ – функции имеет смысл плотности вероятности, то есть определяет вероятность нахождения частицы в
- 13. Свойства волновой функции Волновая функция ψ, характеризующая вероятность обнаружения действия микрочастицы в элементе объёма, должна быть
- 14. Уравнение Шрёдингера - основное уравнение в квантовой механике, описывающее движение микрочастиц в различных силовых полях. m
- 15. Для многих физических явлений, происходящих в микромире это уравнение можно упростить, исключив зависимость волновой функции ψ
- 16. Вопрос 4. Применение уравнения Шрёдингера 1. Движение свободной частицы. Свободная частица – частица, движущаяся в отсутствие
- 17. Отсюда следует , что: - Свободная квантовая частица описывается плоской монохроматической волной де Бройля Плотность вероятности
- 18. 2. Частица в одномерной прямоугольной «потенциальной яме» с бесконечно высокими стенками Частица массой m движется вдоль
- 19. Уравнение Шрёдингера для стационарных состояний в случае данной одномерной задачи имеет вид (1). В пределах «
- 20. Общее решение этого дифференциального уравнения имеет вид:
- 21. При подстановке этих значений K в формулу ( 3 ) , видно, что энергия микрочастицы Е
- 22. Схема энергетических уровней микрочастицы в потенциальной яме для n = 1, n = 2, n =
- 23. Подставляя значения K , получим собственные волновые функции микрочастицы , то есть волновые функции, соответствующие данному
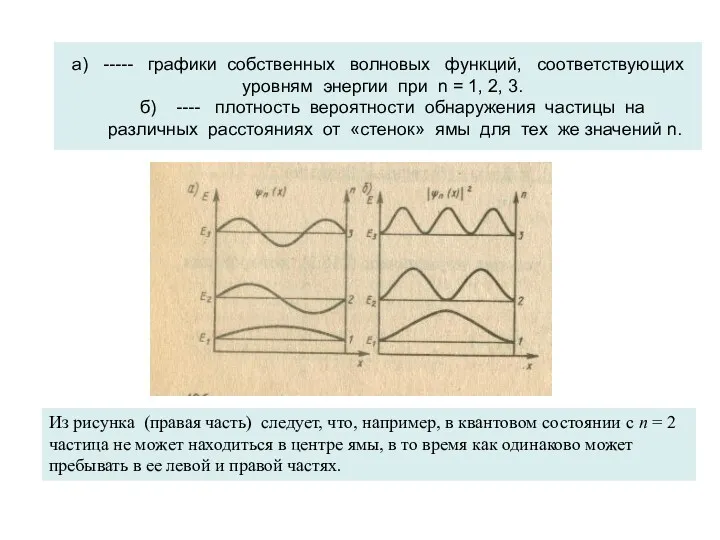
- 24. а) ----- графики собственных волновых функций, соответствующих уровням энергии при n = 1, 2, 3. б)
- 25. Энергетический интервал между двумя соседними уровнями
- 26. Квантово – механическое рассмотрение этой задачи («частица в потенциальной яме») приводит следующим к выводам : Частица
- 27. 5. Атом водорода в квантовой механике Квантовая модель атома водорода отличается от ядерной модели. В модели
- 28. Потенциальная энергия взаимодействия U(r) электрона с ядром , имеющим заряд Z e ( для атома водорода
- 29. Энергия. Дифференциальные уравнения вида (6) , удовлетворяющие требованиям однозначности, конечности и непрерывности волновой функции ψ ,
- 30. В результате решения уравнения ( 6 ) получается волновая функция ψ , которая зависит не только
- 31. ml - магнитное квантовое число определяет проекцию момента импульса орбитального движения электрона Lz на заданное направление
- 32. Кроме того, электрон обладает собственным (или внутренним) механическим моментом импульса, несвязанным с движением электрона в пространстве.
- 33. Таким образом, стационарное квантовое состояние электрона в атоме или в молекуле характеризуется полным набором четырёх квантовых
- 34. Электронные облака для разных состояний атома водорода n = 1 n = 2 n = 3
- 35. О энергии. Хотя энергия электрона в атоме водорода зависит только от главного квантового числа n, но
- 36. Энергетическая диаграмма (энергетические уровни) атома водорода в квантовой механике Каждому стационарному состоянию (энергетическому уровню с определённым
- 37. Кроме того, в квантовой механике теоретически доказано и экспериментально подтверждено, что не все электронные переходы возможны.
- 39. Скачать презентацию

































 Методическая разработка урока Электроскоп. Электрометр. Проводники и диэлектрики
Методическая разработка урока Электроскоп. Электрометр. Проводники и диэлектрики Постоянные магниты. Магнитное поле Земли
Постоянные магниты. Магнитное поле Земли Елементи теорії поля. (Лекція 10)
Елементи теорії поля. (Лекція 10) Испарение. Поглощение энергии при испарении и выделение её при конденсации пара
Испарение. Поглощение энергии при испарении и выделение её при конденсации пара Реактивное движение. Ракеты
Реактивное движение. Ракеты Capacitance in an AC circuit
Capacitance in an AC circuit Нахождение механической силы через силу и перемещение
Нахождение механической силы через силу и перемещение конспект урока на тему: Атмосферное давление. Вес воздуха
конспект урока на тему: Атмосферное давление. Вес воздуха Первый закон Ньютона
Первый закон Ньютона Исследовательская работа в области естествознания. Анемометр в измерении силы ветра. Автор: Григорьев Никита, 11 лет, 6 Б класс
Исследовательская работа в области естествознания. Анемометр в измерении силы ветра. Автор: Григорьев Никита, 11 лет, 6 Б класс Научно-исследовательская работа по физике Электричество из овощей и фруктов (5 класс)
Научно-исследовательская работа по физике Электричество из овощей и фруктов (5 класс) Трансформатор. Қазіргі трансформаторлар
Трансформатор. Қазіргі трансформаторлар Почему внутри жидкостей существует давление?
Почему внутри жидкостей существует давление? Механічна енергія. Потенціальна і кінетична енергії тіла
Механічна енергія. Потенціальна і кінетична енергії тіла Рентгеновское излучение
Рентгеновское излучение Световые явления
Световые явления Изотопы
Изотопы Движение тела под действием силы трения
Движение тела под действием силы трения Атом құрылысы
Атом құрылысы Контур с током в магнитном поле
Контур с током в магнитном поле Учебный проект по теме Виды теплопередачи
Учебный проект по теме Виды теплопередачи Компенсация реактивной мощности
Компенсация реактивной мощности Элементы теории атомного ядра
Элементы теории атомного ядра Проезентация по теме Дисперсия света
Проезентация по теме Дисперсия света Введение в радиосвязь
Введение в радиосвязь 11 класс. Презентация по физике на тему Волновые явления.
11 класс. Презентация по физике на тему Волновые явления. Законы Кирхгофа
Законы Кирхгофа Устройство и назначение карданной передачи в автомобиле
Устройство и назначение карданной передачи в автомобиле