Содержание
- 2. Волны де Бройля. Опыт Дэвиссона Гипотеза де Бройля: все "обыкновенные частицы" (электроны, протоны, нейтроны и др.)
- 3. Для фотона Гипотеза Де Бройля для частиц Волновые свойства частиц
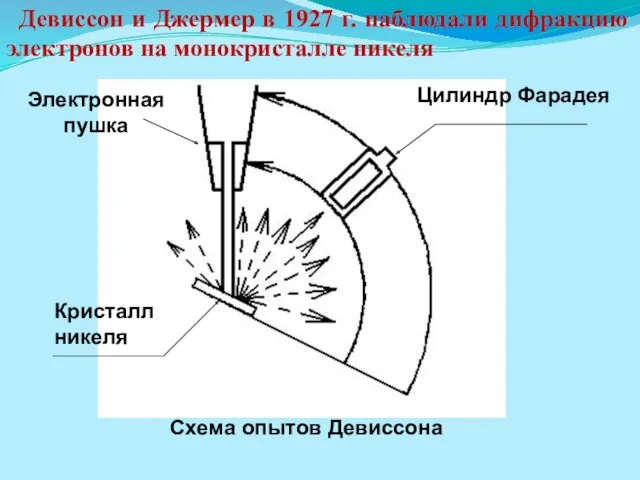
- 4. Схема опытов Девиссона Цилиндр Фарадея Электронная пушка Кристалл никеля Девиссон и Джермер в 1927 г. наблюдали
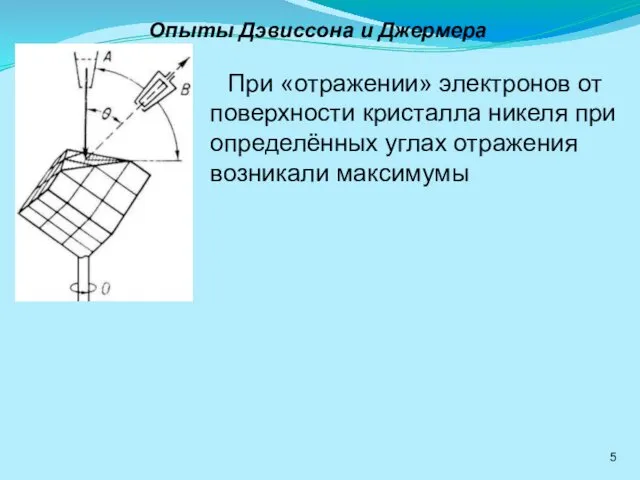
- 5. Опыты Дэвиссона и Джермера При «отражении» электронов от поверхности кристалла никеля при определённых углах отражения возникали
- 6. Угловое распределение отражённых электронов в опытах Девиссона и Джермера Падающие электроны. Отражённые электроны. Дифракционная картина, аналогичная
- 7. Применимость формулы де Бройля не ограничивается только электронами; любой частице соответствует волна, определяемая этой формулой. Для
- 8. Дифракция электронов при прохождении плёнок алюминия и золота впервые исследовали Дж. Дж. Томсон и П. С.
- 9. В 1949 г. Л.М. Биберман, Н.Г. Сушкин, В.А. Фабрикант использовали пучок малой ин-тенсивности: каждый рассеянный электрон
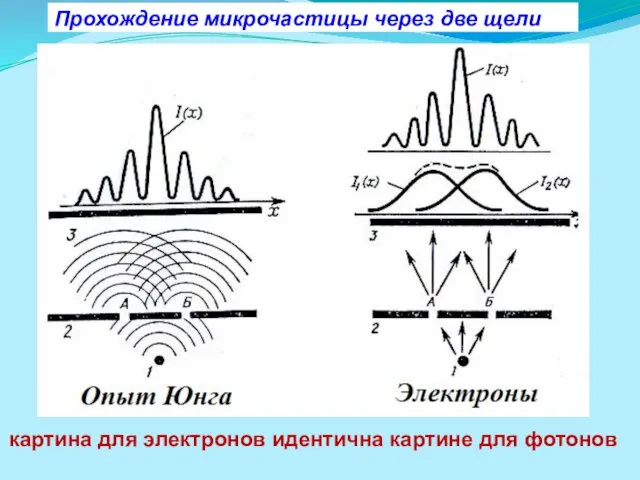
- 10. Прохождение микрочастицы через две щели картина для электронов идентична картине для фотонов
- 11. интерференционная картина от двух щелей в случае света интерференционная картина от двух щелей в случае электронов
- 12. Микрочастицы обладают корпускулярно-волновым дуализмом Каждой микрочастице соответствует волна, характеризующаяся частотой колебания ν и длиной волны λ
- 13. В случае фотонов понятно, так как волна делится на две части, которые интерферируют. Но электрон неделим
- 14. Соотношение неопределенностей В.Гейзенберг, учитывая волновые свойства микро-частиц, показал, что объект микромира невозможно одновременно с любой наперед
- 15. Принцип неопределенности 1927, Вернер Гейзенберг
- 17. Скачать презентацию











 Презентация урока по теме Количество теплоты
Презентация урока по теме Количество теплоты Хроматографические методы. (Часть 2)
Хроматографические методы. (Часть 2) Редуктор конический одноступенчатый горизонтальный
Редуктор конический одноступенчатый горизонтальный Термодинамика. Основы термодинамики
Термодинамика. Основы термодинамики Сабақтың тақырыбы Электр тогының жұмысы мен қуаты. Джоуль –Ленц заңы. Ток көзінің пайдалы әсер коэффициенті
Сабақтың тақырыбы Электр тогының жұмысы мен қуаты. Джоуль –Ленц заңы. Ток көзінің пайдалы әсер коэффициенті Буксовый узел грузового вагона. Техническая ревизия буксового узла колесный пары РУ1-Ш
Буксовый узел грузового вагона. Техническая ревизия буксового узла колесный пары РУ1-Ш What is the brake calipers?
What is the brake calipers? Полярография. Ртутно-капающий электрод. Роль метода в медицине и фармации
Полярография. Ртутно-капающий электрод. Роль метода в медицине и фармации Сила Лоренца
Сила Лоренца сила упругости
сила упругости Своя игра. Физика. 7 класс.
Своя игра. Физика. 7 класс. Электромагнитные колебания
Электромагнитные колебания Радиоактивность. Виды радиоактивных излучений. Изотопы. Закон радиоактивного распада. Радиоактивность вокруг нас
Радиоактивность. Виды радиоактивных излучений. Изотопы. Закон радиоактивного распада. Радиоактивность вокруг нас Трехфазные цепи переменного тока
Трехфазные цепи переменного тока Энергия топлива- урок физики в 8 классе
Энергия топлива- урок физики в 8 классе Влияние на работу дороги природных факторов
Влияние на работу дороги природных факторов Жұмыс орындарындағы электромагниттік сәулеленулер
Жұмыс орындарындағы электромагниттік сәулеленулер Скорость света
Скорость света Електричний струм у газах. Самостійний і несамостійний газові розряди. Плазма
Електричний струм у газах. Самостійний і несамостійний газові розряди. Плазма Основные законы идеального газа
Основные законы идеального газа Механика. Основные понятия кинематики
Механика. Основные понятия кинематики Аеродинаміка та динаміка польоту літака. Аеродинамічні характеристики крила. (Лекція 5.2.1)
Аеродинаміка та динаміка польоту літака. Аеродинамічні характеристики крила. (Лекція 5.2.1) Совершенствование коробки передач автомобиля УАЗ ПАТРИОТ
Совершенствование коробки передач автомобиля УАЗ ПАТРИОТ Метод кругового дихроизма и дисперсии оптического вращения
Метод кругового дихроизма и дисперсии оптического вращения Constraints application. Solution and computation of reactions, displacements, rotations, stresses and strains. 19 lesson
Constraints application. Solution and computation of reactions, displacements, rotations, stresses and strains. 19 lesson Рулевое управление
Рулевое управление Електричний струм у різних середовищах
Електричний струм у різних середовищах Модальный метод синтеза непрерывных систем
Модальный метод синтеза непрерывных систем