Содержание
- 2. Лекция № 3 Второе начало термодинамики. 1. Обратимые и необратимые процессы. 2. Энтропия. Второе начало термодинамики.
- 3. Обратимым процессом называется такое изме- нение состояния системы (или одного отдельного тела), которое будучи проведено в
- 4. Процесс называют обратимым, если он протекает таким образом, что после окончания процесса он может быть проведен
- 5. Процесс называется необратимым, если он протекает так, что после его окончания систему нельзя вернуть в начальное
- 6. Свойством обратимости обладают только равновесные процессы. Каждое промежуточное состояние является состоянием термодинамического равновесия, нечувствительного к тому,
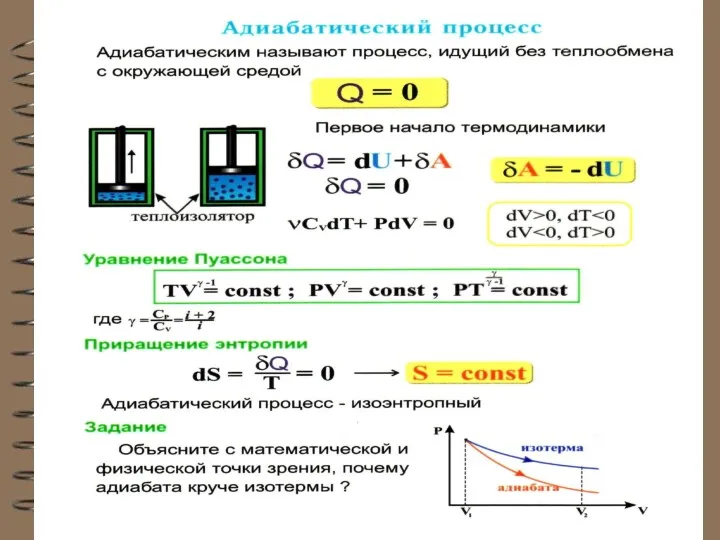
- 7. При адиабатическом расширении газа условие теплоизолированности системы исключает непосредственный теплообмен между системой и средой. Поэтому, производя
- 8. Адиабатный (адиабатический) процесс Это процесс, происходящий без теплообмена с окружающей средой, т.е. При адиабатном процессе работа
- 9. Подставляя dT в уравнение: Группируя PdV: Делим на где Т.к. γ = const ( для одноатомного
- 10. уравнение Пуассона или уравнение адиабаты для идеального газа Или в переменных Т и V уравнение адиабаты
- 12. Конечно, в реальных условиях и в этом случае всегда имеется некоторая необратимость процесса, обусловленная, например, несовершенством
- 13. Второе начало термодинамики Термодинамика, это наука о тепловых процессах, о превращении тепловой энергии. Для описания термодинамических
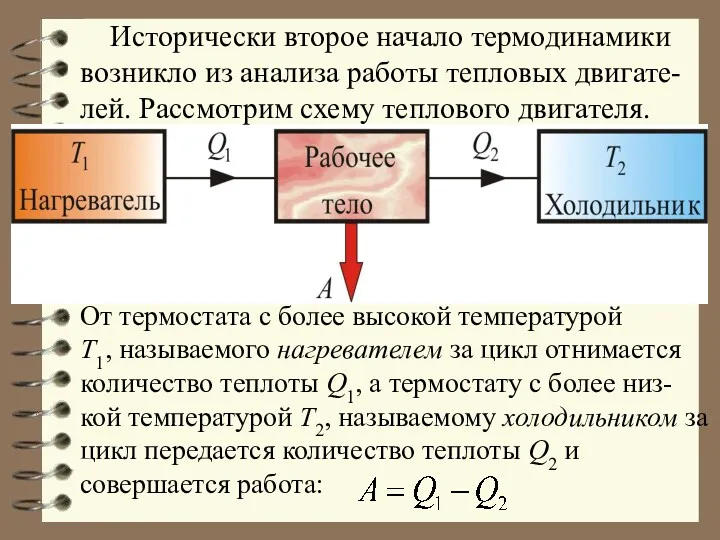
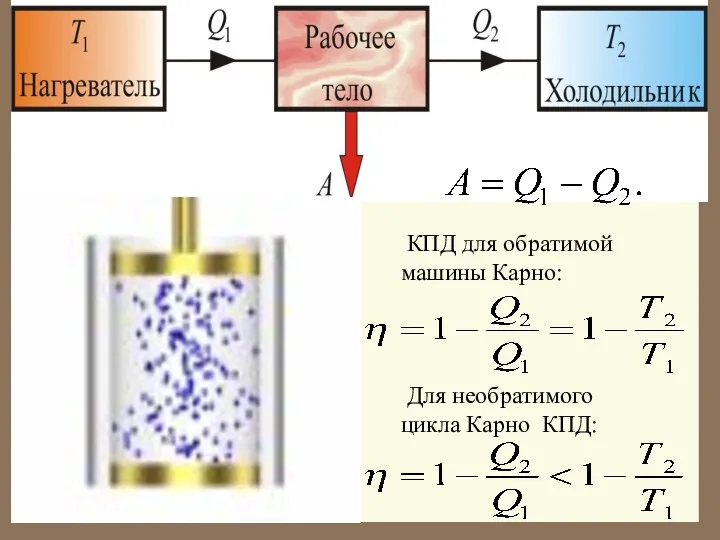
- 14. Исторически второе начало термодинамики возникло из анализа работы тепловых двигате-лей. Рассмотрим схему теплового двигателя. От термостата
- 15. КПД для обратимой машины Карно: Для необратимого цикла Карно КПД:
- 16. Если рассматривать процесс с точки зрения изме-нений, происходящих в самом рабочем теле (иде-альном газе), то Q1
- 17. Отношение иногда называют, по Лоренцу, приведённой теплотой. В обратимом процессе сумма приведённых теплот равна нулю. Система
- 18. В равенстве Клаузиуса Т – температура системы, при которой ей сообщается элементарное количество теплоты , а
- 19. Энтропией S называется функция состояния системы, дифференциал которой в элементарном обратимом процессе равен отношению бесконечно малого
- 20. Понятие энтропии было впервые введено Рудольфом Клаузиусом в 1865 г. Для обратимых процессов изменение энтропии: -
- 21. Клаузиус Рудольф Юлиус Эмануэль (1822 – 1888) – немецкий физик-теоретик, один из создателей термодинамики и кинетической
- 22. Изменение энтропии в изопроцессах Энтропия системы является функцией ее состояния, определенная с точностью до произвольной постоянной.
- 23. Таким образом, по этой формуле можно определить энтропию лишь с точностью до аддитивной постоянной, т.е. начало
- 24. Так как, а то или
- 25. Изменение энтропии ΔS1→2 идеального газа при переходе его из состояния 1 в состояние 2 не зависит
- 26. изобарический: т.к. Р1 = Р2, изотермический: т.к. адиабатический: адиабатический процесс называют изоэнтропийным процессом, т.к.
- 27. Изменение энтропии в изопроцессах:
- 28. Поведение энтропии в процессах изменения агрегатного состояния Рассмотрим три агрегатных состояния: твердое, жидкое и газообразное и
- 29. 1. Переход вещества из твердого состо-яния (фазы) в жидкое называется плав-лением, а обратный – кристаллизация. 2.
- 30. 4. Закон плавления: количество тепла δQ, которое необходимо для плавле-ния вещества массой dm, пропорци-онально этой массе:
- 31. Этот закон справедлив и для кристаллизации, правда, с одним отличием: δQ в этом случае – тепло
- 32. Можно использовать термодинамичес-кий смысл энтропии: с точки зрения термодинамики энтропия – это такая функция состояния системы,
- 33. или Подставим сюда выражение для δQ, получим:
- 34. Так как температура системы в данном фазовом переходе не меняется и равна температуре плавления Тпл ,
- 35. Из этой формулы следует, что при плавлении энтропия возрастает, а при кристаллизации уменьшается. Физический смысл этого
- 36. Поэтому при равной температуре энтропия твердого тела меньше энтропии жидкости. Это означает, что твердое тело представляет
- 37. Фазовый переход «жидкость – газ» Этот переход обладает всеми свойствами перехода «твердое тело – жидкость». Существует
- 38. 2. При испарении система поглощает тепло, при конденсации – теряет. 3. Процессы испарения и конденсации протекают
- 39. В процессе фазового перехода «жидкость – газ» температура остается постоянной и равной температуре кипения до тех
- 40. Коэффициент пропорции r в этом выражении, есть константа, зависящая от вещества системы, называемая удельной теплотой испарения.
- 41. Изменение энтропии в этом процес-се можно найти просто, считая процесс равновесным. И опять это вполне допус-тимое
- 42. При равных температурах фазовая область молекул газа значительно больше фазовой области молекул жидкости, и энтропия газа
- 43. Изменения энтропии при обратимых и необратимых процессах Итак, энтропия – отношение полученной или отданной системой теплоты
- 44. Обратимый цикл Карно Мы знаем, что, в тепловой машине, работающей по принципу Карно, имеются три тела:
- 45. Изменение энтропии нагревателя: Для холодильника: А т.к.
- 46. то т.е. или т.е. S – константа. Это выражение называют равенство Клаузиуса.
- 47. Необратимый цикл Карно Мы знаем, что т.е., или
- 48. Таким образом Это неравенство Клаузиуса. Неравенство Клаузиуса является математической записью второго начала термодинамики для необра- тимых
- 49. Для замкнутой системы – математическая запись второго начала термодинамики. Для произвольного процесса, где, знак равенства –
- 50. Различные формулировки второго начала термодинамики Математической формулировкой второго начала является выражение: Энтропия замкнутой системы при любых
- 51. При любом необратимом процессе энтропия увеличивается до того, пока не прекратятся какие-либо процессы. Это произойдет, при
- 52. При обратимом процессе: При необратимом процессе: − изменение энтропии больше приведенной теплоты. Тогда эти выражения можно
- 53. Первое и второе начала термодинамики в объединенной форме имеют вид: знак равенства – для обратимого процесса;
- 54. Невозможность убывания энтропии привело к выводу о невозможности создания вечного двигателя второго рода. Этот вывод называется
- 55. Третье начало термодинамики Недостатки первого и второго начал термодинамики в том, что они не позволяют определить
- 56. Нернст Вальтер Фридрих Герман (1864 – 1941) – немецкий физик и физ-химик, один из основоположников физической
- 57. Согласно Нернсту, изменение энтропии ΔS стремится к нулю при любых обратимых изотермических процессах, совершаемых между двумя
- 58. Как первое и второе начала термодинамики, теорема Нернста может рассматриваться как результат обобщения опытных фактов, поэтому
- 59. Следствием Третьего начала является то что, невозможно охладить тело до абсолютного нуля (принцип недостижимости абсолютного нуля
- 61. Скачать презентацию























































 Введение в Физику
Введение в Физику Урок физики в 7 классе по теме Давление.Единицы давления
Урок физики в 7 классе по теме Давление.Единицы давления Fast and Simple Physics using Sequential Impulses
Fast and Simple Physics using Sequential Impulses Сварные и паяные соединения
Сварные и паяные соединения Презентация к игре Звездный час для учащихся 7-8 классов
Презентация к игре Звездный час для учащихся 7-8 классов Презентация по физике для 8 класса - своя игра по теме Электричество
Презентация по физике для 8 класса - своя игра по теме Электричество Закон збереження механічної енергії
Закон збереження механічної енергії Подшипники скольжения
Подшипники скольжения Допоміжне устаткування холодильних машин
Допоміжне устаткування холодильних машин Решение задач по теме Законы Ньютона
Решение задач по теме Законы Ньютона Изобретение радио
Изобретение радио Графики зависимости кинематических величин от времени при равномерном и равноускоренном движении
Графики зависимости кинематических величин от времени при равномерном и равноускоренном движении Люменисцентті және электронды микроскопия
Люменисцентті және электронды микроскопия Свойства волн
Свойства волн Источники холода для СКВ
Источники холода для СКВ Разработка урока с презентацией Г.Я. Мякишев, Б.Б. Буховцев, Н.Н. Сотский, 10 класс Уравнение состояния идеального газа. Газовые законы
Разработка урока с презентацией Г.Я. Мякишев, Б.Б. Буховцев, Н.Н. Сотский, 10 класс Уравнение состояния идеального газа. Газовые законы Основные понятия по допускам и посадкам
Основные понятия по допускам и посадкам Когда изобрели велосипед?
Когда изобрели велосипед?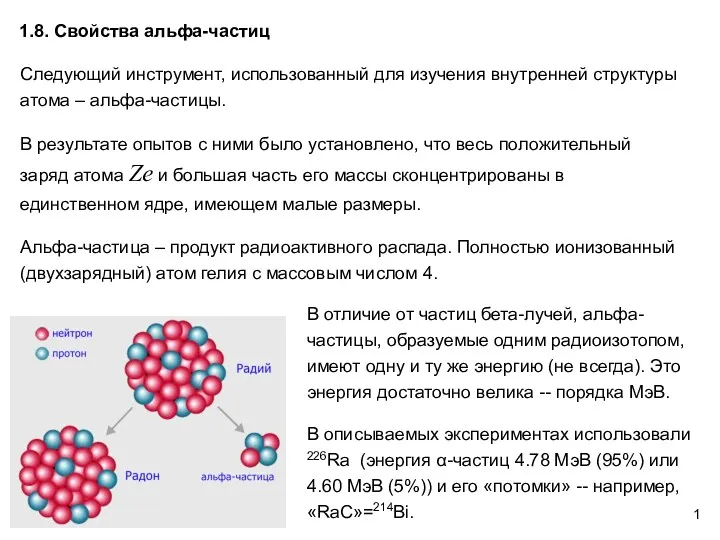 Свойства альфа-частиц. АФ1.8
Свойства альфа-частиц. АФ1.8 Параллельное и последовательное соединение
Параллельное и последовательное соединение Энергия магнитного поля
Энергия магнитного поля Проблема онтологической редукции. Проблема редукции химии к физике
Проблема онтологической редукции. Проблема редукции химии к физике Явление электромагнитной индукции
Явление электромагнитной индукции Закон Ома
Закон Ома Волновая оптика
Волновая оптика Презентация к уроку физики в 7 классе Центр тяжести тела
Презентация к уроку физики в 7 классе Центр тяжести тела Второе начало термодинамики. Идеальная тепловая машина. Цикл Карно
Второе начало термодинамики. Идеальная тепловая машина. Цикл Карно Здравствуй,физика!
Здравствуй,физика!