Содержание
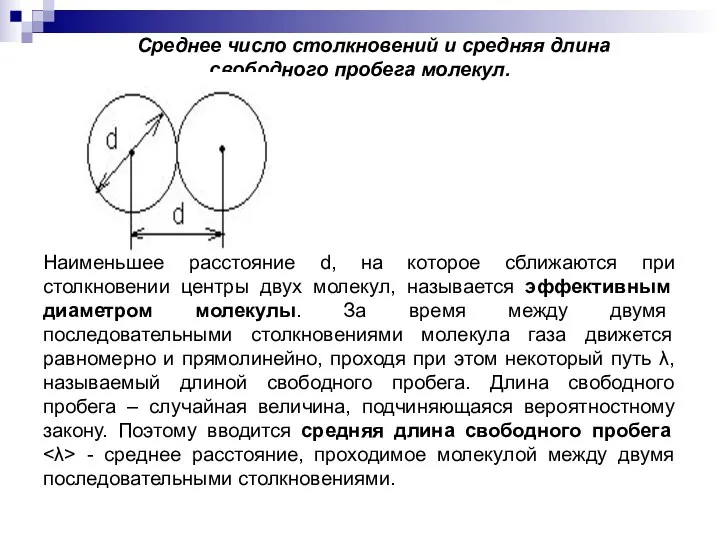
- 2. Среднее число столкновений и средняя длина свободного пробега молекул. Наименьшее расстояние d, на которое сближаются при
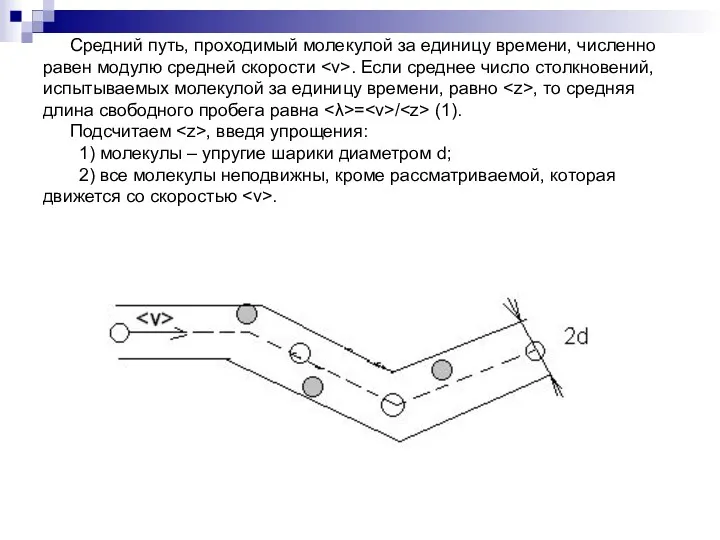
- 3. Средний путь, проходимый молекулой за единицу времени, численно равен модулю средней скорости . Если среднее число
- 4. Среднее число столкновений за 1 с равно числу молекул в объеме этого цилиндра: =nV, где n
- 5. Явления переноса Теплопроводность – процесс выравнивания температуры газа, сопровождающийся направленным переносом энергии из более нагретых слоев
- 6. Физ.смысл теплопроводности: коэффициент теплопроводности численно равен количеству тепла, переносимому за единицу времени через единичную площадку, перпендикулярно
- 7. Диффузия – процесс перемешивания молекул, сопровождающийся переносом массы из мест с большей концентрацией данных молекул в
- 8. Знак « - » показывает, что перенос массы происходит в направлении убывания плотности. где D –
- 9. Внутреннее трение (вязкость) в газе – взаимодействие между слоями газа, движущимися с различными скоростями. Явление сопровождается
- 10. Физ.смысл вязкости: коэффициент вязкости численно равен модулю импульса направленного движения молекул, перенесенному за единицу времени через
- 11. РЕАЛЬНЫЕ ГАЗЫ, ЖИДКОСТИ И ТВЕРДЫЕ ТЕЛА
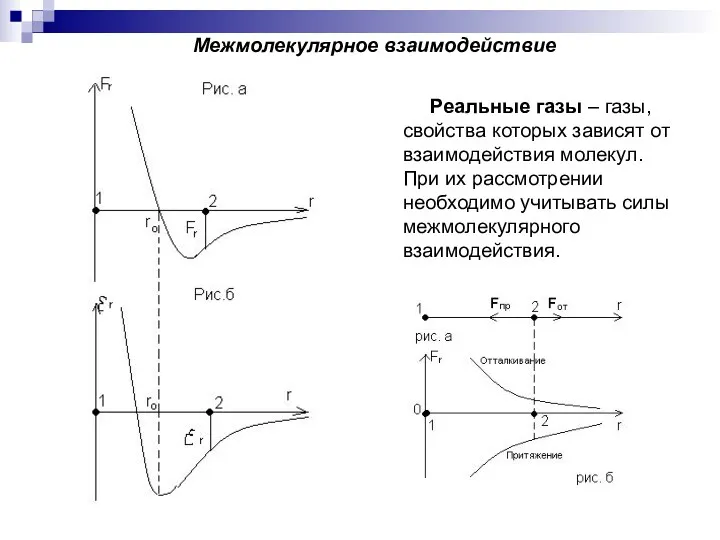
- 12. Межмолекулярное взаимодействие Реальные газы – газы, свойства которых зависят от взаимодействия молекул. При их рассмотрении необходимо
- 13. Рассмотрим две молекулы 1 и 2. Проведем через центры молекул ось r в направлении от 1
- 14. 2) Если >> то вещество находится в газообразном состоянии. Средняя кинетическая энергия теплового движения велика и
- 15. Уравнение Ван–дер-Ваальса Уравнение Ван-дер-Ваалься для моля газа – уравнение состояния реальных газов. (2), т.к. V=νVm=>Vm=V/ν, тогда
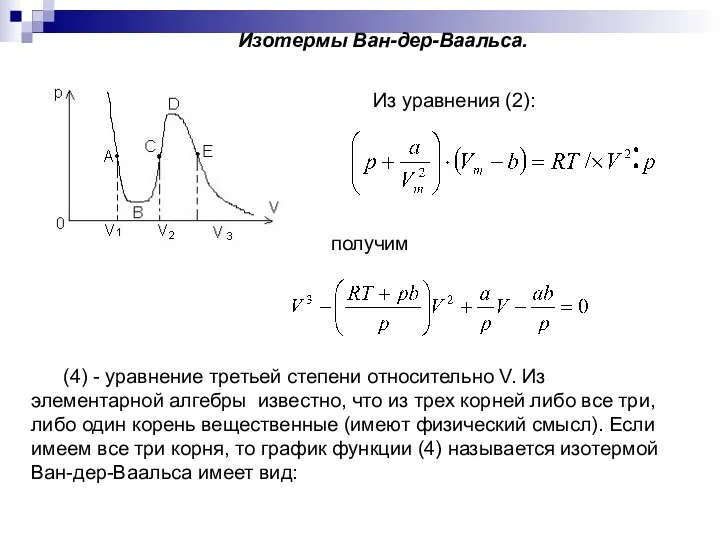
- 16. Изотермы Ван-дер-Ваальса. Из уравнения (2): получим (4) - уравнение третьей степени относительно V. Из элементарной алгебры
- 17. Часть 4 – 3 отвечает газообразному состоянию, а часть 2 – 1 – жидкому. В состояниях,
- 18. С ростом температуры область горбов и впадин на изотерме Ван-дер-Ваальса уменьшается. При некоторой температуре, называемой критической
- 19. Критическое состояние вещества – состояние, при котором исчезает всякое различие между жидкостью и ее насыщенным паром.
- 20. Поверхностное натяжение, капиллярные явления На каждую молекулу жидкости со стороны окружающих молекул действуют силы притяжения, быстро
- 22. Скачать презентацию















 Что называют радиоактивностью?
Что называют радиоактивностью? Инженерлік механиканың негіздері
Инженерлік механиканың негіздері Строение атомного ядра. Ядерные силы
Строение атомного ядра. Ядерные силы Система запуска
Система запуска Нагревание проводников электрическим током. Закон Джоуля-Ленца
Нагревание проводников электрическим током. Закон Джоуля-Ленца Импульс тела. Закон сохранения
Импульс тела. Закон сохранения Урок физики в 7 классе Тема: Градуирование пружины и измерение сил динамометром.
Урок физики в 7 классе Тема: Градуирование пружины и измерение сил динамометром. Lenses. Types of lenses. Main characteristics of the lenses
Lenses. Types of lenses. Main characteristics of the lenses Мир физики
Мир физики Мастер класс Использование сказки для развития познавательного интереса учащихся на уроках физики
Мастер класс Использование сказки для развития познавательного интереса учащихся на уроках физики Метод замены нескольких последовательно соединенных генераторов напряжения одним эквивалентным. (Лекция 4)
Метод замены нескольких последовательно соединенных генераторов напряжения одним эквивалентным. (Лекция 4) Закон сохранения импульса
Закон сохранения импульса Статика. Введение в статику
Статика. Введение в статику Теория турбомашин. Введение. Задачи курса, его метод и связь с другими предметами учебного плана
Теория турбомашин. Введение. Задачи курса, его метод и связь с другими предметами учебного плана Проект по физике на тему Жизнь замечательных людей. А.Д. Сахаров
Проект по физике на тему Жизнь замечательных людей. А.Д. Сахаров Қозғалыс материяның ажырамас қасиеті. Материалдық нүкте. Санақ жүйесі. Салыстырмалы механикалық қозғалыс
Қозғалыс материяның ажырамас қасиеті. Материалдық нүкте. Санақ жүйесі. Салыстырмалы механикалық қозғалыс Магнитное поле в вакууме
Магнитное поле в вакууме Диэлектрические потери и диэлектрическая спектроскопия
Диэлектрические потери и диэлектрическая спектроскопия Презентация к уроку Анероид - высотомер
Презентация к уроку Анероид - высотомер Равновесные и неравновесные носители зарядов
Равновесные и неравновесные носители зарядов Відносність руху
Відносність руху Атомның кванто- механикалық моделі. Атом орбиталі, квант саны. Атомдардың электрондық конфигурациясы
Атомның кванто- механикалық моделі. Атом орбиталі, квант саны. Атомдардың электрондық конфигурациясы Презентация по физике 8 класс по теме История изобретения паровых машин
Презентация по физике 8 класс по теме История изобретения паровых машин Причины изменения технического состояния автомобиля (для обучающихся СПО по специальности Техник
Причины изменения технического состояния автомобиля (для обучающихся СПО по специальности Техник Модернизация швейной машины 335-12 класса
Модернизация швейной машины 335-12 класса Энергия. Тест 10
Энергия. Тест 10 Уравнение газового состояния. Решение задач
Уравнение газового состояния. Решение задач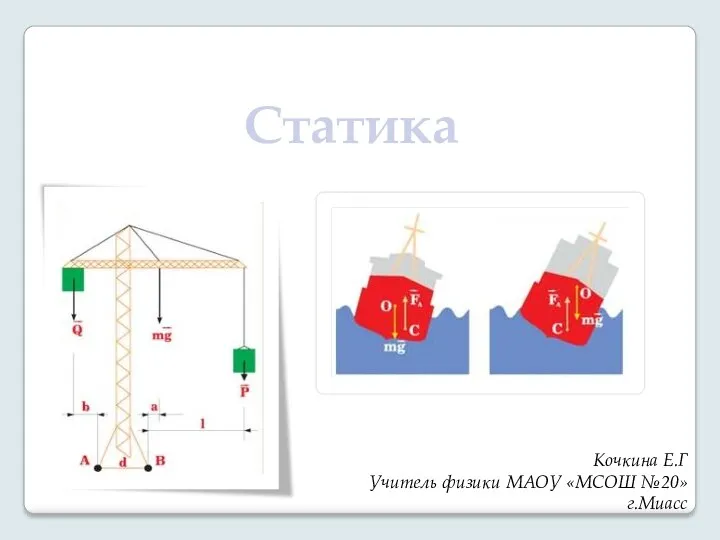 Статика. Равновесие тел
Статика. Равновесие тел