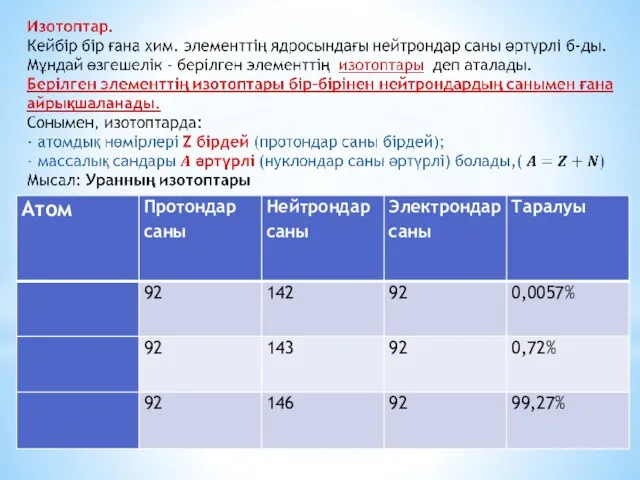
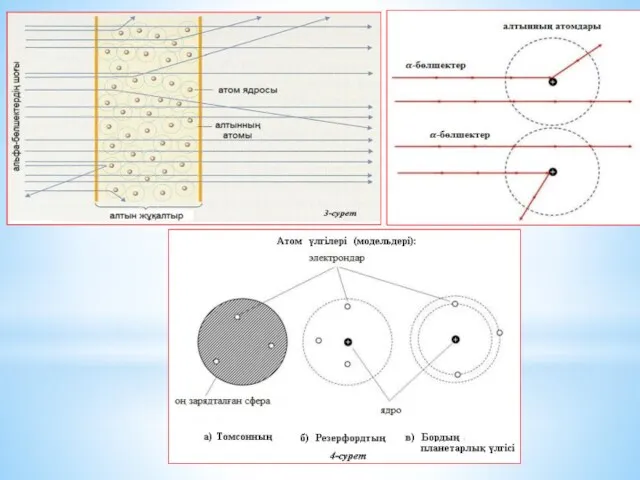
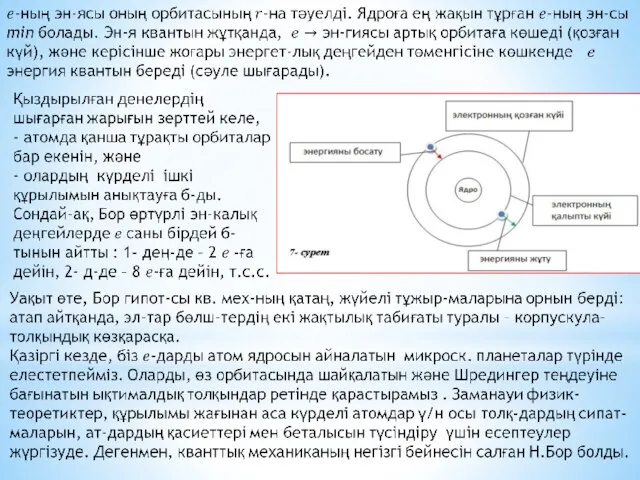
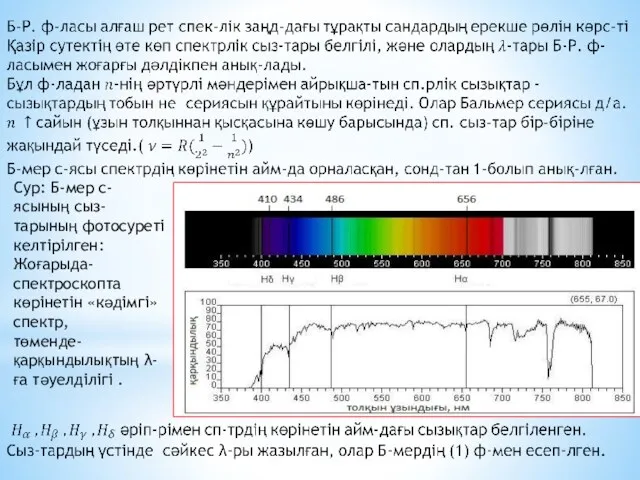
Эл-трон қозғалған әрбір осындай орбита «энергетикалық деңгейлер» д/а.
Атомдағы эл-тронның энергиясы
тек қана секірмелі өзгереді, яғни эл-трон төменгі орбитаға секіріп өткенде, ол эн-гиясын жоғалтады, демек жарық квантын , яғни белгілі бір эн-гиясы ж/е λ-сы бар фотонды шығарады.
Ал жоғарырақ орбитаға өту үшін эл-трон сәйкесінше фотонды (жарық квантын) жұту к/к (эл-трон орбиталардың арасына орналаса алмайды). Сондықтан, эл-рондардың энергет-лық күйлері квантталған дейді.
«Рұқсат етілген» өз орбиталарында тұрған эл-трондар белгілі бір қарқындылығы мен жиілігі бар ЭМ толқынды шығара алмайды, әйтпесе төмен рұқсат етілмеген орбитаға өтуші еді.
Сондықтан олар өзінің анағұрлым жоғары орбитасында ұсталынып тұрады.
Алайда, эл-трон басқа «рұқсат етілген» орбитаға өте алады, мұны, кванттық мех-ның көптеген құбылыстары сияқты, көрнекті түрде елестету қиын: электрон орбитадан кәдімгідей жоғалып кетеді де, орбита арасын қимай, басқа орбитаға пайда болып (материалданып), шыға келеді. Бұл эффектіні «кванттық секіру» д/а
Сонымен, Бор б-ша, электрон бір рұқсат етілген орбитадан екіншісіне дискретті (үзікті) түрде секірмелі өтеді. Әрбір секіру, міндетті түрде ЭМ сәулелену энергиясының квантын (фотонды) шығару не жұтумен бірге жүреді.





















 Оптическое излучение импульсного объемного разряда в инертных газах высокого давления
Оптическое излучение импульсного объемного разряда в инертных газах высокого давления СТО-ның міндеттері
СТО-ның міндеттері Формирование и первичная обработка видеосигналов
Формирование и первичная обработка видеосигналов Закон Архимеда
Закон Архимеда Формирование учебно-познавательной компетенции учащихся второй ступени обучения на уроках физики
Формирование учебно-познавательной компетенции учащихся второй ступени обучения на уроках физики Тележка электровоза ВЛ80р
Тележка электровоза ВЛ80р Двигатели летательных аппаратов
Двигатели летательных аппаратов Обслуживание и ремонт кривошипно-шатунного механизма
Обслуживание и ремонт кривошипно-шатунного механизма Открытие радиоактивности. Радиоактивные превращения
Открытие радиоактивности. Радиоактивные превращения Уплотнения опор
Уплотнения опор Совершенствование вычислительных машин
Совершенствование вычислительных машин Электромобиль. Возможности и перспективы использования (7 класс)
Электромобиль. Возможности и перспективы использования (7 класс) Презентация по теме Центр тяжести тела
Презентация по теме Центр тяжести тела Механические волны
Механические волны Техническое обслуживание и ремонт автосцепки локомотива
Техническое обслуживание и ремонт автосцепки локомотива Робота і потужність електричного струму. Урок 56
Робота і потужність електричного струму. Урок 56 Shunt and Series Compensation
Shunt and Series Compensation Технічне обслуговування електрообладнання автомобілів та системи запалювання карбюраторних двигунів (6)
Технічне обслуговування електрообладнання автомобілів та системи запалювання карбюраторних двигунів (6) Атомная энергия
Атомная энергия Диэлектрические потери
Диэлектрические потери Дифракция света
Дифракция света Определение коэффициента поверхностного натяжения синтетических моющих средств
Определение коэффициента поверхностного натяжения синтетических моющих средств قوة المولد بروفايل
قوة المولد بروفايل Механическое движение. Что называют механическим движением?
Механическое движение. Что называют механическим движением? Параллельное и последовательное соединение проводников
Параллельное и последовательное соединение проводников Енераторларға техникалық қызмет көрсету және жөндеу
Енераторларға техникалық қызмет көрсету және жөндеу Расчёт ферм
Расчёт ферм КПД простых механизмов. Уроки физики в 7 классе
КПД простых механизмов. Уроки физики в 7 классе