Слайд 2

Проверка знаний:
NaOH
Cu(OH)2
Al(OH)3.
Слайд 3

Слайд 4

Слайд 5

Цели урока:
Сформировать понятие об основаниях как классе электролитов.
Рассмотреть их классификацию по
разным признакам.
Представить химические свойства оснований в свете теории электролитической диссоциации.
Слайд 6

Физические свойства оснований
Ba(OH)2
Co(OH)2
NaOH
Ca(OH)2
LiOH
Cu(OH)2
Слайд 7
Слайд 8

Ca(OH)2 – гидроксид кальция
Fe(OH)2 – гидроксид железа (II)
Fe(OH)3 – гидроксид железа
(III)
Слайд 9

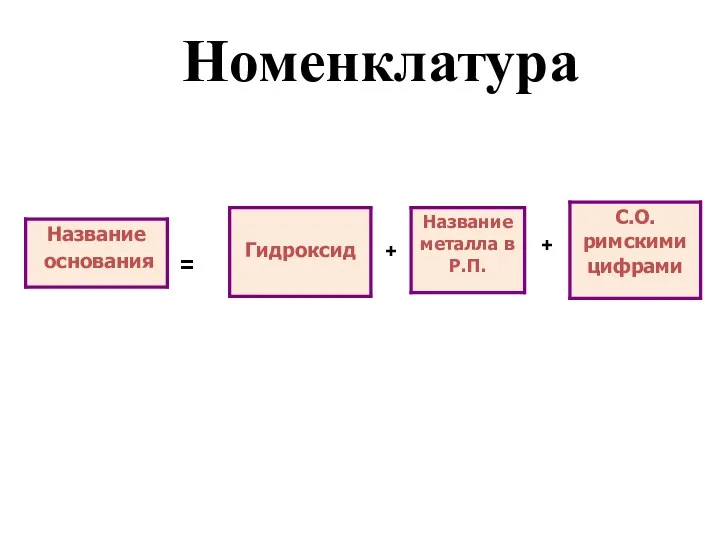
Основания - это сложные вещества, состоящие из ионов металла и одной
или нескольких гидроксогрупп
Слайд 10

Если заряд иона металла равен +1, то формула гидроксида МеОН
Если заряд
иона металла равен +2 , то формула гидроксида Ме(ОН)2
Если заряд иона металла равен +3 , то формула гидроксида Ме(ОН)3
Слайд 11
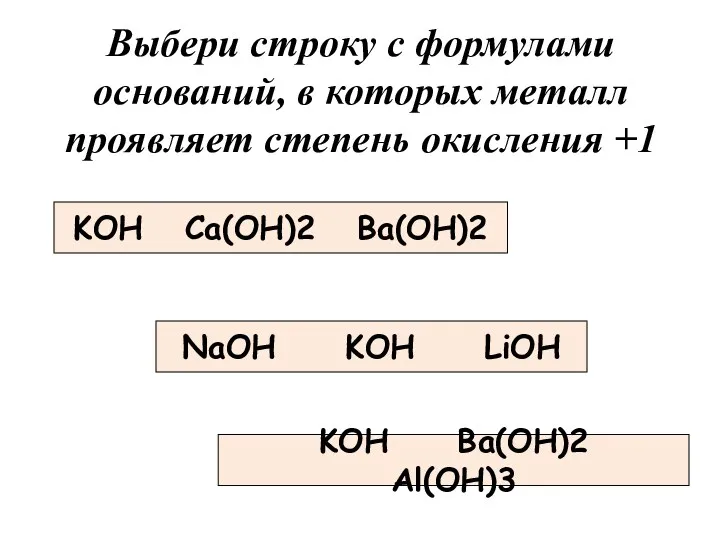
KOH Ca(OH)2 Ba(OH)2
Выбери строку с формулами оснований, в которых металл проявляет
степень окисления +1
NaOH KOH LiOH
KOH Ba(OH)2 Al(OH)3
Слайд 12

Лабораторный опыт
Опыт №1 Растворение гидроксидов.
Цель: на основании проведенного опыта сделать вывод
о растворимости оснований.
Содержание и порядок выполнения работы:
1) Взаимодействие с водой.
1. Добавьте воду в пробирки с твёрдыми веществами:
1-я пробирка - гидроксид натрия. Наблюдаем …
2-я пробирка - гидроксид кальция. Наблюдаем …
3-я пробирка - гидроксид меди. Наблюдаем …
Выводы:
Слайд 13
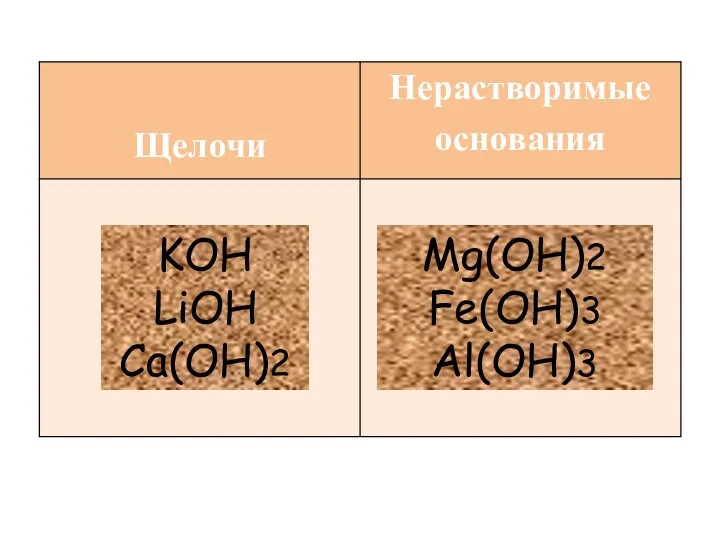
KOH
LiOH
Ca(OH)2
Mg(OH)2
Fe(OH)3
Al(OH)3
Слайд 14

Лабораторный опыт
Опыт №2 Взаимодействие с кислотами.
Цель: на основании проведенного опыта сделать
вывод об особенностях взаимодействия оснований с кислотами.
Содержание и порядок выполнения работы:
Налить в пробирку немного раствора гидроксида натрия, добавить фенолфталеин.
Наблюдаем …
В эту же пробирку добавить соляную кислоту. Наблюдаем …
Выводы:
Уравнения реакций в молекулярном и ионном виде
Слайд 15

Основание + кислота = соль + вода














 5511c750430548bfa1da4ba840324bb2
5511c750430548bfa1da4ba840324bb2 NPK Fertilizers. Classification of fertilizers
NPK Fertilizers. Classification of fertilizers Строение атома. 8 класс
Строение атома. 8 класс Protein and amino acid metabolism
Protein and amino acid metabolism Химические свойства солей
Химические свойства солей Растворы ВМС и их свойства
Растворы ВМС и их свойства Композиционные материалы
Композиционные материалы Алкени і алкіни
Алкени і алкіни Соли, как производные кислот и оснований. Их состав и номенклатура
Соли, как производные кислот и оснований. Их состав и номенклатура Пластмассы
Пластмассы 9 Амины
9 Амины №2 Практикалық жұмыс. Химиялық реакция жылдамдығына әртүрлі факторлардың әсерін зерттеу
№2 Практикалық жұмыс. Химиялық реакция жылдамдығына әртүрлі факторлардың әсерін зерттеу Липиды; классификация; строение; значение для жизнедеятельности организмов
Липиды; классификация; строение; значение для жизнедеятельности организмов Возникновение и развитие научной химии
Возникновение и развитие научной химии Оптические свойства дисперсных систем. Оптические методы исследования коллоидных систем
Оптические свойства дисперсных систем. Оптические методы исследования коллоидных систем Электролитическая диссоциация
Электролитическая диссоциация Решение задач на нахождение молекулярной формулы органических веществ
Решение задач на нахождение молекулярной формулы органических веществ Амины
Амины Дисперсные системы. Свойства коллоидных растворов
Дисперсные системы. Свойства коллоидных растворов Валентные возможности атомов химических элементов
Валентные возможности атомов химических элементов Углеводы. Моносахариды
Углеводы. Моносахариды Аномальные свойства воды – основа жизни на Земле
Аномальные свойства воды – основа жизни на Земле Ароматические углеводороды (арены)
Ароматические углеводороды (арены) Значення хімічних процесів у природі
Значення хімічних процесів у природі Кислород. Электронное строение и свойства
Кислород. Электронное строение и свойства Искусственные полимеры
Искусственные полимеры Месторождения турмалина
Месторождения турмалина Электронное строение атома
Электронное строение атома