Содержание
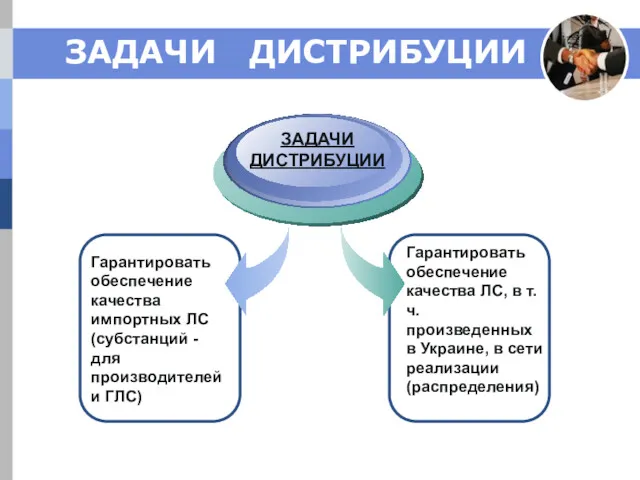
- 2. ЗАДАЧИ ДИСТРИБУЦИИ Гарантировать обеспечение качества импортных ЛС (субстанций - для производителей и ГЛС) ЗАДАЧИ ДИСТРИБУЦИИ Гарантировать
- 3. GDP – GOOD DISTRIBUTION PRACTICE ДИСТРИБЬЮЦИЯ - неотъемлемая часть системы обеспечения качества ЛС
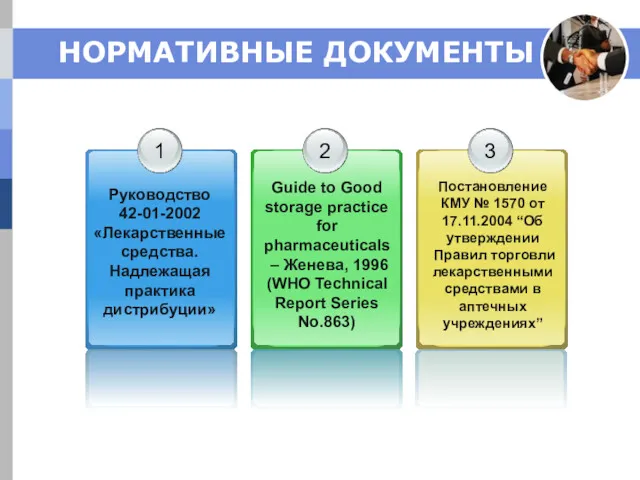
- 4. НОРМАТИВНЫЕ ДОКУМЕНТЫ
- 5. ТРЕБОВАНИЯ GDP Руководство 42-01-2002 ПОСТАВКИ ПОТРЕБИТЕЛЯМ ПОМЕЩЕНИЯ И ОБОРУДОВАНИЕ (ПОЛУЧЕНИЕ, ХРАНЕНИЕ) ДОКУМЕНТАЦИЯ ПЕРСОНАЛ ОСНОВНЫЕ ПОЛОЖЕНИЯ САМОИНСПЕКЦИЯ
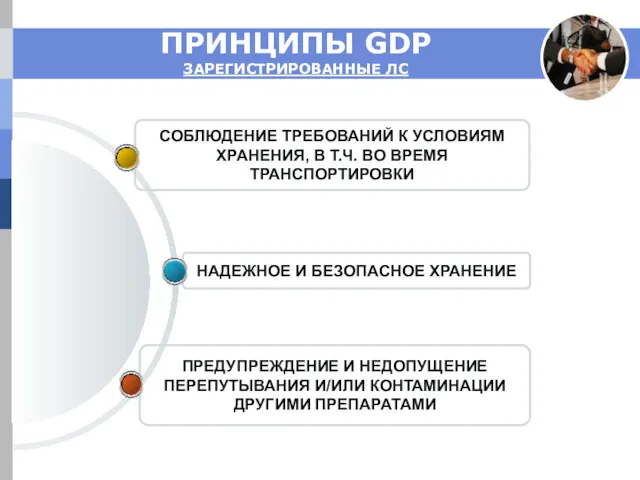
- 6. ПРИНЦИПЫ GDP ЗАРЕГИСТРИРОВАННЫЕ ЛС ПРЕДУПРЕЖДЕНИЕ И НЕДОПУЩЕНИЕ ПЕРЕПУТЫВАНИЯ И/ИЛИ КОНТАМИНАЦИИ ДРУГИМИ ПРЕПАРАТАМИ НАДЕЖНОЕ И БЕЗОПАСНОЕ ХРАНЕНИЕ
- 7. ПРИНЦИПЫ GDP ОБОРОТНОСТЬ ЗАПАСОВ СОЗДАНИЕ И ФУНКЦИОНИРОВАНИЕ НАДЕЖНОЙ СИСТЕМЫ ОТЗЫВА ПРОДУКЦИИ ПОЛНЫЕ И ОДНОЗНАЧНЫЕ ПРОТОКОЛЫ РАСПРЕДЕЛЕНИЯ
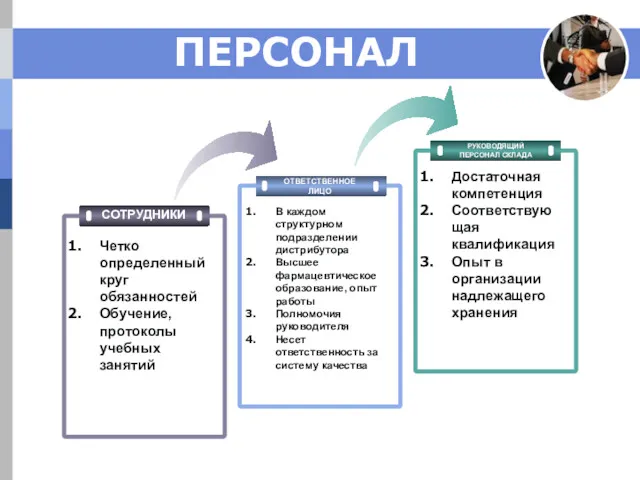
- 8. ПЕРСОНАЛ ОТВЕТСТВЕННОЕ ЛИЦО РУКОВОДЯЩИЙ ПЕРСОНАЛ СКЛАДА В каждом структурном подразделении дистрибутора Высшее фармацевтическое образование, опыт работы
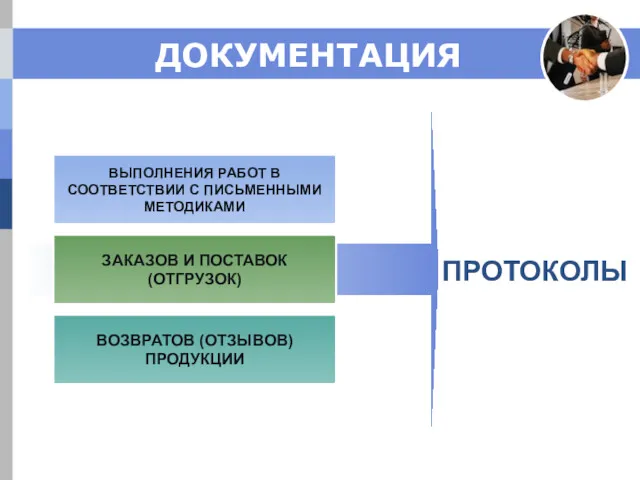
- 9. ДОКУМЕНТАЦИЯ ПИСЬМЕННЫЕ МЕТОДИКИ: получение и проверка обслуживание складских помещений контроля и регистрации условий хранения обращения с
- 10. ВЫПОЛНЕНИЯ РАБОТ В СООТВЕТСТВИИ С ПИСЬМЕННЫМИ МЕТОДИКАМИ ЗАКАЗОВ И ПОСТАВОК (ОТГРУЗОК) ВОЗВРАТОВ (ОТЗЫВОВ) ПРОДУКЦИИ ПРОТОКОЛЫ ДОКУМЕНТАЦИЯ
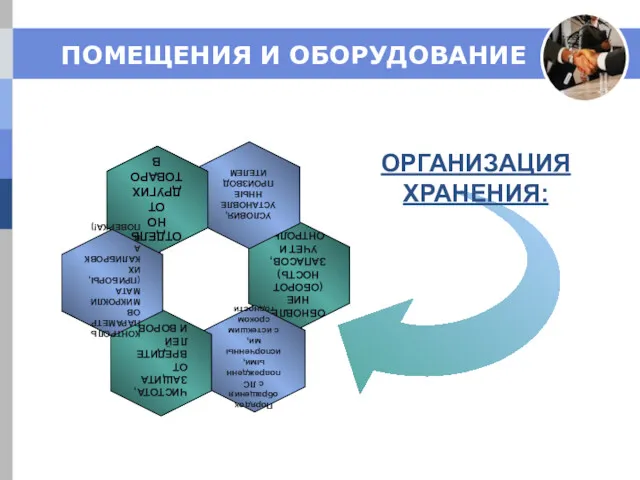
- 11. ПОМЕЩЕНИЯ И ОБОРУДОВАНИЕ Пригодны и соответствуют по размерам объемам хранящейся продукции. Получение: Защита от климатических явлений
- 12. ОРГАНИЗАЦИЯ ХРАНЕНИЯ: ПОМЕЩЕНИЯ И ОБОРУДОВАНИЕ
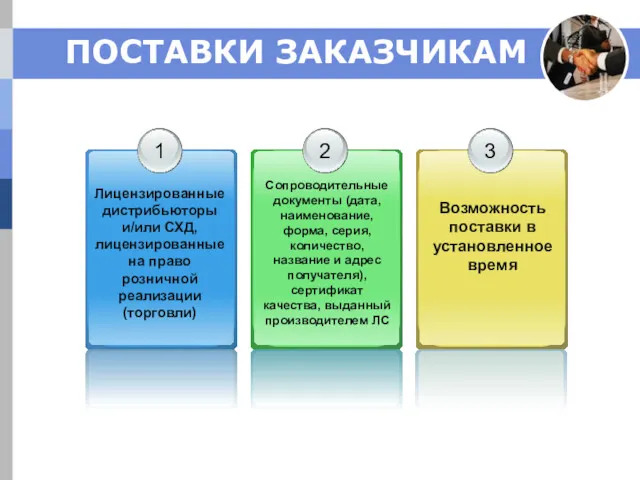
- 13. ПОСТАВКИ ЗАКАЗЧИКАМ
- 14. ПОСТАВКИ ЗАКАЗЧИКАМ ОБЩИЕ ПРАВИЛА ТРАНСПОРТИРОВАНИЯ: Не утрачена возможность идентификации Недопущение перекрестной контаминации Предупредительные меры от повреждений
- 15. ВОЗВРАТЫ ЛС, НЕ ИМЕЮЩИЕ ДЕФЕКТОВ Отдельное хранение (карантин) до момента получения разрешения на повторную реализацию Официальное
- 16. ЧТО ТАКОЕ «ОТЗЫВ»? ИЗЪЯТИЕ ИЗ ОБРАЩЕНИЯ (С РЫНКА) КОНКРЕТНОЙ ИЛИ ВСЕХ СЕРИЙ КОНКРЕТНОГО ПРЕПАРАТА
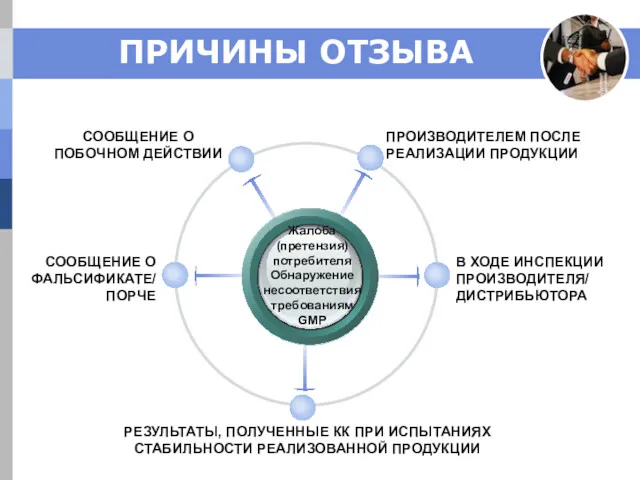
- 17. ПРИЧИНЫ ОТЗЫВА Жалоба (претензия) потребителя Обнаружение несоответствия требованиям GMP ПРОИЗВОДИТЕЛЕМ ПОСЛЕ РЕАЛИЗАЦИИ ПРОДУКЦИИ СООБЩЕНИЕ О ПОБОЧНОМ
- 18. ПРИНЦИП ОТЗЫВА У ПРОИЗВОДИТЕЛЯ / ДИСТРИБЬЮТОРА должна быть создана система быстрого и эффективного отзыва продукции из
- 19. ПЛАН ДЕЙСТВИЙ В КРИТИЧЕСКИХ СИТУАЦИЯХ (СРОЧНЫЙ ОТЗЫВ): Наличие письменного плана действий для срочных и плановых (несрочных)
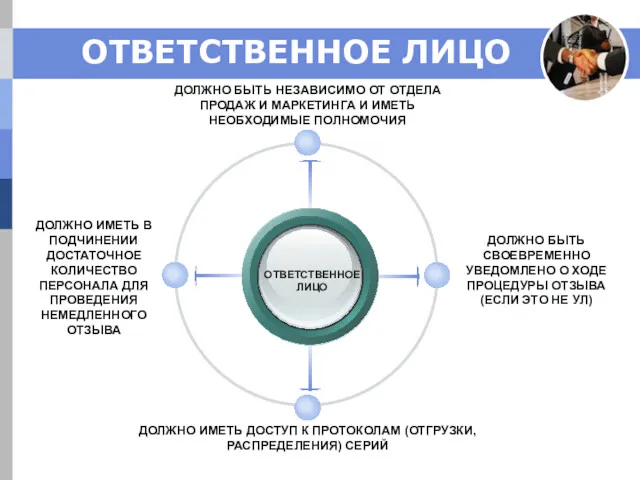
- 20. ОТВЕТСТВЕННОЕ ЛИЦО ОТВЕТСТВЕННОЕ ЛИЦО ДОЛЖНО БЫТЬ НЕЗАВИСИМО ОТ ОТДЕЛА ПРОДАЖ И МАРКЕТИНГА И ИМЕТЬ НЕОБХОДИМЫЕ ПОЛНОМОЧИЯ
- 21. ПРОТОКОЛ ОТЗЫВА В полном соответствии с СРМ с объяснением причин отклонений от нее Баланс количеств отгруженной
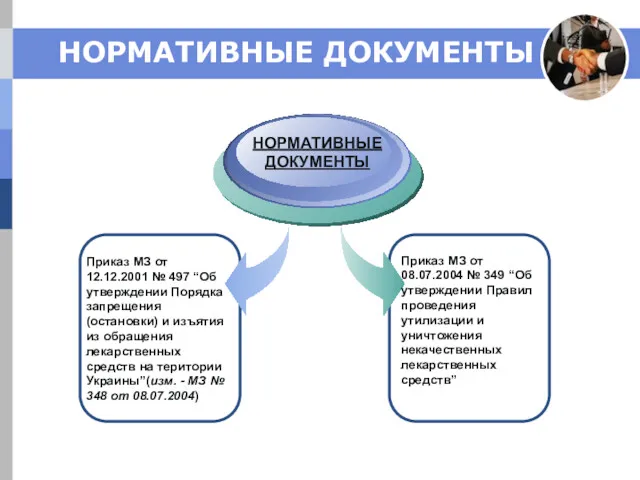
- 22. НОРМАТИВНЫЕ ДОКУМЕНТЫ Приказ МЗ от 12.12.2001 № 497 “Об утверждении Порядка запрещения (остановки) и изъятия из
- 23. САМОИНСПЕКЦИИ Самоконтроль Коррегирующие действия Совершенствование системы обеспечения качества дистрибьютора/производителя
- 24. СЕРТИФИКАЦИЯ дистрибьюторов на соответствие требованиям GDP в Украине Порядок проведения сертификации Утвержден приказом МЗ Украины от
- 25. КРИТЕРИИ СЕРТИФИКАЦИИ Соответствие материально-технической базы, технических средств и системы обеспечения качества ЛС в ходе дистрибьюции требованиям
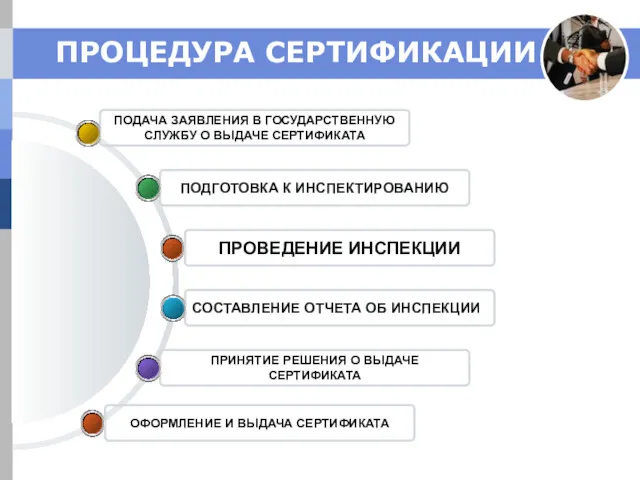
- 26. ПРОЦЕДУРА СЕРТИФИКАЦИИ ОФОРМЛЕНИЕ И ВЫДАЧА СЕРТИФИКАТА ПРИНЯТИЕ РЕШЕНИЯ О ВЫДАЧЕ СЕРТИФИКАТА СОСТАВЛЕНИЕ ОТЧЕТА ОБ ИНСПЕКЦИИ ПОДГОТОВКА
- 27. СЕРТИФИКАТ № Срок действия до ______________ Этот сертификат свидетельствует, что система обеспечения качества и техническое обеспечение
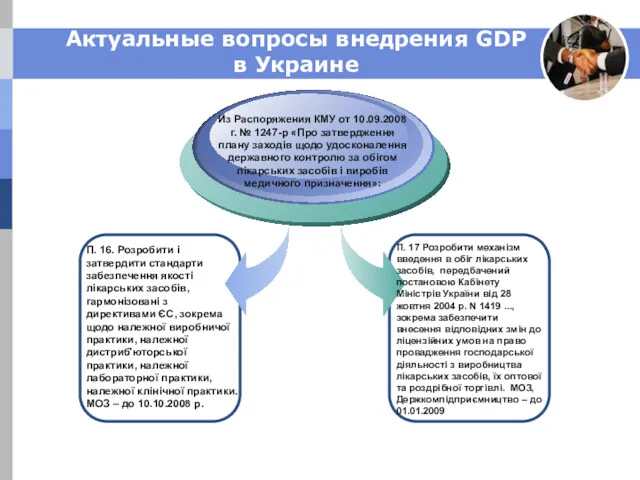
- 28. Актуальные вопросы внедрения GDP в Украине Из Распоряжения КМУ от 10.09.2008 г. № 1247-р «Про затвердження
- 30. Скачать презентацию















 Мастер от друга. Комплексное обслуживание компьютеров
Мастер от друга. Комплексное обслуживание компьютеров A global innovation company Indra
A global innovation company Indra Виртуальная АТС
Виртуальная АТС Стандарти мерчендайзингу
Стандарти мерчендайзингу Химические пилинги нового поколения
Химические пилинги нового поколения Маркетинговий проект. Об'єднання співвласників багатоквартирного будинку (ОСББ)
Маркетинговий проект. Об'єднання співвласників багатоквартирного будинку (ОСББ) Свадебное агенство Wedding House
Свадебное агенство Wedding House Маркетинговое исследование. Рынок сотовых телефонов
Маркетинговое исследование. Рынок сотовых телефонов Нейроисследования и Eye Tracking
Нейроисследования и Eye Tracking МегаФон – надежный партнер для вашего бизнеса. Виртуальная АТС
МегаФон – надежный партнер для вашего бизнеса. Виртуальная АТС Итальянские сумки из натуральной кожи. Бренд Vera Pelle
Итальянские сумки из натуральной кожи. Бренд Vera Pelle Аудит магазина ИП Неньков А.Н. на Wildberries
Аудит магазина ИП Неньков А.Н. на Wildberries АО Экспортная страховая компания KazakhExport
АО Экспортная страховая компания KazakhExport Шкафы-купе. 5 причин купить шкафы-купе
Шкафы-купе. 5 причин купить шкафы-купе Структура презентации - шаблон
Структура презентации - шаблон Линия DSD OPIUM (двойного действия)
Линия DSD OPIUM (двойного действия) Контент - маркетинговая стратегия
Контент - маркетинговая стратегия This is your presentatio N title
This is your presentatio N title Продвижение сайта в поисковике Яндекс из ТОП-100 в ТОП-3
Продвижение сайта в поисковике Яндекс из ТОП-100 в ТОП-3 Медиаисследования и медипланирование различных характеристик средств массовой информации
Медиаисследования и медипланирование различных характеристик средств массовой информации Типы информационных моделей формирования ТН. Информация о составе лекарственных средств
Типы информационных моделей формирования ТН. Информация о составе лекарственных средств Медиапланирование в издательстве. Анализ эффективности интернет-рекламы. Веб-аналитика
Медиапланирование в издательстве. Анализ эффективности интернет-рекламы. Веб-аналитика Унитазы
Унитазы Selfie Nails & beauty club - сеть салонов красоты
Selfie Nails & beauty club - сеть салонов красоты СТО Шик - авто. Кузовной ремонт легковых автомобилей
СТО Шик - авто. Кузовной ремонт легковых автомобилей Автомобильный техцентр
Автомобильный техцентр Новый набор компании NSP Ясная голова
Новый набор компании NSP Ясная голова Основы маркетинга. Сущность маркетинга
Основы маркетинга. Сущность маркетинга