Содержание
- 2. План: Введение 1. Получение 2. Физические свойства 3. Химические свойства и методы анализа 3.1. Стероидный цикл
- 3. Введение В 1563 году Бартоломео Евстахий, личный врач римского кардинала Делла Ровере, получивший благодаря своим связям
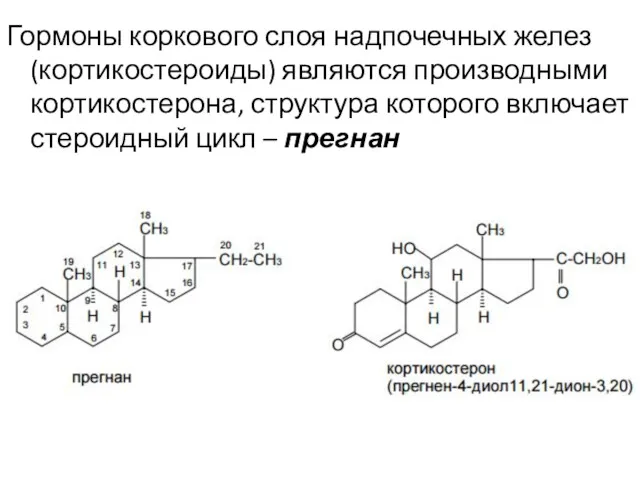
- 4. Гормоны коркового слоя надпочечных желез (кортикостероиды) являются производными кортикостерона, структура которого включает стероидный цикл – прегнан
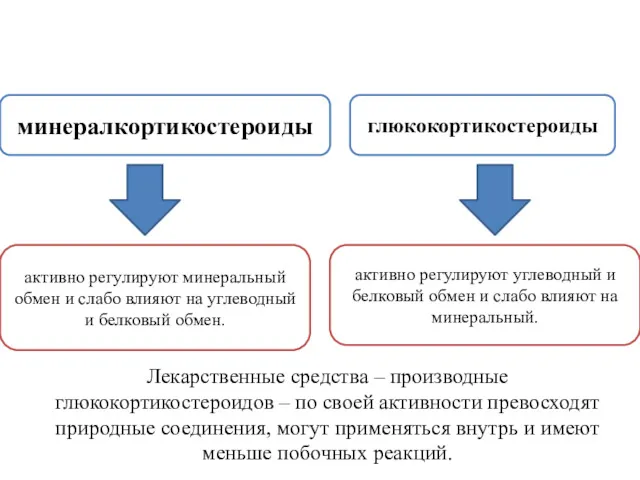
- 5. минералкортикостероиды глюкокортикостероиды активно регулируют углеводный и белковый обмен и слабо влияют на минеральный. активно регулируют минеральный
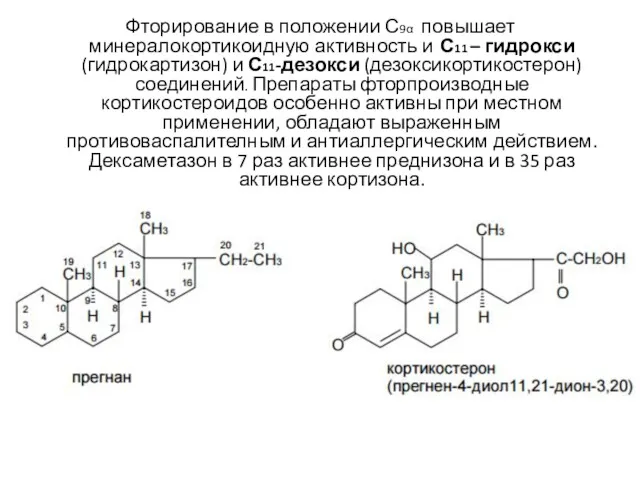
- 6. Фторирование в положении С9α повышает минералокортикоидную активность и С11 – гидрокси (гидрокартизон) и С11-дезокси (дезоксикортикостерон) соединений.
- 7. Получение: Кортизон был выделен в 1936 г. из коры надпочечников одновременно Кендаллом и Винтерштейнером в США
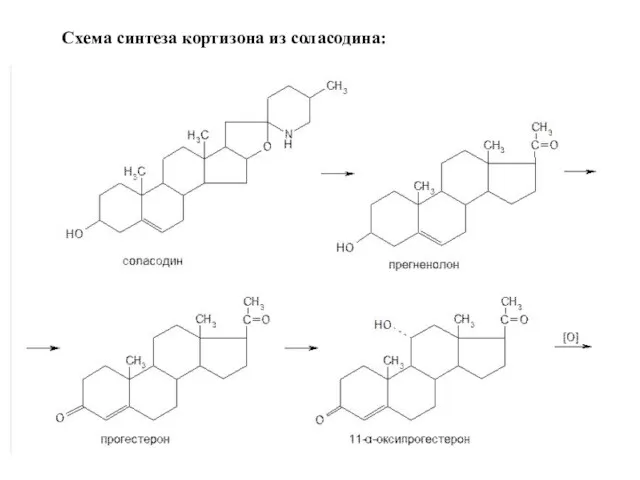
- 8. В 1956 г. Н. Н. Суворовым с сотр. (ВНИХФИ) была показана возможность использования соласодина — аглюкона
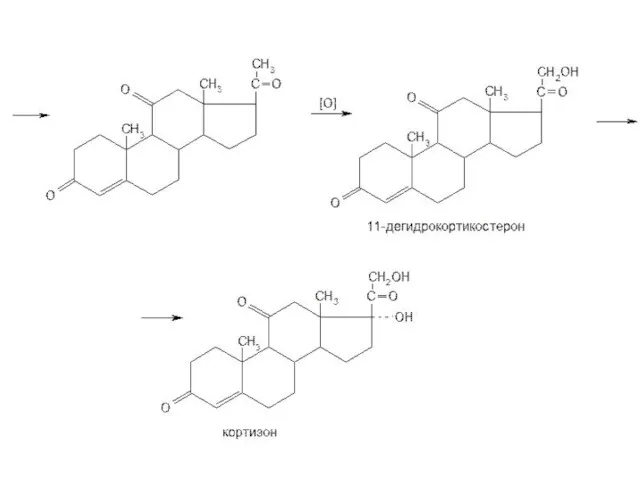
- 9. Схема синтеза кортизона из соласодина:
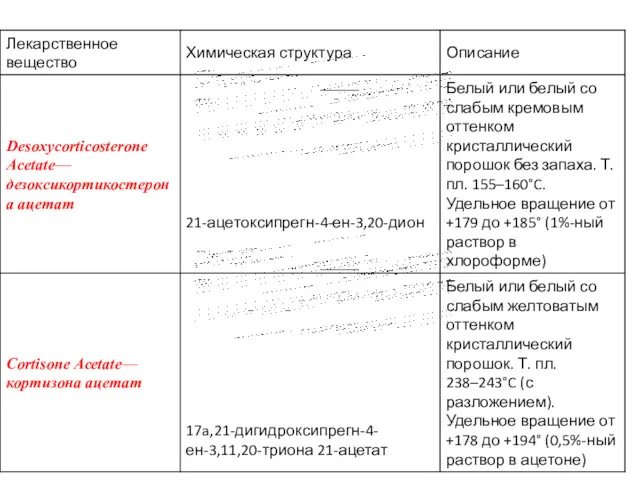
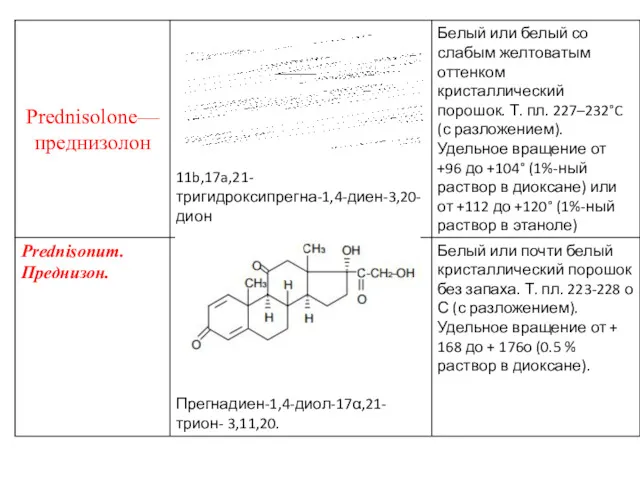
- 11. Физические свойства Препараты гормонов коры надпочечников и их синтетических аналогов представляют собой белые кристаллические вещества, имеющие
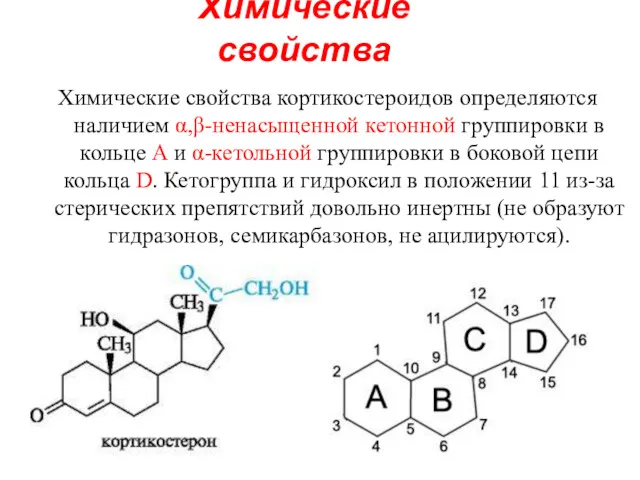
- 14. Химические свойства Химические свойства кортикостероидов определяются наличием α,β-ненасыщенной кетонной группировки в кольце А и α-кетольной группировки
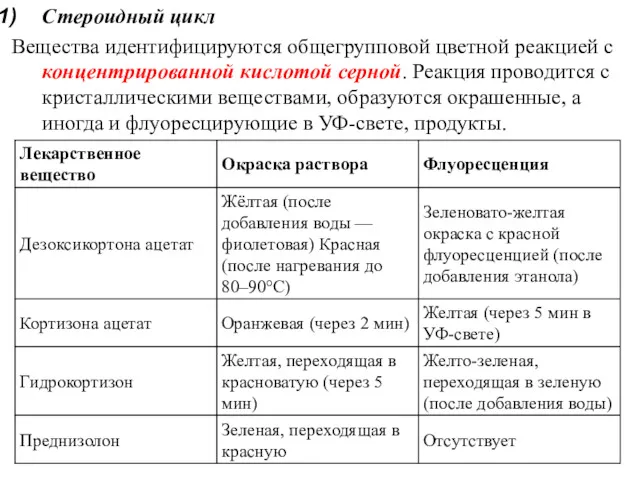
- 15. Стероидный цикл Вещества идентифицируются общегрупповой цветной реакцией с концентрированной кислотой серной. Реакция проводится с кристаллическими веществами,
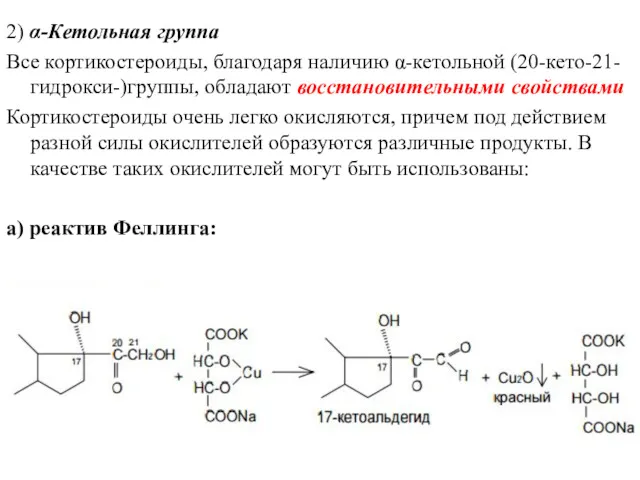
- 16. 2) α-Кетольная группа Все кортикостероиды, благодаря наличию α-кетольной (20-кето-21- гидрокси-)группы, обладают восстановительными свойствами Кортикостероиды очень легко
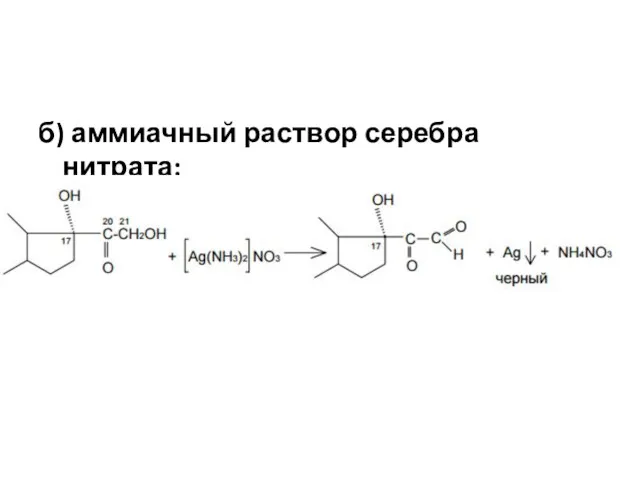
- 17. б) аммиачный раствор серебра нитрата:
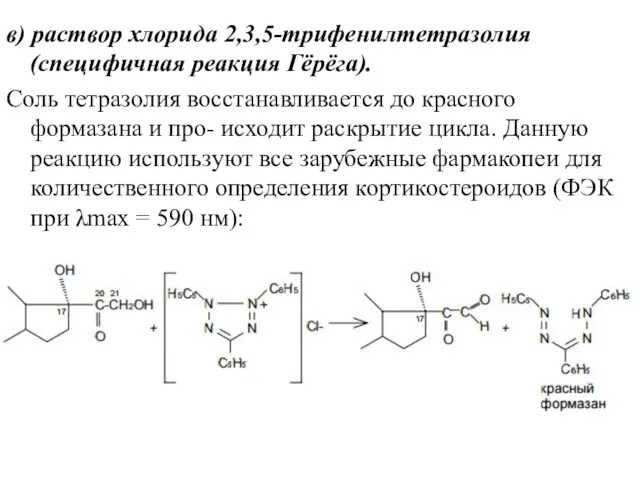
- 18. в) раствор хлорида 2,3,5-трифенилтетразолия (специфичная реакция Гёрёга). Соль тетразолия восстанавливается до красного формазана и про- исходит
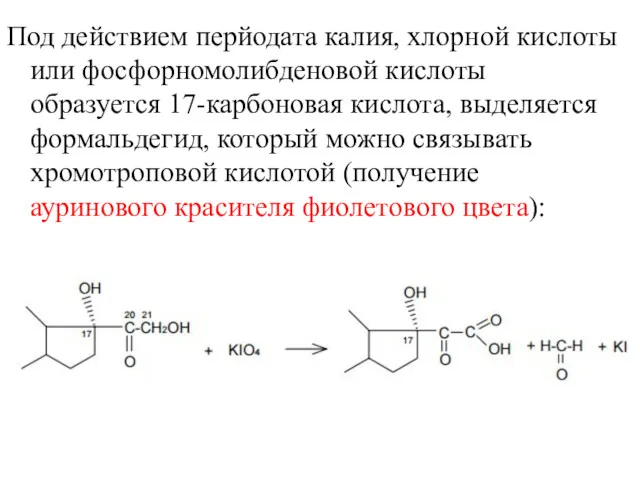
- 19. Под действием перйодата калия, хлорной кислоты или фосфорномолибденовой кислоты образуется 17-карбоновая кислота, выделяется формальдегид, который можно
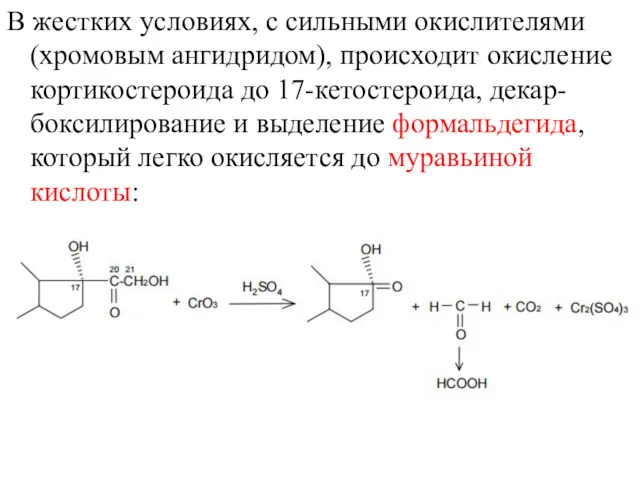
- 20. В жестких условиях, с сильными окислителями (хромовым ангидридом), происходит окисление кортикостероида до 17-кетостероида, декар-боксилирование и выделение
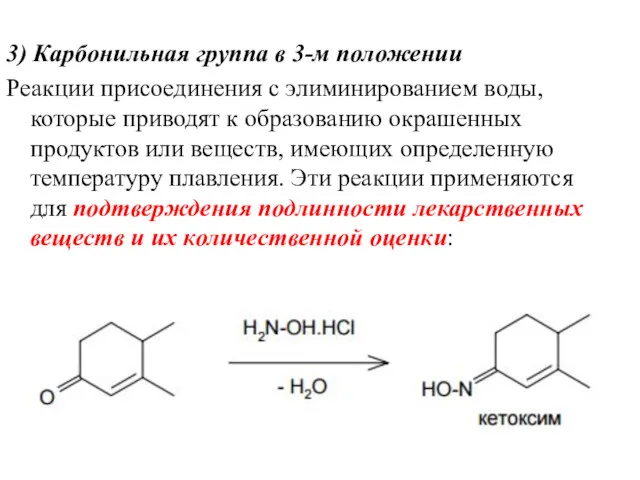
- 21. 3) Карбонильная группа в 3-м положении Реакции присоединения с элиминированием воды, которые приводят к образованию окрашенных
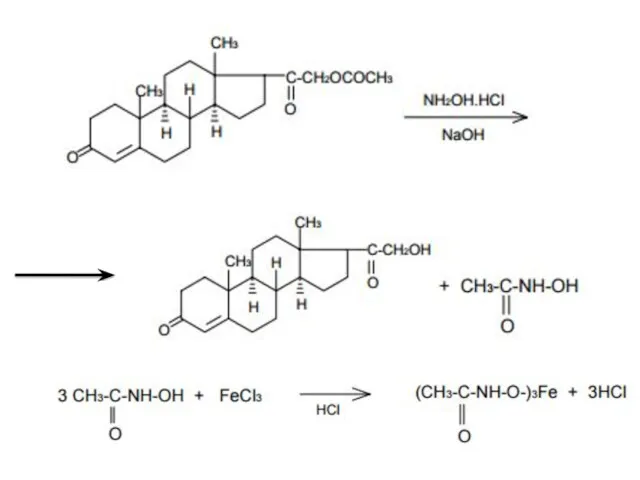
- 22. 4) Сложно-эфирная группа Для идентификации лекарственных средств, представляющих собой сложные эфиры, используется реакция получения ацетгидроксамовой кислоты
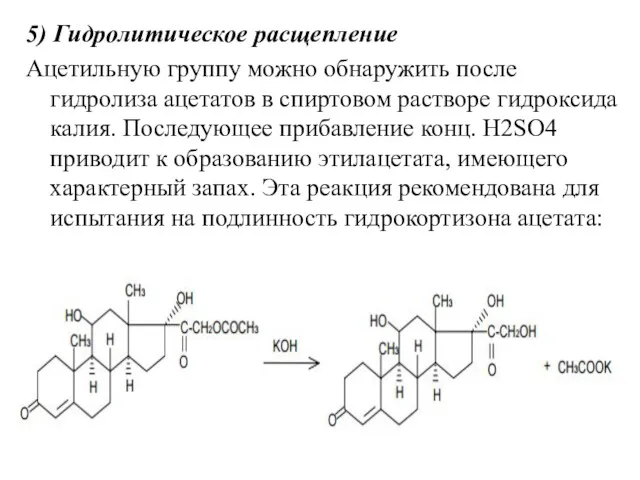
- 24. 5) Гидролитическое расщепление Ацетильную группу можно обнаружить после гидролиза ацетатов в спиртовом растворе гидроксида калия. Последующее
- 25. 6) Доказательство ковалентно-связанного фтора Во фторсодержащих лекарственных средствах (дексаметазоне и др.) фтор доказывается после минерализации (сжигание
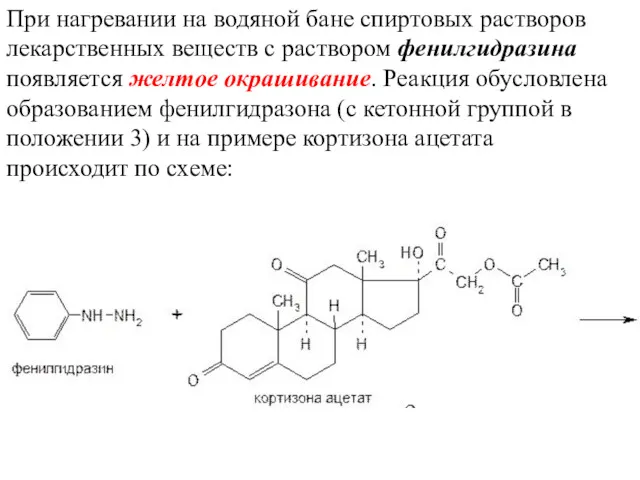
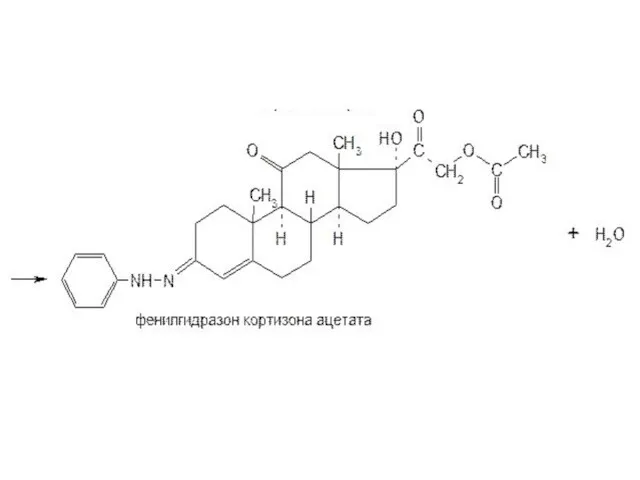
- 26. При нагревании на водяной бане спиртовых растворов лекарственных веществ с раствором фенилгидразина появляется желтое окрашивание. Реакция
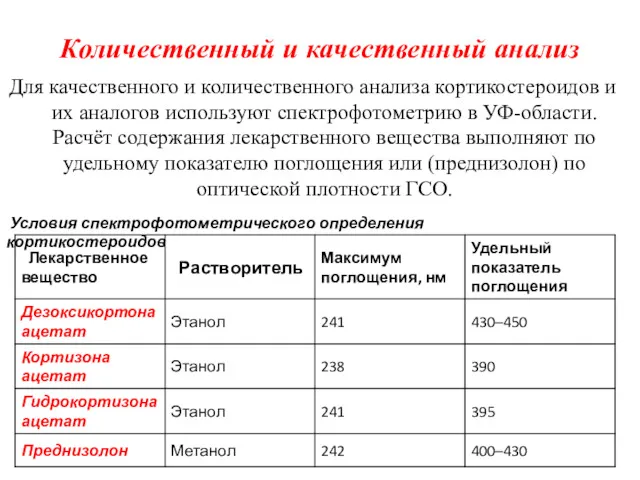
- 28. Количественный и качественный анализ Для качественного и количественного анализа кортикостероидов и их аналогов используют спектрофотометрию в
- 29. Чистота. Из примесных соединений во всех препаратах этой группы определяются посторонние стероиды. Используется ВЭЖХ или ТСХ.
- 30. Подлинность и Примеси: Для установления подлинности и проведения испытаний на посторонние примеси ФС рекомендована также ИК-спектроскопия
- 31. Методом ТСХ: на пластинках Силуфол УФ-254 или Сорбфил устанавливают во всех лекарственных веществах наличие примесей посторонних
- 32. Метод ВЭЖХ: Микроколоночную ВЭЖХ применяют для идентификации и испытаний на чистоту ряда кортикостероидов: дезоксикортона ацетата, кортизона
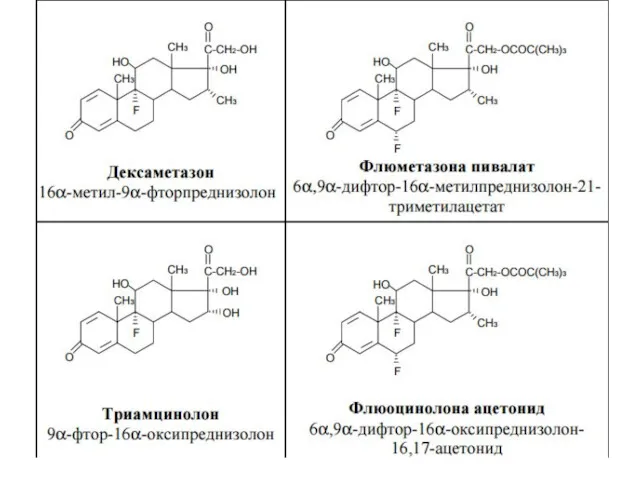
- 33. В результате исследования влияния галогенов, введенных в молекулу кортикостероидов, на их фармакологическую активность были синтезированы моно-
- 35. Фторпроизводные преднизолона Фторпроизводные преднизолона отличаются более активным противовоспалительным, антиаллергическим действием. Они высокоэффективны при местном применении. Дексаметазон
- 36. Введение атома фтора в положение 9a осуществляют действием фтороводорода, а образование двойной связи в положения 1-2
- 37. Заключение Кортикостероиды – это высокоэффективные лекарственные препараты, которые используются для лечения многих воспалительных и аллергических заболеваний.
- 39. Скачать презентацию















 Информатизация здравоохранения
Информатизация здравоохранения Мочекаменная болезнь
Мочекаменная болезнь Тригельм. Трехфазная антипаразитарная программа
Тригельм. Трехфазная антипаразитарная программа Хроническая почечная недостаточность (ХПН)
Хроническая почечная недостаточность (ХПН) Төтенше жағдайлардың психологиялық аспектілері.Әлеуметтік сипатты төтенше жағдайлар
Төтенше жағдайлардың психологиялық аспектілері.Әлеуметтік сипатты төтенше жағдайлар Здоровое питание. Что такое здоровое питание?
Здоровое питание. Что такое здоровое питание? Поверхностные явления. Адсорбция. (Лекция 1)
Поверхностные явления. Адсорбция. (Лекция 1) Эндокринная система человека. Гистология
Эндокринная система человека. Гистология Тіс жегі, ауыз қуысы гигиенасы нашар балаларды емдеуде ортодонттың іс-әрекеті
Тіс жегі, ауыз қуысы гигиенасы нашар балаларды емдеуде ортодонттың іс-әрекеті Первая медицинская помощь при массовых поражениях
Первая медицинская помощь при массовых поражениях Скажи наркотикам нет
Скажи наркотикам нет Группы риска, по возможности развития поствакцинальных осложнений. Роль медицинской сестры в школе
Группы риска, по возможности развития поствакцинальных осложнений. Роль медицинской сестры в школе Нейроэндокринные синдромы. Предменструальный синдром. Лекции № 26
Нейроэндокринные синдромы. Предменструальный синдром. Лекции № 26 Неотложные состояния в гинекологии
Неотложные состояния в гинекологии Геморрагиялық шок
Геморрагиялық шок Электрофизиологиялық сигналдарды өңдеу әдістері
Электрофизиологиялық сигналдарды өңдеу әдістері Экстрапирамидная система, синдромы поражения
Экстрапирамидная система, синдромы поражения Лабораторные информационные системы, их значение для клинической практики
Лабораторные информационные системы, их значение для клинической практики Классификация биологических и медицинских систем автоматизированного проектирования
Классификация биологических и медицинских систем автоматизированного проектирования Техника безопасности при фиксации животных для введения лекарственных веществ
Техника безопасности при фиксации животных для введения лекарственных веществ Зертханалық жануарларды экспериментальды жолмен жұқтыру
Зертханалық жануарларды экспериментальды жолмен жұқтыру Иммунодефициты
Иммунодефициты Schistosomiasis
Schistosomiasis Металлокерамика. Монолитная гипсовая модель
Металлокерамика. Монолитная гипсовая модель Kelun-Kazpharm ЖШС кәсіпорнында 100 мл контейнердегі инфузияға арналған 0,9 % натрий хлориді ерітіндісін өндіру
Kelun-Kazpharm ЖШС кәсіпорнында 100 мл контейнердегі инфузияға арналған 0,9 % натрий хлориді ерітіндісін өндіру Гормональные препараты аминокислотного и пептидного строения. Пероральные сахароснижающие препараты. Антитиреоидные средств
Гормональные препараты аминокислотного и пептидного строения. Пероральные сахароснижающие препараты. Антитиреоидные средств Эндоскопические методы диагностики в хирургии
Эндоскопические методы диагностики в хирургии Диафрагмальные грыжи
Диафрагмальные грыжи