Содержание
- 2. Понятие боли Боль - неприятное сенсорное и эмоциональное переживание, связанное с фактическим или потенциальным повреждением ткани
- 3. Виды болевого синдрома Острая боль - нормальная, предсказуемая физиологическая реакция на неблагоприятные химические, термические, механические повреждающие
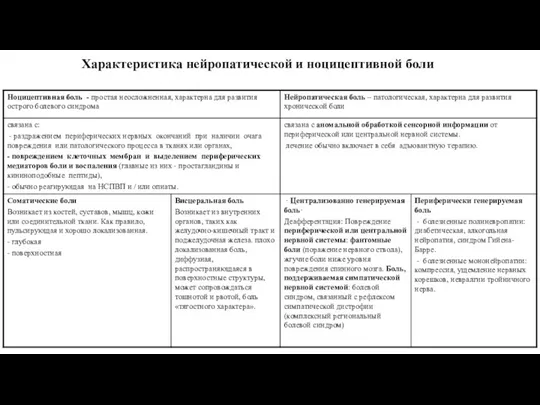
- 4. Характеристика нейропатической и ноцицептивной боли
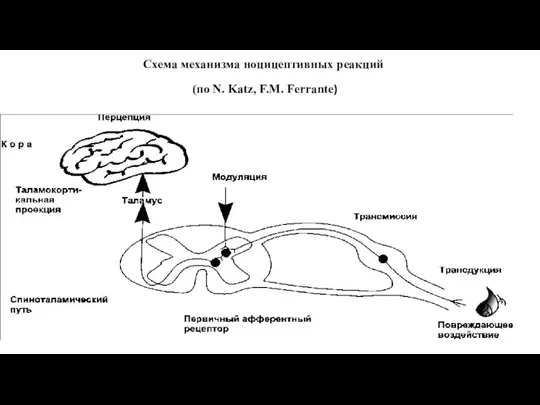
- 5. Схема механизма ноцицептивных реакций (по N. Katz, F.M. Ferrante)
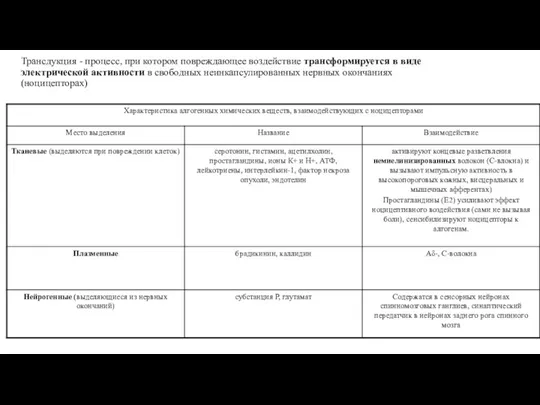
- 6. Трансдукция - процесс, при котором повреждающее воздействие трансформируется в виде электрической активности в свободных неинкапсулированных нервных
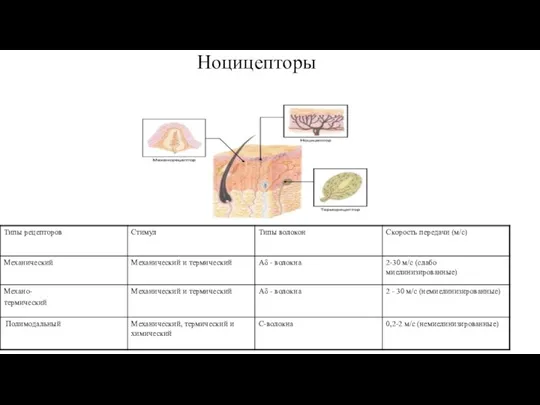
- 7. Ноцицепторы
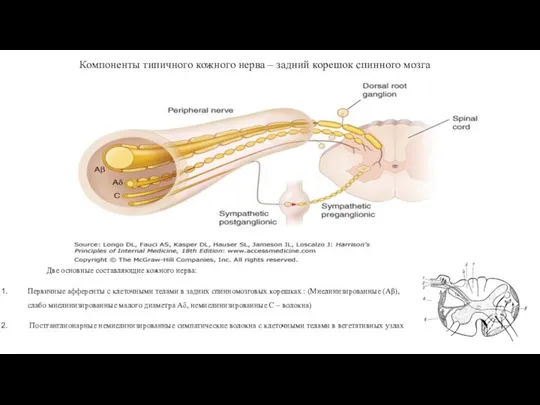
- 8. Компоненты типичного кожного нерва – задний корешок спинного мозга Две основные составляющие кожного нерва: Первичные афференты
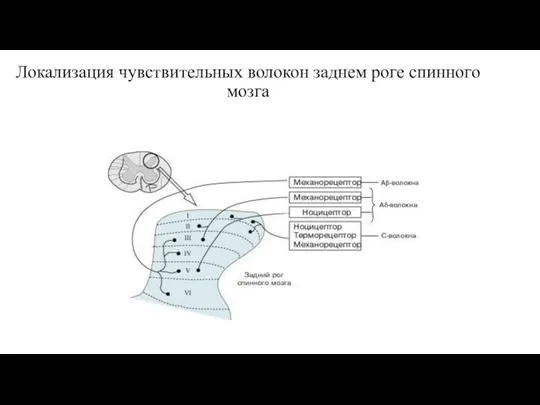
- 9. Локализация чувствительных волокон заднем роге спинного мозга
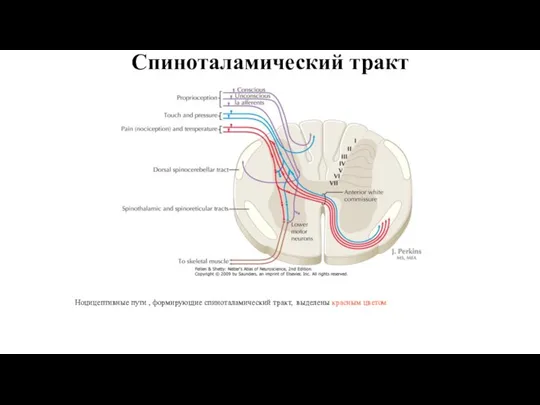
- 10. Спиноталамический тракт Ноцицептивные пути , формирующие спиноталамический тракт, выделены красным цветом
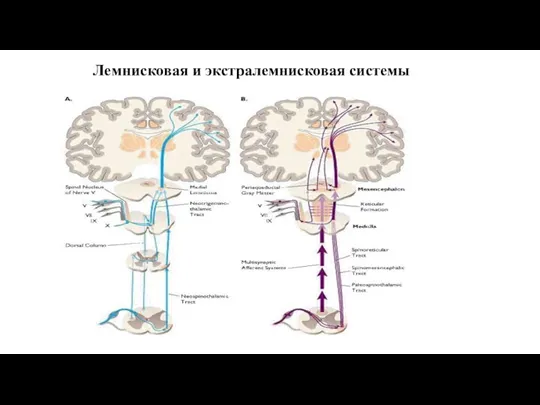
- 11. Лемнисковая и экстралемнисковая системы
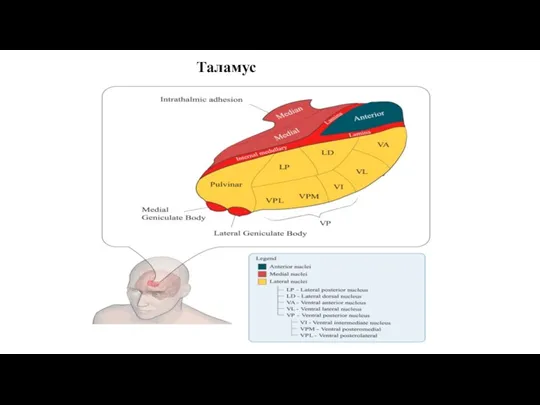
- 12. Таламус
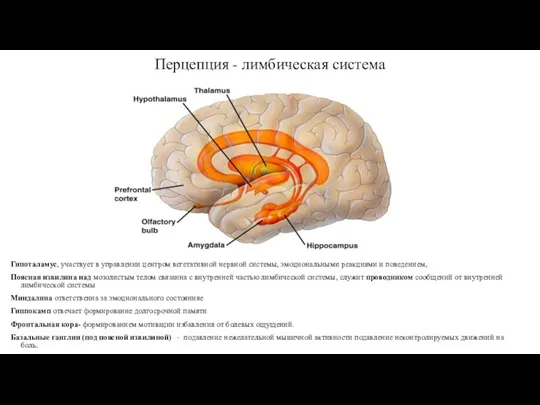
- 13. Перцепция - лимбическая система Гипоталамус, участвует в управлении центром вегетативной нервной системы, эмоциональными реакциями и поведением,
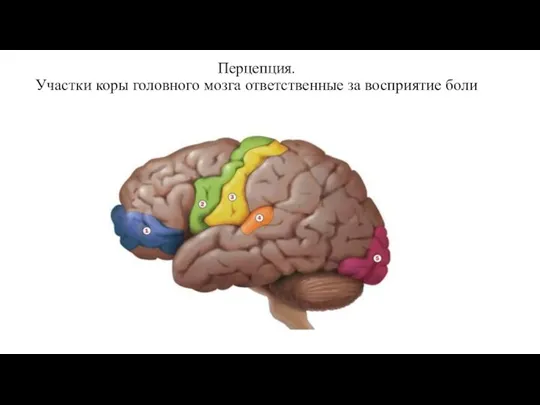
- 14. Перцепция. Участки коры головного мозга ответственные за восприятие боли
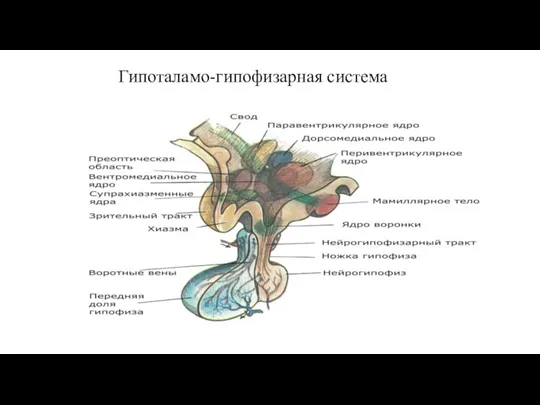
- 15. Гипоталамо-гипофизарная система
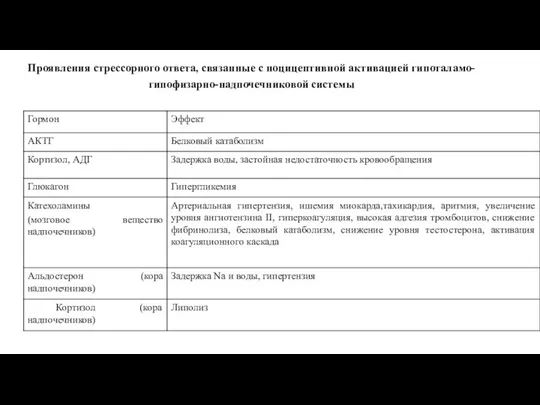
- 16. Проявления стрессорного ответа, связанные с ноцицептивной активацией гипоталамо-гипофизарно-надпочечниковой системы
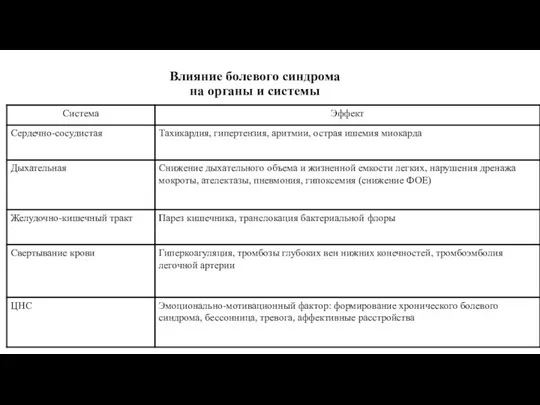
- 17. Bлияние болевого синдрома на органы и системы
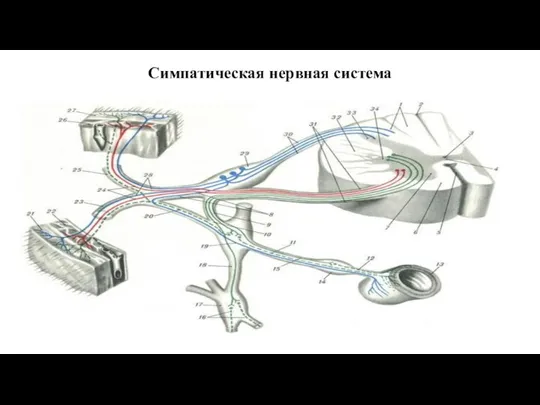
- 18. Симпатическая нервная система
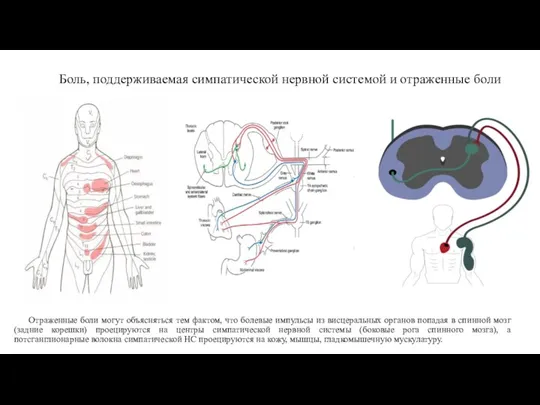
- 19. Боль, поддерживаемая симпатической нервной системой и отраженные боли Отраженные боли могут объясняться тем фактом, что болевые
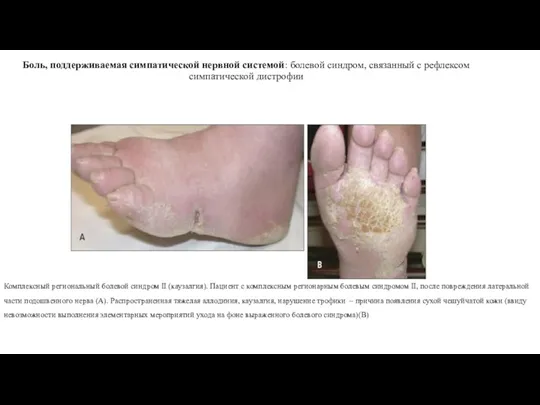
- 20. Боль, поддерживаемая симпатической нервной системой: болевой синдром, связанный с рефлексом симпатической дистрофии Комплексный региональный болевой синдром
- 21. Патофизиологические механизмы формирования острого и хронического болевого синдрома Патофизиологической основой формирования болевого синдрома является развитие феномена
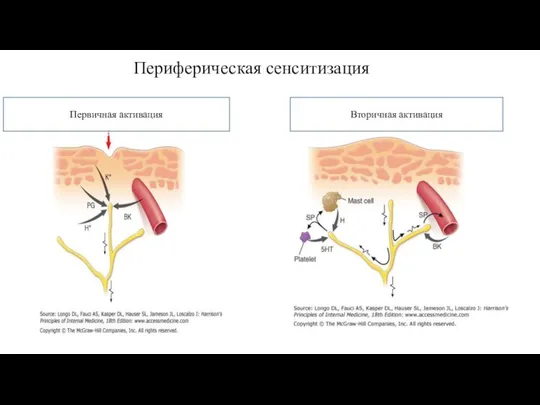
- 22. Периферическая сенситизация Первичная активация Вторичная активация
- 23. Периферическая сенситизация - механическое, химическое, термическое повреждающее воздействие; - высвобождение PGE2и других БАВ; - снижение порога
- 24. Центральная сенситизация Изменение возбуждения нейронов задних рогов спинного мозга Результат длительного ноцицептивного воздействия Извращенное восприятие неноцицептивных
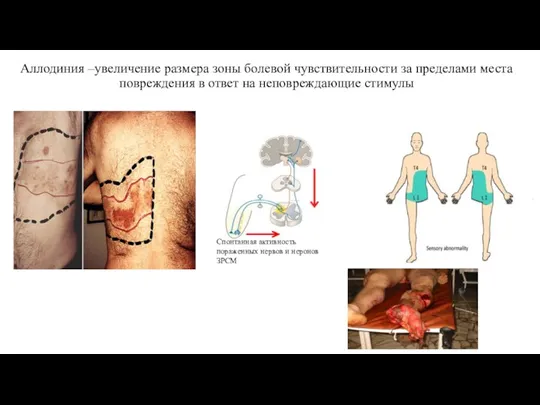
- 25. Аллодиния –увеличение размера зоны болевой чувствительности за пределами места повреждения в ответ на неповреждающие стимулы Спонтанная
- 26. Аллодиния Болезненные ощущения на неповреждающие стимулы Следствие избыточной активации NMDA-рецепторов в ЦНС В формировании аллодини играют
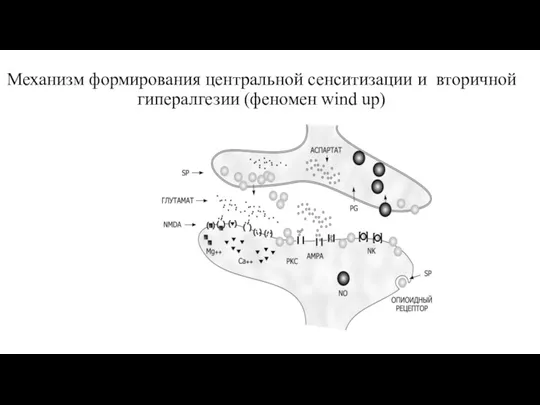
- 27. Механизм формирования центральной сенситизации и вторичной гипералгезии (феномен wind up)
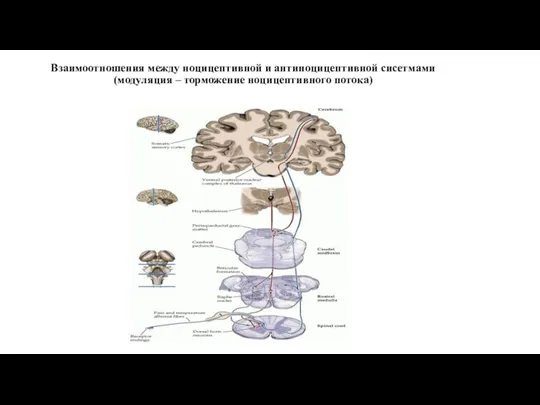
- 28. Взаимоотношения между ноцицептивной и антиноцицептивной сисетмами (модуляция – торможение ноцицептивного потока)
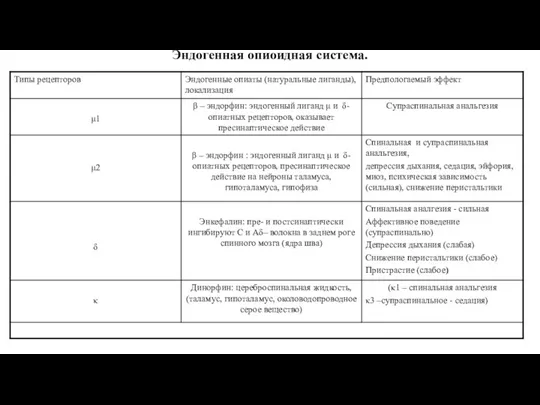
- 29. Эндогенная опиоидная система.
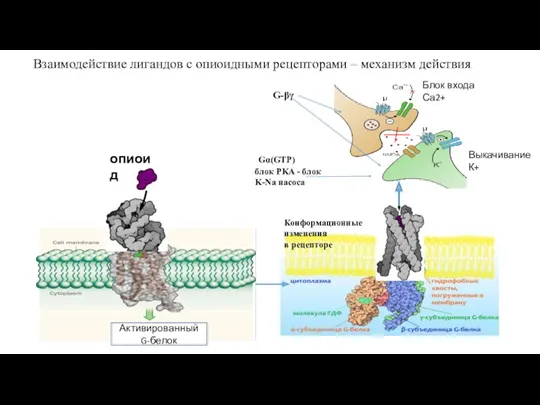
- 30. Взаимодействие лигандов с опиоидными рецепторами – механизм действия опиоид G-βγ Gα(GTP) блок PKA - блок K-Na
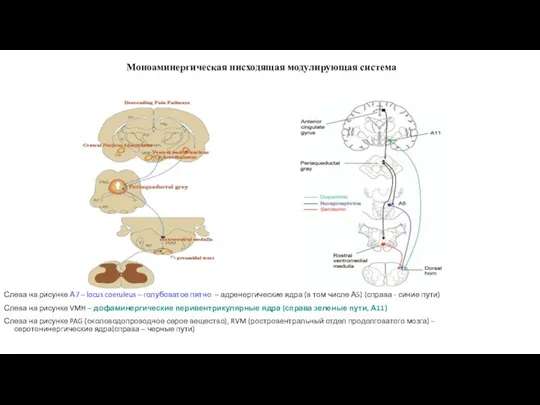
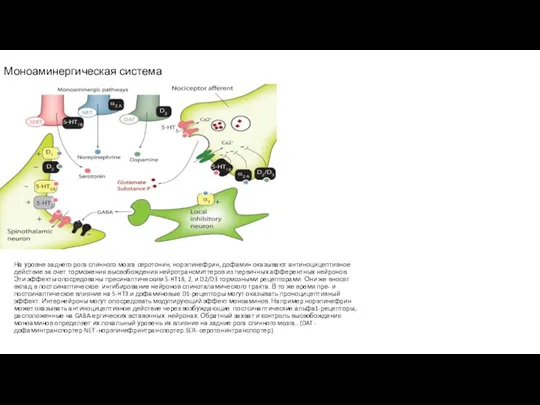
- 31. Моноаминергическая нисходящая модулирующая система Слева на рисунке А7 – locus coeruleus – голубоватое пятно – адренергические
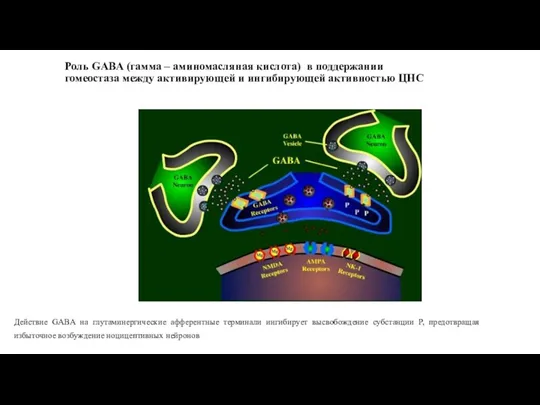
- 32. Роль GABA (гамма – аминомасляная кислота) в поддержании гомеостаза между активирующей и ингибирующей активностью ЦНС Действие
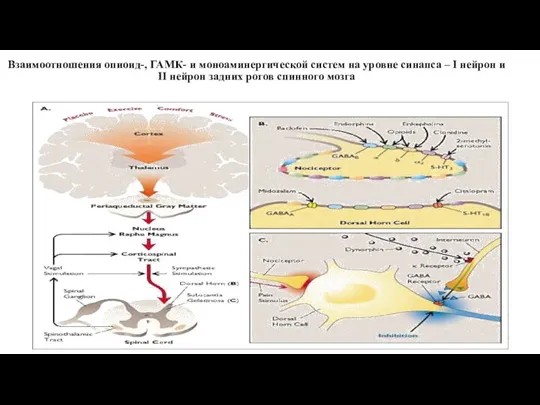
- 33. Взаимоотношения опиоид-, ГАМК- и моноаминергической систем на уровне синапса – I нейрон и II нейрон задних
- 34. Роль опиоидергической и моноаминергической систем в модуляции боли 1. При острой ноцицептивной боли модуляция в большей
- 35. Часть вторая Клинико-фармакологическая характеристика препаратов, наиболее широко применяемых для купирования острого болевого синдрома.
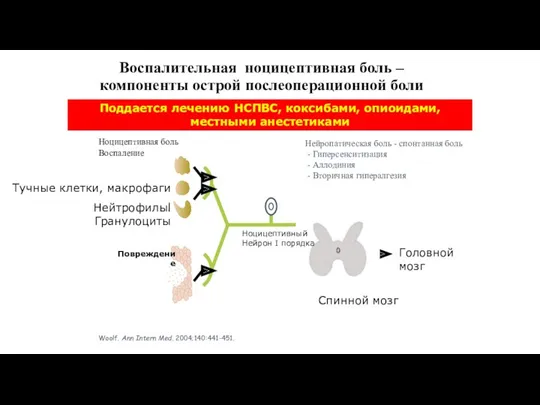
- 36. Воспалительная ноцицептивная боль – компоненты острой послеоперационной боли Woolf. Ann Intern Med. 2004;140:441-451. Поддается лечению НСПВС,
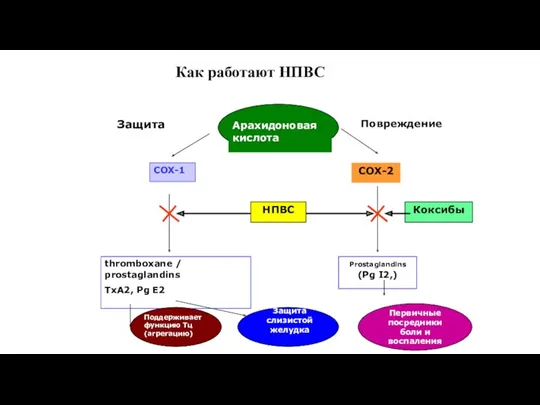
- 37. Нестероидные противовоспалительные средства НПВС оказывают свое влияние на периферическом (тканевом) уровне через подавление синтеза циклооксигеназы 2
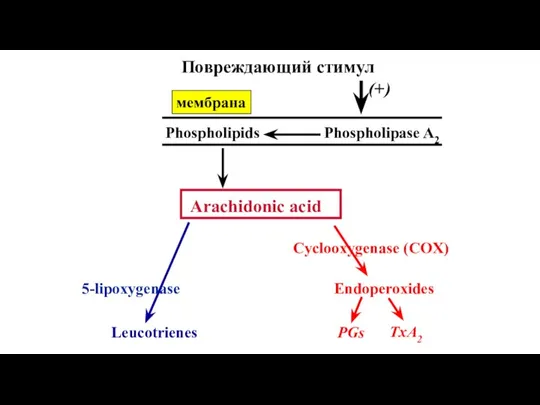
- 38. (+) Phospholipase A2 Phospholipids Arachidonic acid 5-lipoxygenase Leucotrienes Cyclooxygenase (COX) Endoperoxides PGs TxA2 Повреждающий стимул мембрана
- 39. Циклооксигеназа (СОХ) COX-1 (защитное действие) работает в физиологических условиях - TxA2 - агрегация тромбоцитов, вазоконстрикция -
- 40. Как работают НПВС
- 41. Побочные эффекты неселективных НПВС
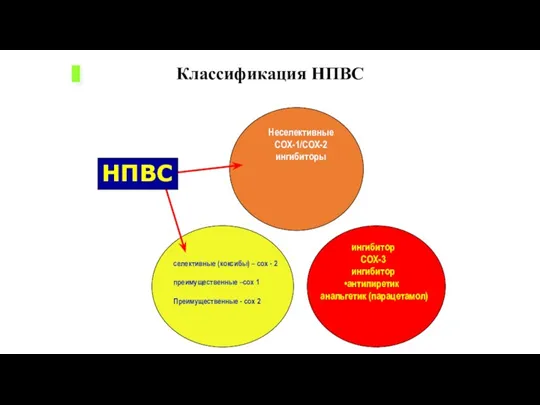
- 42. селективные (коксибы) – cox - 2 преимущественные –cox 1 Преимущественные - cox 2 ингибитор COX-3 ингибитор
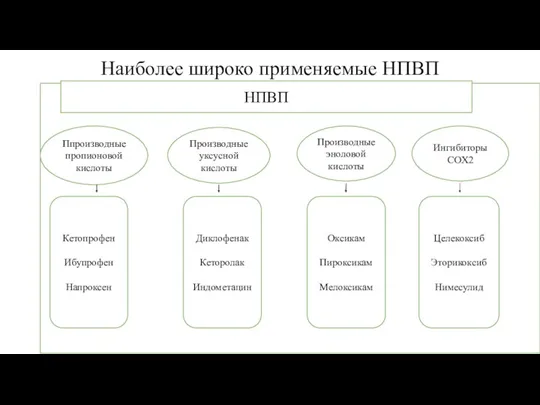
- 43. Наиболее широко применяемые НПВП Ппроизводные пропионовой кислоты Производные уксусной кислоты Производные эноловой кислоты Ингибиторы COX2 Диклофенак
- 44. Классификация НПВС по селективности в отношении различных форм циклооксигеназы
- 45. Показания к применению и способы применения НПВП и коксибов Внутримышечно, внутривенно и перорально: острая послеоперационная боль;
- 46. COX-2 ингибиторы (1) Селективные COX-2 ингибиторы (Coxibs) Celecoxib Etoricoxib Parecoxib (2) преимущественные COX-2 ингибиторы Meloxicam Nimesulide
- 47. Коксибы Коксибы – селективные COX-2 ингибиторы, оказывают противовоспалительное, анальгетическое, антипиретическое действие, могут вызывать бесплодие, обладают высоким
- 48. Эффективность и побочные эффекты НПВП и коксибов при периоперационном применении Коксибы не угнетают функцию тромбоцитов -
- 49. Анальгин – производное пиразолона (метамизол)
- 50. Оксикамы Лорнрксикам Период полувыведения 3-5 ч, отсутствие кумуляции, снижает риск передозировки и повышает безопасность применения Мощный
- 51. Парацетамол – механизм действия Оказывает центральное действие Селективно ингибирует синтез PG в ЦНС через COX-3 Метаболизируется
- 52. Безопасность парацетамола и методика применения Первое применение в операционной, Скорость и интервал инфузии– 1 г в
- 53. Принципы применения НПВП Каждый класс НПВП обладает уникальными эффективностью и побочными эффектами. Низкая эффективность одного из
- 54. Кортикостероиды Редуцирует болевой синдром разными путями Противовоспалительное действие Уменьшает компрессию нервов Ингибирует спонтанное открытие Na+ каналов
- 55. Опиаты и опиоиды: терминология и классификация Опиаты –производные опиумного мака - Натуральные опиумные алкалоиды: Морфин и
- 56. Классификация опиоидов по химической структуре I. Производные опия (опиаты): - морфин - кодеин - омнопон II.
- 57. Эффекты опиоидов при стимуляции различных типов рецепторов
- 58. Побочные эффекты Толерантность - связана с «привыканием» рецепторов к применяемой дозе опиоида и снижением аналгетического эффекта
- 59. Классификация опиоидов по характеру взаимодействия опиоидов с μ-, κ-, δ-, σ- опиоидными анальгетиками Полные агонисты -
- 60. - Наибольшую афинность проявляет к μ-рецепторам (μ> δ = κ) Стандарт лечения - Плохая биодоступность (30%)
- 61. Фармакологические эффекты μ агонистов ЦНС 1. У лиц с болевым синдромом - Аналгезия, седация и анксиолизис
- 62. Типичные побочные эффекты μ-агонистов (на примере морфина) ЦНС Апатия: Сонливость вялость Когнитивные расстройства: нарушения памяти, неспособность
- 63. Меперидин - промедол 1. Атропиноподобный эффект : тахикардия, сухость слизистых, спазмолитик 2. Стимулирует миометрий 3. Метабоизируется
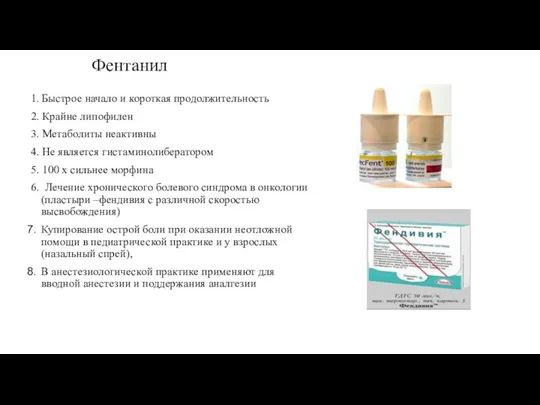
- 64. Фентанил 1. Быстрое начало и короткая продолжительность 2. Крайне липофилен 3. Метаболиты неактивны 4. Не является
- 65. Омнопон Полусинтетическое производное опиумного мака Смесь алкалоидов опиума В структутре содержит 48 -50% морфина Cодержит папаверин,
- 66. Трамадол Синтетический опиоид средней аналгетической силы (0,15 от потенциала морфина) Слабый агонист μ – рецепторов –
- 67. Бупренорфин – частичный агонист μ – рецепторов Высокая липофильность, аффинитет, связывание с μ-рецепторами В 30-40 раз
- 68. Агонисты κ- σ-, антагонисты μ-рецепторов - Агонисты κ- или σ-рецепторов - Антагонисты μ-рецепторов - Применяются при
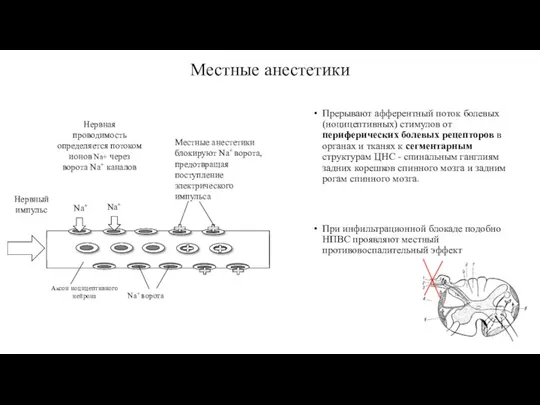
- 69. Местные анестетики Прерывают афферентный поток болевых (ноцицептивных) стимулов от периферических болевых рецепторов в органах и тканях
- 70. Дозировки и способы введения наиболее широко применяемых местных анестетиков
- 71. Побочные эффекты местных анестетиков Связаны с проявлением системной токсичности при непреднамеренном попадание в кровоток токсической дозы
- 72. Показания к применению местных анестетиков Абдоминальная хирургия - эпидуральное обезболивание , местная анестезия -операции на органах
- 73. Группы препаратов (адьювантов) для лечения нейропатической боли
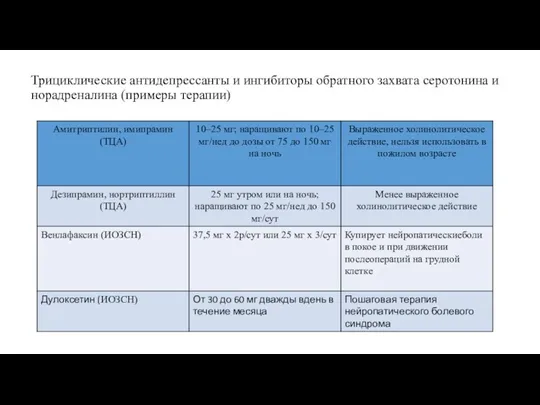
- 74. Трициклические антидепрессанты и ингибиторы обратного захвата серотонина и норадреналина (примеры терапии)
- 75. Антиконвульсанты (противоэпилептические препараты) стабилизация нейрональных мембран за счет снижения активности Na+, Ca2+ каналов; активизация ГАМК-системы; ингибирование
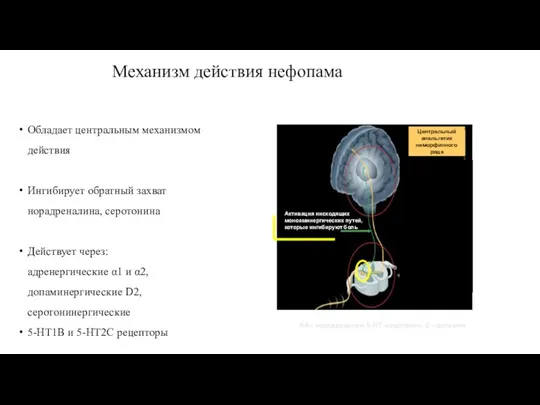
- 76. Механизм действия нефопама Обладает центральным механизмом действия Ингибирует обратный захват норадреналина, серотонина Действует через: адренергические α1
- 77. Акупан - методика применения и показания Внутримышечное введение: глубоко – 20 мг/инъекция. При необходимости введение повторяют
- 78. Противопоказания, взаимодействия и побочные эффекты Противопоказания Гиперчувствительность Дети младше 12 лет, из-за отсутствия клинических исследований Судороги
- 79. Клофелин Центральный α2-агонист адренорецепторов; Модулирующее действие на уровне ЗРСМ; Не используется в качестве моноанальгетика; Наиболее ценным
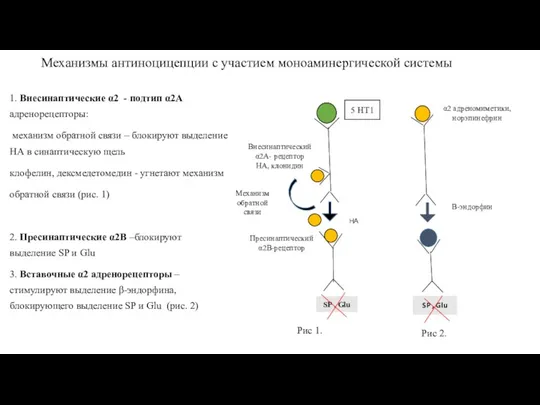
- 80. Механизмы антиноцицепции с участием моноаминергической системы 1. Внесинаптические α2 - подтип α2A адренорецепторы: механизм обратной связи
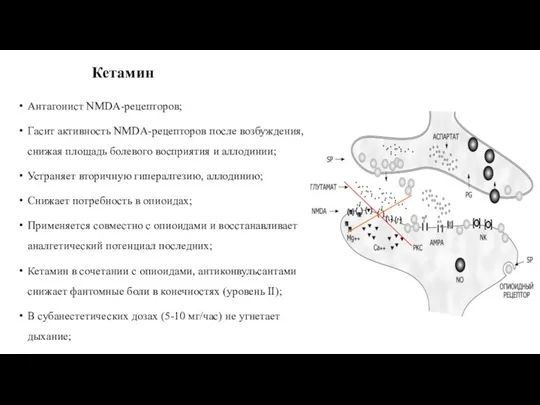
- 81. Кетамин Антагонист NMDA-рецепторов; Гасит активность NMDA-рецепторов после возбуждения, снижая площадь болевого восприятия и аллодинии; Устраняет вторичную
- 82. Кетамин и лидокаин в лечении нейропатической боли Внутривенное введение лидокаина (0,5 – 1 мг/кг/час) и кетамина
- 83. Магний Магний считается антагонистом NMDA-рецепторов, но также обладает противовоспалительным действием. Эффекты связаны со снижением уровней IL-6
- 84. Другие адьюванты Центральные миорелаксанты - тизанидин (сирдалуд - агонист α2 – адренорецепторов), баклофен(активатор ГАМК-системы), мидокалм (блокатор
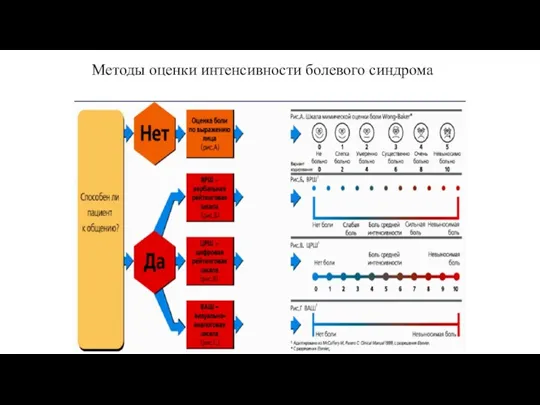
- 85. Методы оценки интенсивности болевого синдрома
- 86. Оценка интенсивности острого болевого синдрома Отрезок длинною 100 мм - ЦРШ (цифровая рейтинговая шкала) - 0-5
- 87. Пошаговая терапия болевого синдрома Слабый БС (44% или 44 мм) - НСПВП + парацетамол Умеренный БС
- 88. Купирование острого болевого синдрома – Лестница ВОЗ Опиоидные анальгетики для лечения умеренной боли (ВАШ 40-70%) Трамадол
- 89. Критерии эффективности купирования острого болевого синдрома Снижение боли на 30 – 35% (30-35 мм по ЦРШ)
- 90. Основные принципы фармакотерапии болевого синдрома
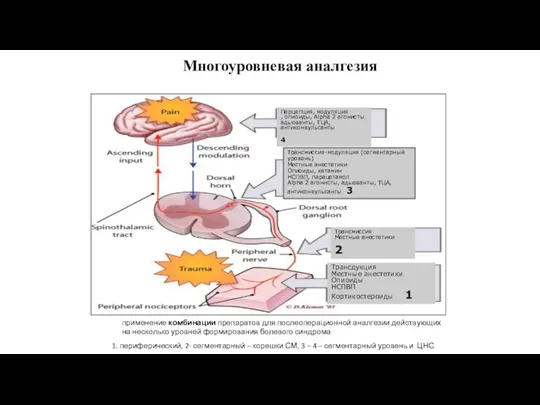
- 91. Многоуровневая аналгезия применение комбинации препаратов для послеоперационной аналгезии действующих на несколько уровней формирования болевого синдрома 1.
- 92. Преимущества и методы упреждающей аналгезии Сводит к минимуму вероятность развития хронической боли Боль становится легче предотвратить,
- 93. Потребность в адекватном обезболивании после различных операций
- 94. Заключение Общим принципом послеоперационного обезболивания следует считать применение сбалансированной аналгезии Соблюдение принципа упреждающей и превентивной аналгезии
- 95. Заключение
- 96. Заключение
- 97. Эйкозаноиды – продукты арахидоновой кислоты PGI2 (prostacyclin) (синтезируется COX2) : - Воспаление, эксудация,вазодилатация, - Сенситизация ноцицепторов
- 98. Схема хода волокон поверхностной чувствительности (боль, температура, частично тактильные ощущения (по М. М. Одинаку): 1 -
- 99. Характеристика лемнисковой и экстралемнисковой системы Лемнисковая 1. Латеральный спинно-таламический тракт - специфический, проводящий точную и быструю
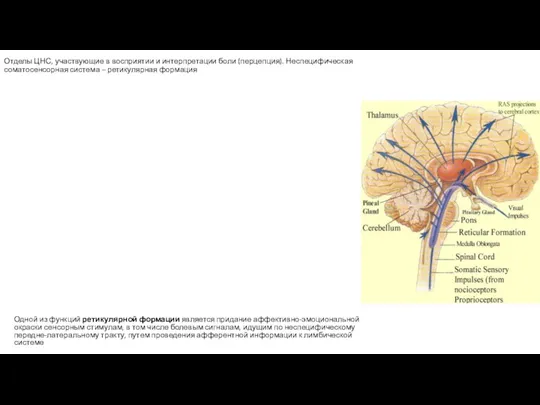
- 100. Отделы ЦНС, участвующие в восприятии и интерпретации боли (перцепция). Неспецифическая соматосенсорная система – ретикулярная формация Одной
- 101. Моноаминергическая нисходящая модулирующая система Серотонинергическая система:передняя поясная извилина - околоводопроводное серое вещество (каудальный отдел среднего мозга)
- 102. Моноаминергическая система На уровне заднего рога спинного мозга серотонин, норэпинефрин, дофамин оказывают антиноцицептивное действие за счет
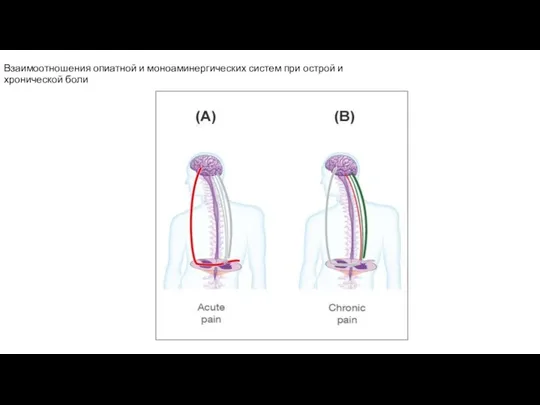
- 103. Взаимоотношения опиатной и моноаминергических систем при острой и хронической боли
- 104. Роль GABA (гамма-аминомасляная кислота ) в поддержании гомеостаза между активирующей и ингибирующей активностью ЦНС Действие GABA
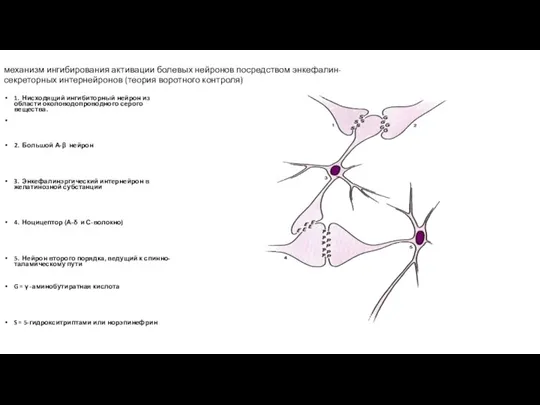
- 105. механизм ингибирования активации болевых нейронов посредством энкефалин-секреторных интернейронов (теория воротного контроля) 1. Нисходящий ингибиторный нейрон из
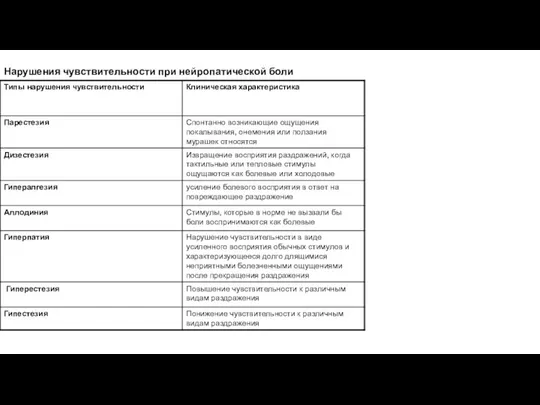
- 106. Нарушения чувствительности при нейропатической боли
- 107. Положительные эффекты неселективных НПВС, связанные с ингибированием синтеза ПГ 1. Аналгезия. Предупреждает сенситизацию нервных окончаний 2.
- 108. Способ применения и дозы диклофенака В составе премедикации перед операцией:50–75 мг внутримышечно или 50 мг в
- 109. Способы введения и дозы кетопрофена Максимальная суточная доза - 300 мг Применяется парентерально (внутримышечно, внутривенно) и
- 110. Оксикамы Лорнрксикам Период полувыведения 3-5 ч, отсутствие кумуляции, снижает риск передозировки и повышает безопасность применения Мощный
- 111. Показания к применению, способы введения и дозы лорноксикама Per os или внутримышечно: 24-32 мг в первые
- 112. Кеторолак трометамин
- 113. Парацетамол – механизм действия Оказывает центральное действие Селективно ингибирует синтез PG в ЦНС через COX-3 Метаболизируется
- 114. Взаимодействие опиатов с опиоидными рецепторами Опиоиды являются агонистами, частичными агонистами или конкурентными антагонистами главным образом 3-х
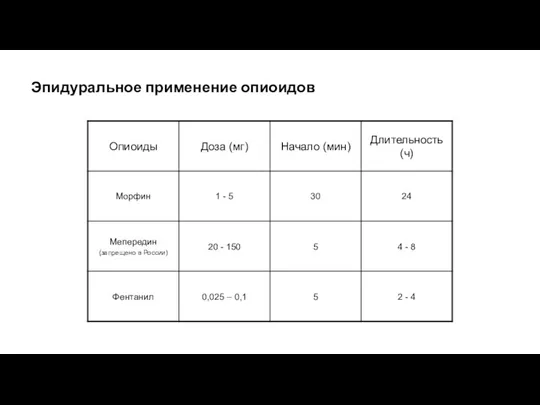
- 115. Эпидуральное применение опиоидов
- 116. Бупренорфин – частичный агонист μ-рецепторов Высокая липофильность, аффинитет, связывание с μ-рецепторами В 30-40 раз сильнее морфина
- 117. Местные анестетики Обеспечивают адекватную аналгезию за счет блокады афферентной и эфферентной импульсации. Прерывают афферентный поток ноцицептивных
- 118. Основные характеристики МА Мощность зависит от их способности растворяться в жирах: Жирорастворимость: Лидокаин - 2,9 Ропивакаин
- 119. Основные характеристики МА Скорость наступления эффекта - определяется рК (рН препарата). Чем выше рК анестетика, тем
- 120. Основные характеристики МА Длительность действия - определяется способностью препарата связываться с белками. высокий потенциал связывания с
- 121. Лидокаин Не обладает кардиотоксичностью Средняя дозировка препарата – 300 мг (4,5 мг/кг массы) Максимально рекомендуемая доза
- 122. Бупивакаин В 4 раза мощнее лидокаина Большая продолжительность действия Дифференцированное выключение сенсорных волокон Наибольшая способность связываться
- 123. Ропивакаин VS Бупивакаин Меньшая токсичность Меньшая моторная блокада Хорошо устраняет турникетные боли На 40 % менее
- 124. Преимущества эпидуральной аналгезии Улучшение контроля болевого синдрома Снижение длительности госпитализации Улучшает функцию ЖКТ Снижение дозировки опиоидов
- 125. Преимущества многоуровневой аналгезии Синергичное действие Снижение дозировки каждого препарата Повышение эффективности аналгезии Снижение периферической сенситизации ноцицепторов
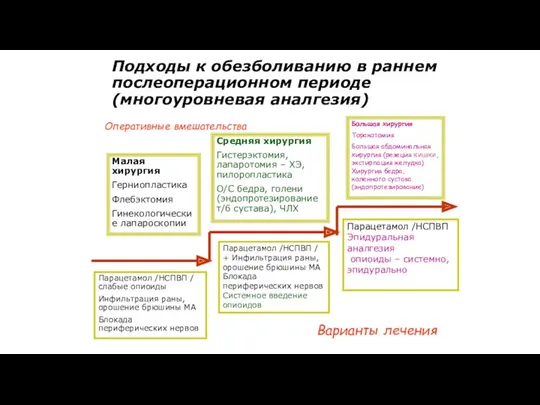
- 126. Подходы к обезболиванию в раннем послеоперационном периоде (многоуровневая аналгезия) Малая хирургия Герниопластика Флебэктомия Гинекологические лапароскопии Средняя
- 127. Упреждающая аналгезия Основой «упреждающей» аналгезии является полная блокада или максимальное ограничение интенсивности периоперационного ноцицептивного входа к
- 128. Особенности мультимодальной аналгезии При операциях низкой травматичности эпидуральная анестезия не показана. 2. Сочетание парацетамола с НСПВП
- 129. Нейропатическая боль Чувствительна к: местным анестетикам антиконвульсантам антидепрессантам кетамину Менее чувствительна к опиоидам Не чувствительна к
- 130. Группы препаратов для лечения нейропатической боли I - Доказательства, полученные из систематического обзора всех соответствующих рандомизированных
- 131. Послеоперационная ноцицептивная и нейропатическая боль Вызвана преимущественным поражением или дисфункцией ЦНС; С регионарным вовлечением симпатической НС;
- 132. Клинические примеры развития смешанного болевого синдрома (острая ноцицептивная и нейропатическая боль) Повреждение спинного мозга ноцицептивная боль
- 133. Сочетание препаратов для лечения острой нейропатической боли Травма спинного мозга Опиоиды (в/в, per os); Кетамин (в/в);
- 134. Кетамин и лидокаин в лечении нейропатической боли Внутривенное введение лидокаина (0,5 – 1 мг/кг/час) и кетамина
- 135. Комбинированная адьювантная терапия Препараты двойного действия, такие как трициклические антидепрессанты (амитриптилин, кломипрамин) и венлафаксин, (комбинация антидепрессантов
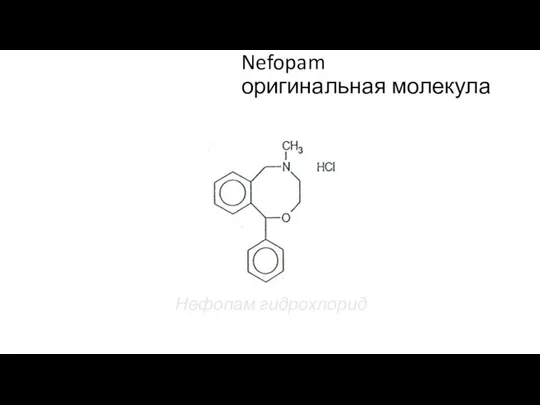
- 136. Nefopam оригинальная молекула Нефопам гидрохлорид
- 137. АКУПАН® активирует нисходящие моноаминергические пути, которые ингибируют боль « Не единственный механизм, лежащий в основе анальгетического
- 138. Как АКУПАН® контролирует боль? АКУПАН® активирует адренергические, допаминергические и серотонинергические пути через: Адренергические α1 и α2
- 139. Противопоказания, взаимодействия и побочные эффекты Противопоказания Гиперчувствительность к нефопаму или другим компонентам Дети младше 12 лет,
- 140. Режимы дозирования МА разрешенных в РФ (на основании инструкций) Дозирование Дозирование
- 141. Адъюванты Вазоконстрикторы Изменение плотности растворов Алкалинизация Смеси анестетиков Опиоиды α2-адреноагонисты (клофелин) антихолинергические препараты (неостигмин) антагонисты NMDA
- 142. Рекомендации 2016 г Guidelines on the Management of Postoperative Pain A Clinical Practice Guideline From the
- 143. Рекомендации 2016 г Опиоиды Пероральный прием опиоидных анальгетиков предпочтителен у пациентов, которые могут принимать препараты таким
- 144. Рекомендации 2016 г Опиоиды Необходимо обеспечивать мониторинг степени седации, газообмена и возможного развития побочных эффектов, связанных
- 145. Рекомендации 2016 г НПВС и парацетамол Пациентам, при отсутствии противопоказаний в схеме мультимодальной терапии показано использование
- 146. НПВС, Целекоксиб НПВС противопоказаны для периоперационного введения при операциях на коронарных артериях, поскольку повышают риск кардиоваскулярных
- 147. Целекоксиб Предоперационное введение целекоксиба (селективного блокатора ЦОГ 2) пациентам с предстоящим большим хирургическим вмешательством снижает потребность
- 148. Габапентин и прегабалин Габапентин и прегабалин (лирика) могут рассматриваться как компоненты мультимодальной аналгезии, которые снижают потребность
- 149. Кетамин Кетамин рассматривается как компонент мультимодальной аналгезии, снижающий риск персистирующей боли после хирургических операций. Кетамин используется
- 150. Лидокаин Инфузия лидокаина показана взрослым пациентам, подвергшимся лапароскопическим и открытым абдоминальным операциям, не имеющим противопоказаний. Назначение
- 151. Лкальная (регионарная) аналгезия введение местных анестетиков в зоне хирургического воздействия при таких операциях, как тотальное эндопротезирование
- 152. Лкальная (регионарная) аналгезия Использование регионарной аналгезии является эффективным компонентом мультимодальной аналгезии при торакотомии, операциях на суставах
- 153. Клонидин Рекомендуется добавление клонидина, как адьюванта, при однократной периферической блокаде местным анестетиком, который увеличивает продолжительность регионарной
- 155. Скачать презентацию









































































































 Вегетативные дисфункции у детей
Вегетативные дисфункции у детей Питание детей с муковисцидозом
Питание детей с муковисцидозом Травма головы
Травма головы Дене шынықтыру мен спорт
Дене шынықтыру мен спорт Іріңді-септикалық инфекциялар кезінде алдын алу және эпидемияға қарсы шаралар.Күйік бөлімшелеріндегі инфекциялық бақылау
Іріңді-септикалық инфекциялар кезінде алдын алу және эпидемияға қарсы шаралар.Күйік бөлімшелеріндегі инфекциялық бақылау Определение и оценка физического развития
Определение и оценка физического развития Возрастные особенности опорно-двигательной системы
Возрастные особенности опорно-двигательной системы Тканевая совместимость и переливание крови
Тканевая совместимость и переливание крови Антитела, строение и функции
Антитела, строение и функции Дыхание в необычных условиях
Дыхание в необычных условиях Дегенерация сетчатки глаза
Дегенерация сетчатки глаза Заболевания щитовидной железы
Заболевания щитовидной железы Злокачественные опухоли и их профилактика
Злокачественные опухоли и их профилактика Печеночная кома. Интенсивная терапия
Печеночная кома. Интенсивная терапия Роль формулярной системы в повышении эффективности использования лекарственных средств
Роль формулярной системы в повышении эффективности использования лекарственных средств Новые подходы в организации и проведении предварительных и периодических медицинских осмотров
Новые подходы в организации и проведении предварительных и периодических медицинских осмотров Антигипертензивные препараты при беременности. Влияние на мать и плод
Антигипертензивные препараты при беременности. Влияние на мать и плод Технология сестринских манипуляций. Сестринский процесс в организации питания больных
Технология сестринских манипуляций. Сестринский процесс в организации питания больных Аномалии развития почек
Аномалии развития почек Неврология, психиатрия және наркология. Шизофрения
Неврология, психиатрия және наркология. Шизофрения Электрофорез белков сыворотки крови
Электрофорез белков сыворотки крови Локализованные формы рака молочной железы. Тактика лечения. Прогноз
Локализованные формы рака молочной железы. Тактика лечения. Прогноз Молекулярні хвороби та методи їх діагностики. (Лекція 8)
Молекулярні хвороби та методи їх діагностики. (Лекція 8) Травматические вывихи
Травматические вывихи Цитостатикалық ем
Цитостатикалық ем Рожа - инфекционная болезнь
Рожа - инфекционная болезнь Холера. Клиническая картина
Холера. Клиническая картина Механизмы трофического действия физических упражнений
Механизмы трофического действия физических упражнений