Содержание
- 2. Антитела, строение и функции V(D)J-рекомбинация Получение моноклональных антител Иммунохимические методы – ИФА и Western blot, иммуноцитохимия
- 3. Антитела (иммуноглобулины) – это сывороточные белки, образующиеся в ответ на действие антигена и способные к специфическому
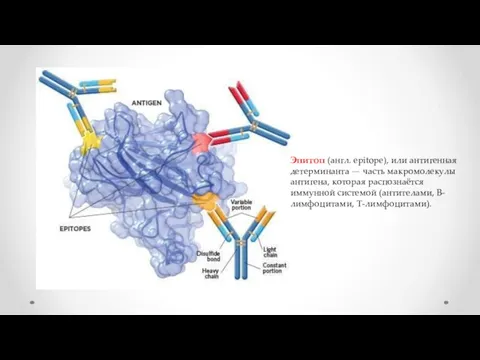
- 4. Эпитоп (англ. epitope), или антигенная детерминанта — часть макромолекулы антигена, которая распознаётся иммунной системой (антителами, B-лимфоцитами,
- 6. secondary response against antigen A Primary response against antigen A Level of antibodies napok primary response
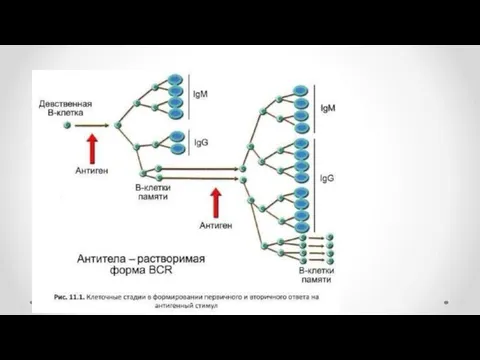
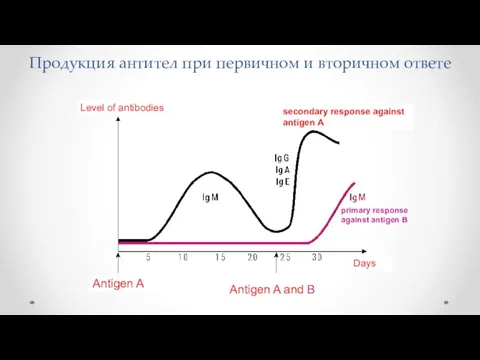
- 7. Продукция антител при первичном и вторичном ответе
- 8. Самое первое антитело было обнаружено Берингом и Китазато в 1890 году, однако в это время о
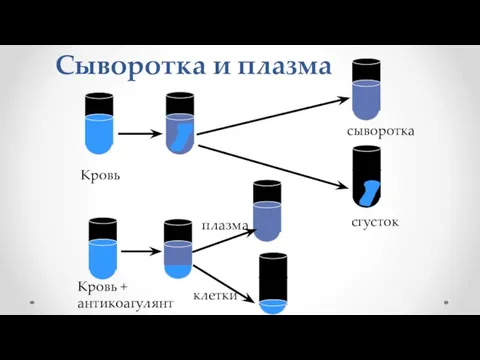
- 9. Сыворотка и плазма Кровь Кровь + антикоагулянт клетки плазма сыворотка сгусток
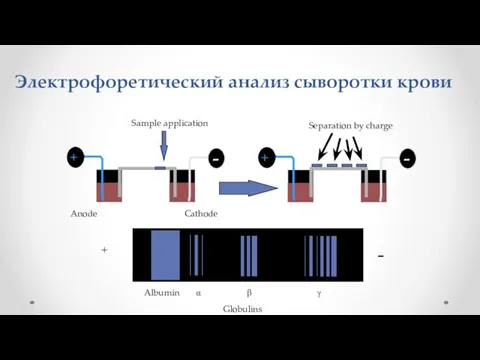
- 10. Электрофоретический анализ сыворотки крови - Sample application Anode Cathode - Separation by charge
- 11. Белки сыворотки
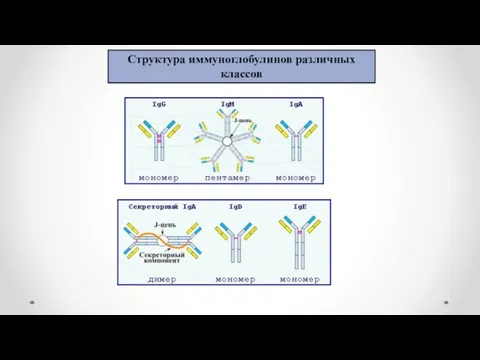
- 12. Структура иммуноглобулинов различных классов
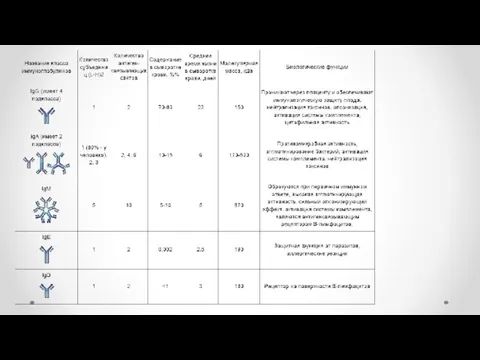
- 13. Ig A - Обеспечивает защиту слизистых оболочек от инфекции (местный иммунитет). Ig M - синтезируется на
- 14. Функции иммуноглобулинов Функция иммуноглобулинов – гуморальный иммунный ответ: Связывание антитела с поверхностным антигеном активирует систему комплемента
- 15. Иммуноглобулины всех изотипов бифункциональны. Это означает, что иммуноглобулин любого типа: распознает и связывает антиген, а затем
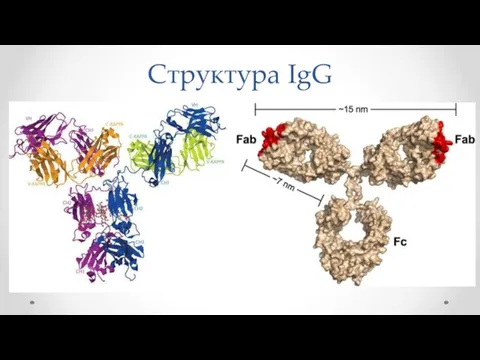
- 17. Структура IgG
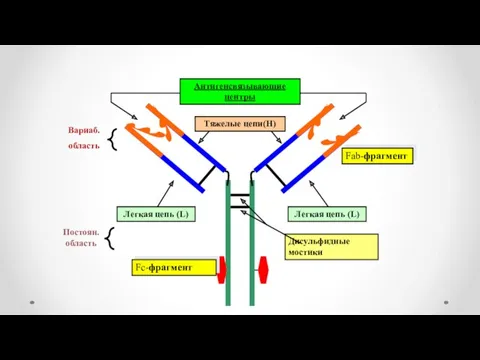
- 18. Вариаб. область Постоян.область Fc-фрагмент Fab-фрагмент
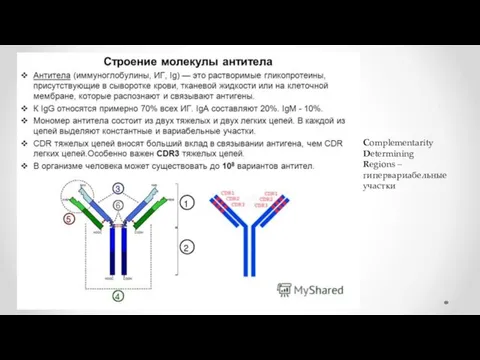
- 19. Complementarity Determining Regions – гипервариабельные участки
- 20. Антитела являются относительно крупными (~150 кДа — IgG) гликопротеинами, имеющими сложное строение. Состоят из двух идентичных
- 21. IgG является основным иммуноглобулином сыворотки здорового человека (составляет 70-75 % всей фракции иммуноглобулинов), наиболее активен во
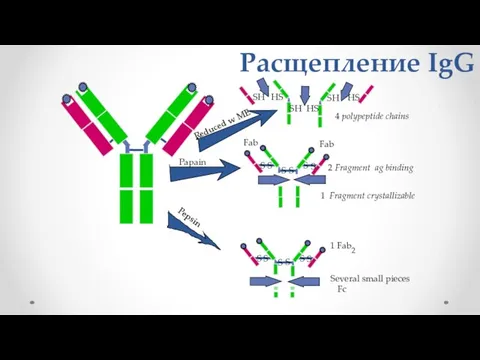
- 22. Расщепление IgG 2 Fragment ag binding 1 Fragment crystallizable 1 Fab2 Several small pieces Fc Pepsin
- 23. В каждом антителе выделяют Fс-фрагмент (якорная часть), который может взаимодействовать с мембраной клеток, и Fab-фрагмент, в
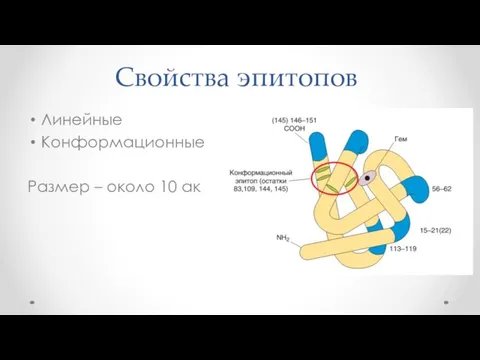
- 24. Свойства эпитопов Линейные Конформационные Размер – около 10 ак
- 25. Валентность – количество активных (антиген-связывающих) центров антител. Как правило, бивалентны. Аффинность – сродство антигенной детерминанты с
- 26. Клонально-селекционная теория имеет в виду то, что каждый лимфоцит синтезирует антитела только одной определенной специфичности. И
- 27. Антитела и лимфоциты с нужной специфичностью уже существуют в организме до первого контакта с антигеном. Лимфоциты,
- 28. Любой лимфоцит несет на своей поверхности рецепторы только одной специфичности. Лимфоциты, имеющие антиген, проходят стадию пролиферации
- 29. антиинфекционные или антипаразитарные антитела, вызывающие непосредственную гибель или нарушение жизнедеятельности возбудителя инфекции либо паразита антитоксические антитела,
- 30. аутоагрессивные антитела, или аутологичные антитела, аутоантитела — антитела, вызывающие разрушение или повреждение нормальных, здоровых тканей самого
- 31. гетерологичные антитела, или изоантитела — антитела против антигенов тканей или клеток организмов других биологических видов. Изоантитела
- 32. антиидиотипические антитела — антитела против антител, вырабатываемых самим же организмом. Причём это антитела не «вообще» против
- 33. V(D)J-рекомбинация механизм соматической рекомбинации ДНК, происходящий на ранних этапах дифференцировки лимфоцитов и приводящий к формированию антиген-распознающих
- 34. Система адаптивного (приобретенного) иммунитета способна распознавать миллионы отдельных антигенных детерминант. Если бы весь антиген-распознающий репертуар рецепторов
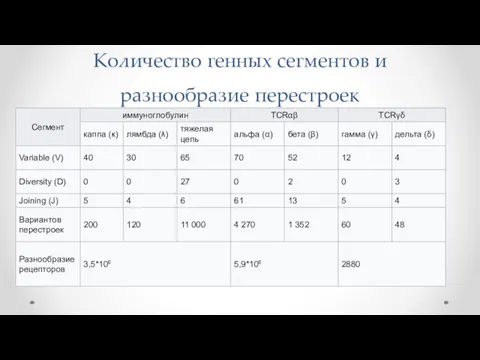
- 35. Количество генных сегментов и разнообразие перестроек
- 36. Механизм Молекулярный механизм рекомбинации всех семи локусов Ig/TCR идентичный. Эти генные перестройки происходят на ранних этапах
- 37. Сигнальные последовательности Рекомбинация происходит по сигнальным последовательностям ДНК, непосредственно прилегающим к генным сегментам. Консервативные сигнальные последовательности
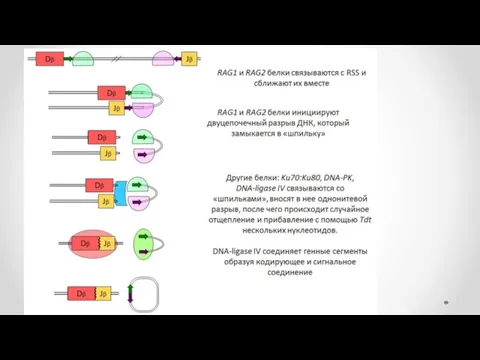
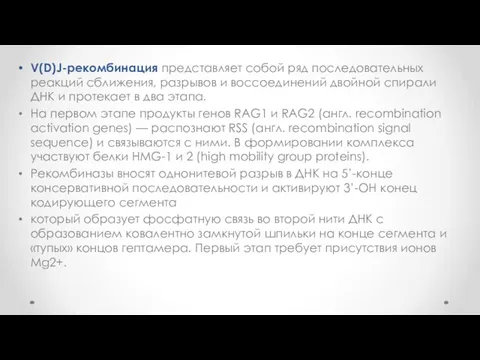
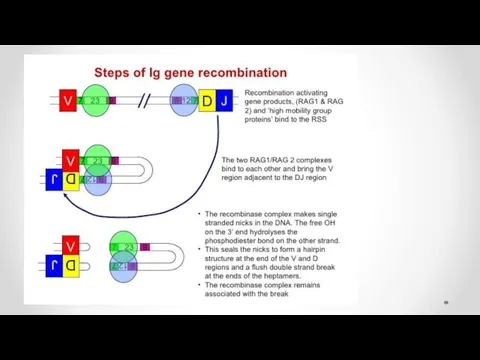
- 39. V(D)J-рекомбинация представляет собой ряд последовательных реакций сближения, разрывов и воссоединений двойной спирали ДНК и протекает в
- 41. 2 этап На втором этапе реакции тупые концы гептамеров соединяются, образуя так называемое сигнальное соединение. Кодирующие
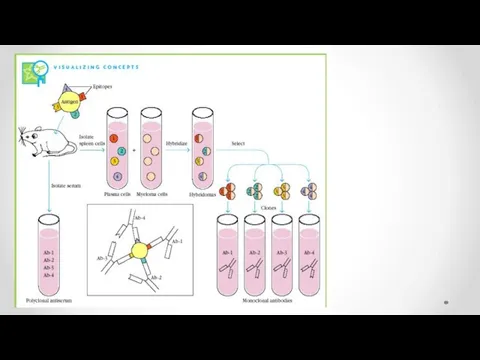
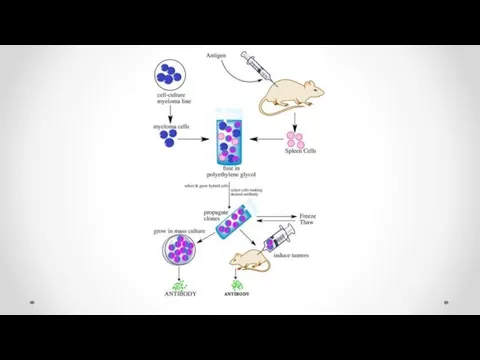
- 43. Получение моноклональных антител
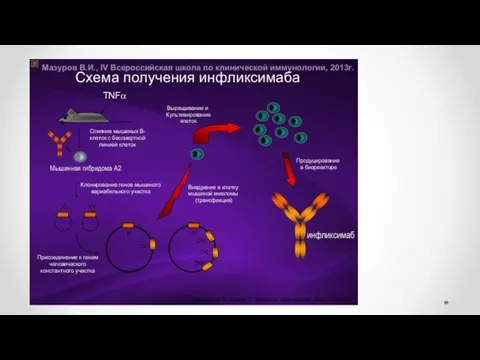
- 46. Моноклональные антитела и гибридомная технология 1976 г Келер и Мильстайн осуществили соматическую гибридизацию антителообразующей и миеломной
- 48. Иммунохимические методы исследования ELISA Western Blotting Иммуногистохимия Иммунопреципитация
- 49. Иммунохимические методы исследований Иммунохимические методы исследований – методы, основанные на специфической реакции взаимодействия антигена с антителом.
- 50. Специфичность и чувствительность иммунохимических методов Специфичность: иммунохимические методы высокоспецифичны (95-98%), можно легко и точно дифференцировать в
- 51. ELISA (ИФА) Enzyme Linked Immunosorbent Assay (Иммуноферментный анализ)
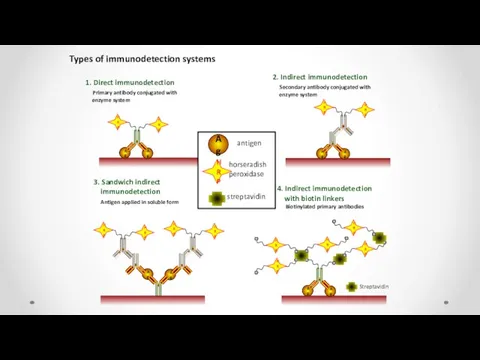
- 53. Ag Ag Types of immunodetection systems 1. Direct immunodetection Primary antibody conjugated with enzyme system 2.
- 55. Indirect ELISA
- 56. Детекция сигнала: оптическое поглощение (450 нм)
- 57. Раститровка стандартного антигена
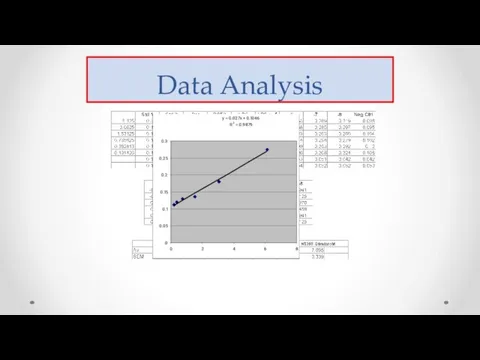
- 58. Data Analysis
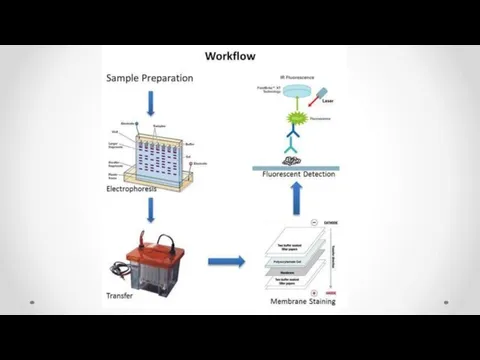
- 59. Western blotting Enzyme Linked Immunosorbent Assay (Иммуноферментный анализ)
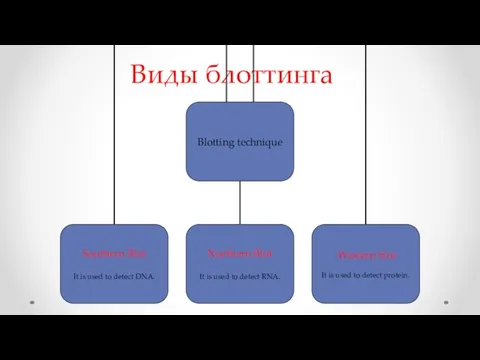
- 60. Виды блоттинга
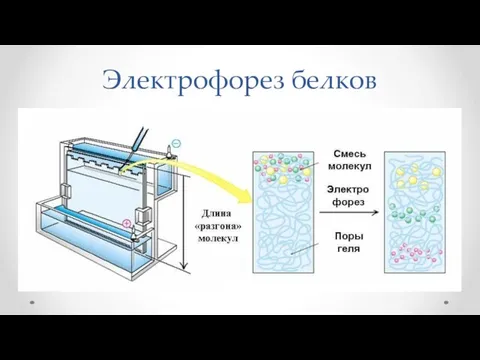
- 62. Электрофорез белков
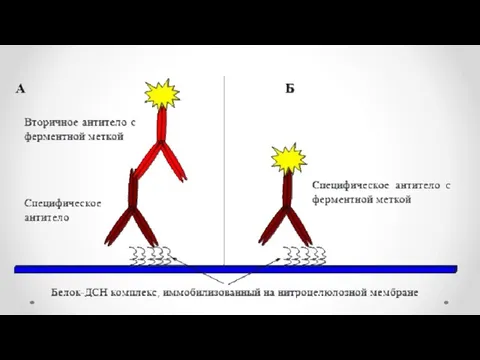
- 63. Электроперенос белков на мембрану
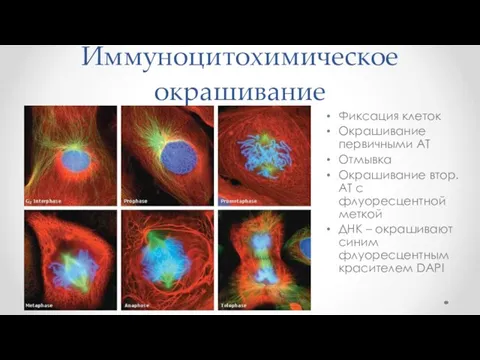
- 65. Иммуноцитохимическое окрашивание Фиксация клеток Окрашивание первичными АТ Отмывка Окрашивание втор. АТ с флуоресцентной меткой ДНК –
- 66. Иммунопреципитация Метод выделения белка из сложных смесей при помощи специфичных антител Антитела иммобилизуют на нерастворимых гранулах
- 67. Абзимы Абзимы (англ. abzyme, antibody enzyme) — каталитически активные антитела. В широком смысле термином «абзимы» обычно
- 69. Антитела в медицине К ноябрю 2014 года в США и Европе к использованию допущены 47 лекарственных
- 70. Сегодня применение моноклональных антител в медицине основано на трех основных стратегиях: • распознавание антителами характерных белков
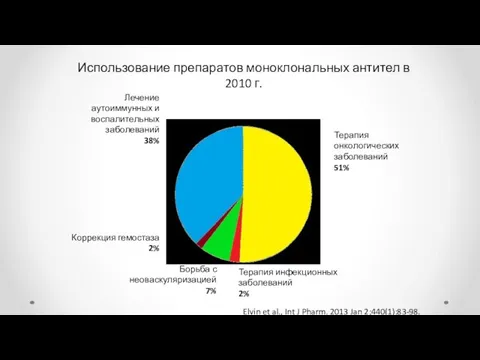
- 71. Использование препаратов моноклональных антител в 2010 г. Терапия онкологических заболеваний 51% Лечение аутоиммунных и воспалительных заболеваний
- 72. http://www.antibodysociety.org/news/approved_mabs.php
- 75. Скачать презентацию













































 ОПН при инфекционной патологии у детей. Причины развития. Диагностика. Тактика ведения
ОПН при инфекционной патологии у детей. Причины развития. Диагностика. Тактика ведения Деонтология в онкологии
Деонтология в онкологии Частная вирусология. Возбудители ОРВИ
Частная вирусология. Возбудители ОРВИ Особенности психического развития детей с нарушениями опорно - двигательного аппарата
Особенности психического развития детей с нарушениями опорно - двигательного аппарата Принципы и мероприятия медицинской защиты. Табельные мед средства индивидуальной защиты и их использование. Основные понятия
Принципы и мероприятия медицинской защиты. Табельные мед средства индивидуальной защиты и их использование. Основные понятия Сенсорные нарушения, их коррекция и реабилитация (речевые, зрительные и другие)
Сенсорные нарушения, их коррекция и реабилитация (речевые, зрительные и другие) Иммуннологические маркеры аутоимунных заболеваний ЖКТ
Иммуннологические маркеры аутоимунных заболеваний ЖКТ Медицинская информация
Медицинская информация Атом энергиясын бейбіт мақсатта пайдалану. Радиоактивті изотоптар мен иондаушы сәулелер көздерін медицинада қолдану
Атом энергиясын бейбіт мақсатта пайдалану. Радиоактивті изотоптар мен иондаушы сәулелер көздерін медицинада қолдану Клещевой энцефалит
Клещевой энцефалит Жедел мезентериялық қан айналым бұзылысы
Жедел мезентериялық қан айналым бұзылысы Синдром лихорадки и субфебриллитета неясного генеза
Синдром лихорадки и субфебриллитета неясного генеза Молекулярні хвороби та методи їх діагностики. (Лекція 8)
Молекулярні хвороби та методи їх діагностики. (Лекція 8) Рентгенологические признаки заболеваний легких: как читать рентгенограммы и КТ органов грудной клетки
Рентгенологические признаки заболеваний легких: как читать рентгенограммы и КТ органов грудной клетки Гинекологическое обследование детей и подростков в норме и при патологии
Гинекологическое обследование детей и подростков в норме и при патологии Противоязвенные лекарственные средства
Противоязвенные лекарственные средства Болезни печени
Болезни печени Особености травматологии детского возраста
Особености травматологии детского возраста Образовательная программа^ профилактика ВИЧ-инфекции (для школьников и педагогов)
Образовательная программа^ профилактика ВИЧ-инфекции (для школьников и педагогов) Опухоли кроветворной ткани. Лейкозы
Опухоли кроветворной ткани. Лейкозы Вирус клещевого энцефалита
Вирус клещевого энцефалита Пациент. Подпись врача
Пациент. Подпись врача Clinical manifestation of HIV-infection
Clinical manifestation of HIV-infection Внебольничная пневмония
Внебольничная пневмония Сестринский уход при болезнях пищеварения у гериатрических пациентов
Сестринский уход при болезнях пищеварения у гериатрических пациентов Күйіктер. Жаларар
Күйіктер. Жаларар Обследование больных с патологией сердечно-сосудистой системы
Обследование больных с патологией сердечно-сосудистой системы Жүктілікті болдырмау үшін қолданылатын контрацепциялар
Жүктілікті болдырмау үшін қолданылатын контрацепциялар