Содержание
- 2. Размеры молекул простых и сложных белков, нуклеиновых кислот в растворе по своим размерам соответствуют коллоидным частицам
- 3. Факторы, определяющие электрофоретическую подвижность белков Величина заряда Размер белковой молекулы Форма белковой молекулы (чем менее шарообразна,
- 4. Факторы, определяющие электрофоретическую подвижность белков Для стабилизации зон используют: - в жидкой среде – использование градиента
- 5. Факторы, определяющие электрофоретическую подвижность белков Недостаток – носители имеют полярные группы (целлюлоза – карбоксильные, агар –
- 6. Электрофорез белков плазмы крови При добавлении к среде NaCl ионы Na+ взаимодействуют с отрицательно заряженными группами
- 7. Факторы, определяющие электрофоретическую подвижность белков
- 8. Виды электрофореза Электрофорез с подвижной границей – разделение идет в жидкой среде в U-образной кювете. Исследуемый
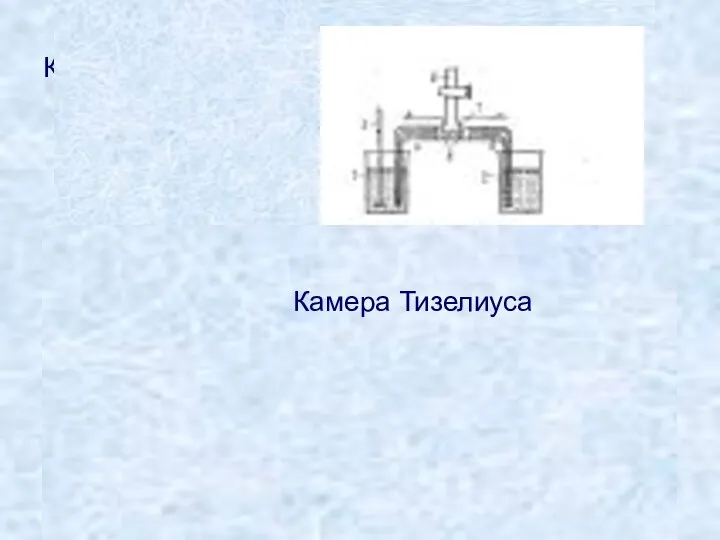
- 9. Камера Тизелиуса Камера Тизелиуса
- 10. Виды электрофореза Зональный электрофорез в поддерживающей среде – обеспечивает стабильность зон, используется непрерывная буферная система. В
- 11. На электрофоретическую подвижность влияют адсорбция молекул исследуемого вещества на поверхности раздела фаз Присутствие ионогенных групп в
- 12. Зональный электрофорез на бумаге Специальная бумага пропитывается буферным раствором, наносится образец и подключается ток За ходом
- 13. Недостатки метода: - неоднородность по структуре - при волокнистой структуре частицы движутся как в капиллярах (торможение
- 14. Зональный электрофорез на ацетатцеллюлозе Пленки имеют однородную структуру Диаметр пор –несколько микрон Не содержат ионогенных групп
- 15. Камера для электрофореза для ацетатцеллюлозной пленке
- 16. Зональный электрофорез на ацетатцеллюлозе
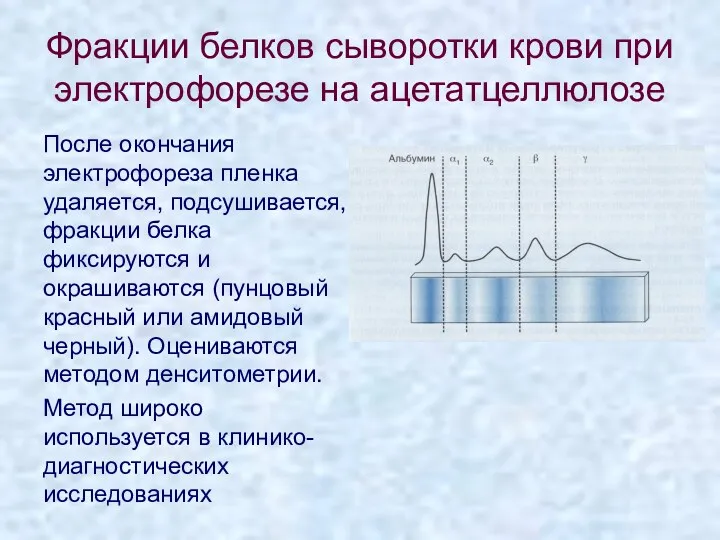
- 17. Фракции белков сыворотки крови при электрофорезе на ацетатцеллюлозе
- 18. Приборы для электрофореза для ацетатцеллюлозной пленке
- 19. Аппарат для электрофореза
- 20. Электрофорез в гранулированных материалах Зональный электрофорез в крахмальном геле - сложность приготовления крахмального геля - нестабильность
- 21. Электрофорез в гранулированных материалах Зональный электрофорез в геле агара и агарозы - электрофорез идет как в
- 22. Электрофорез в гранулированных материалах Электрофорез в полиакриламидном геле Синтетический материал с капиллярной структурой Размеры пор могут
- 23. Электрофорез в полиакриламидном геле Варианты : - в однородной буферной системе - в неоднородной (прерывистой) буферной
- 24. Диск-электрофорез Используется неоднородная разделяющая система – образуются зоны, имеющие форму диска Разделение белков проводится в геле
- 25. Диск-электрофорез
- 26. Диск-электрофорез в полиариламидном геле
- 27. Тест-набор для электрофореза
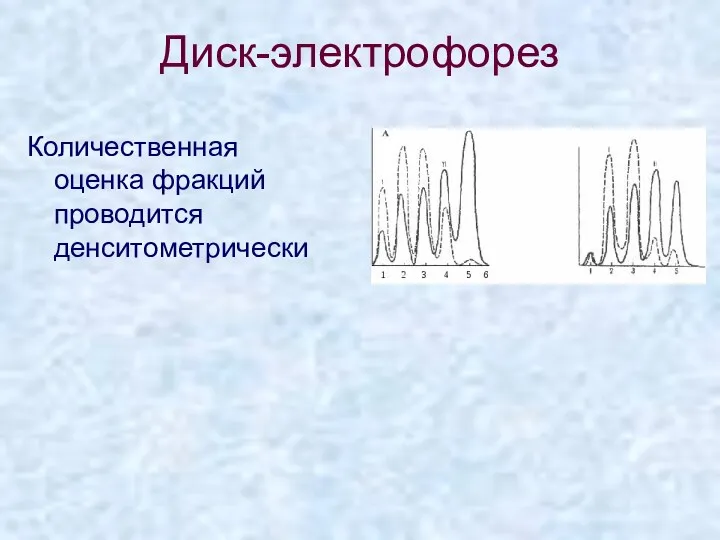
- 28. Диск-электрофорез Количественная оценка фракций проводится денситометрически
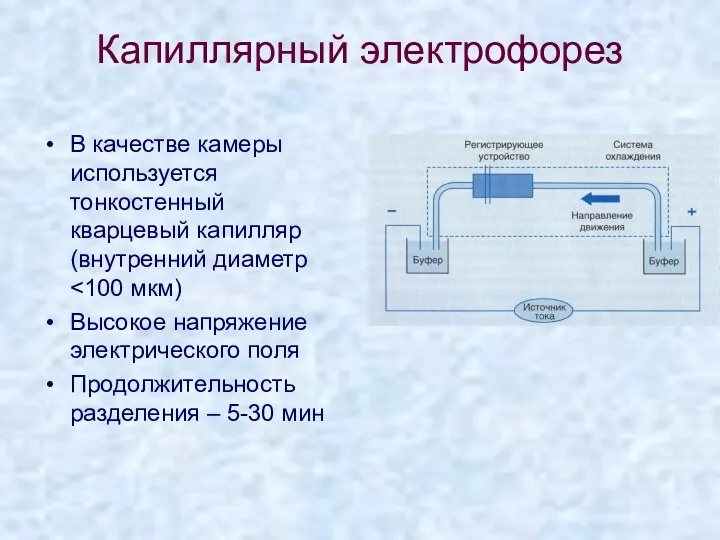
- 29. Капиллярный электрофорез В качестве камеры используется тонкостенный кварцевый капилляр (внутренний диаметр Высокое напряжение электрического поля Продолжительность
- 30. Миграция белков при капиллярном электрофорезе Разделение происходит за счет движения под действием электрического поля и тока
- 31. Оборудование, предназначенное для разделения образцов анализируемой смеси на компоненты, посредством взаимодействия пробы с электрическим полем внутри
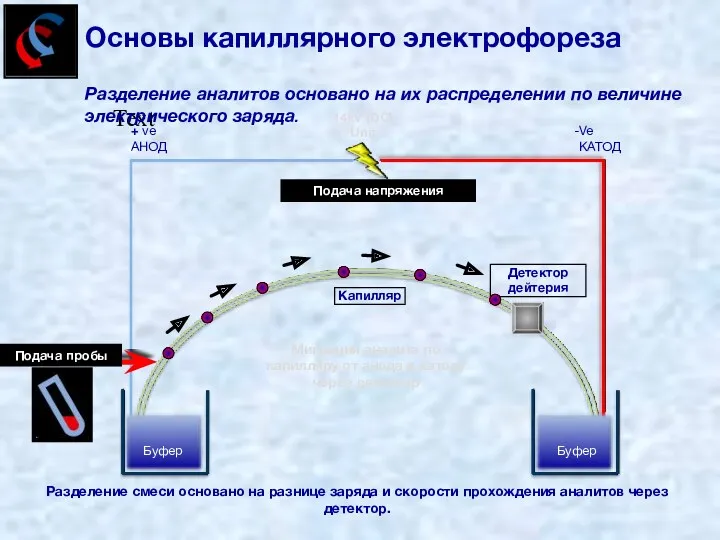
- 32. Text Разделение аналитов основано на их распределении по величине электрического заряда. Sample applied Voltage applied Буфер
- 33. Результаты разделения и идентификации белков с использованием капиллярного электрофореза
- 34. СОВРЕМЕННЫЙ КАПИЛЛЯРНЫЙ ЭЛЕКТРОФОРЕЗ Знакомьтесь – V8 – новое решение от компании Helena
- 35. Стационарный электрофорез Через некоторое время после начала разделения макромолекул достигается распределение компонентов смеси, и ширина зон
- 36. Изоэлектрическое фокусирование Метод разделения веществ, обладающих амфотерными свойствами, в соответствии с значением их изоэлектрической точки в
- 37. pH Метод разделения макромолекул, основанный на их миграции в градиенте значений рН под действием постоянного электрического
- 38. Изоэлектрическое фокусирование
- 40. Изотахофорез Метод электрофореза, при котором молекулы под действием электрического поля разделяются в соответствии с зарядами, образуя
- 41. Оценка электрофореграмм Окрашивание специфическими красителями с последующей фотометрией Регистрация поглощения УФ-лучей и флуоресценции Иммунохимические методы Регистрация
- 42. Окрашивание Окрашиваются бумага, ацетат целлюлозы, агар, агароза, ПААГ Красители образуют комплексы с молекулами, но вымываются из
- 43. ДЕНСИТОМЕТР
- 44. Современный гелевый электрофорез SAS 1plus Helena – автоматическое нанесение, концентрирование и разделение образцов на агарозном геле
- 45. Выявление по поглощению УФ-света и флуоресценции Регистрация поглощенного УФ света, проходящего через электрофореграммы на твердых прозрачных
- 46. Иммунопроявление и иммунофиксация Взаимодействие белков (антигенов) с со специфическими к ним антителами вызывает образование преципитата Иммуноэлектрофорез
- 47. Регистрация радиоактивности Увеличивает чувствительность метода Предварительно молекулы метятся радиоактивной меткой Радиоактивность обнаруживается при сканировании высушинных гелей
- 48. Типичные ошибки Ошибка при расчете объема исследуемого образца – избыточное количество приводит к искажению электрофореграммы Сыворотка
- 49. Типичные ошибки Ошибки при подготовке образцов для исследования – если использована плазма, а не сыворотка крови
- 50. Типичные ошибки Свойства буферных растворов при близости рН к ИЭТ миграция замедлена повторное использование буфера может
- 51. Типичные ошибки Ошибки, связанные с электрической цепью отсутствие напряжения – отсутствие миграции неправильная полярность – миграция
- 52. Типичные ошибки при электрофорезе белков
- 53. Типичные ошибки при электрофорезе белков
- 54. Роль электрофоретического анализа Определение типа электрофореграммы может подтвердить предполагаемый диагноз, выявить скрытую патологию, следить за ходом
- 55. спасибо за внимание
- 56. Иммунофиксация – качественный метод, позволяющий установить природу моноклонального компонента Методы определения – гелевый электрофорез на агарозе
- 57. IgG κ Выявление моноклональных гаммапатий Иммунофиксация в гелевом электрофорезе На агарозном геле разделение белков IFE в
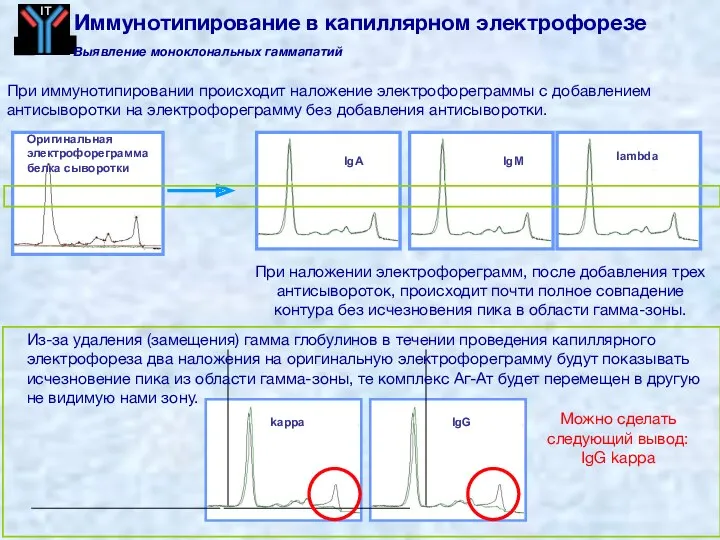
- 58. 1. Антисыворотка добавляется непосредственно к пробе. Если есть антитела, то происходит образование комплекса Антиген-Антитело. 2. Антисыворотка
- 59. IgG IgA IgM lambda Оригинальная электрофореграмма белка сыворотки kappa Можно сделать следующий вывод: IgG kappa При
- 60. Методические подходы к определению белков Электрофоретический метод является полуколичественным и не подлежит метрологическому контролю
- 61. Электрофоретические фракции и индивидуальные белки сыворотки крови здорового человека
- 62. Электрофоретические фракции и составляющие их белки сыворотки крови
- 63. Фракции белков сыворотки крови
- 64. Электрофореграмма при бисальбуминемии Выявляется двойная полоса в зоне альбумина Может быть генетически обусловленной или транзиторной Причины:
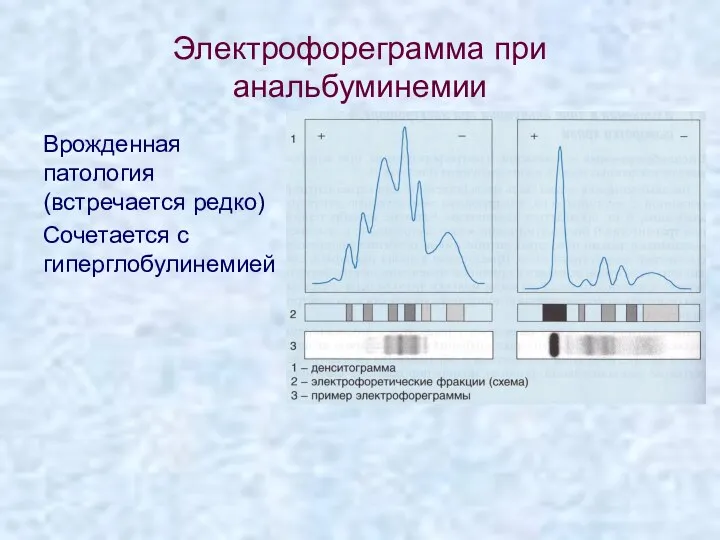
- 65. Электрофореграмма при анальбуминемии
- 66. Электрофореграмма при ожогах
- 67. Электрофореграмма при дефиците α1 -антитрипсина
- 68. Электрофореграмма при остром воспалительном синдроме
- 69. Электрофореграмма сыворотки крови при нефротическом синдроме Снижение α2 –глобулинов Нарушение питания Патология печени Внутрисосудистый гемолиз Увеличение
- 70. Электрофореграмма сыворотки крови и гипертрансферинемией при анемии Уменьшение β-глобулинов -патология печени -дефицит С3-компонента комплемента Увеличение β-глобулинов
- 71. Электрофореграма сыворотки крови при алкогольном циррозе Слияние β- и γ-фракции (за счет увеличения поликлонального Ig A)
- 72. Электрофореграмма сыворотки крови при гипогаммаглобулинемии Физиологическая – у новорожденных Первичный гуморальный иммунодефицит Вторичный – при лечении
- 73. Электрофореграмма сыворотки криви при поликлональной гипергаммаглобулинемии Диффузное усиление зоны γ-глобулинов (инфекционные заболевания печени, СПИД, аутоиммунные заболевания)
- 74. Электрофореграмма сыворотки крови при олигоклональной гипергаммаглобулинемии Появление нескольких полос (синтез в организме одновременно нескольких типов антител
- 75. Электрофореграмма сыворотки крови пожилого пациента с моноклональным компонентом Появление узкой гомогенной полосы У пожилых лиц обнаруживается
- 76. Электрофореграмма сыворотки крови с дополнительной полосой , обусловленной присутствием фибриногена, и того же образца после обработки
- 80. Определение фракций белков в моче (примеры) Определение фракций белков в моче должно проводиться после концентрирования и
- 82. Скачать презентацию







































































 Соединения костей
Соединения костей Определение аллергии
Определение аллергии Гормоны поджелудочной, щитовидной желёз, надпочечников, половых желёз. Лекция 17
Гормоны поджелудочной, щитовидной желёз, надпочечников, половых желёз. Лекция 17 Топографическая анатомия и операции на желудке
Топографическая анатомия и операции на желудке Болезнь Гамборо, инфекционный бурсит кур, инфекционная бурсальная болезнь
Болезнь Гамборо, инфекционный бурсит кур, инфекционная бурсальная болезнь ЛФК при заболеваниях сердечно-сосудистой системы
ЛФК при заболеваниях сердечно-сосудистой системы Пиелонефрит у беременных
Пиелонефрит у беременных Острые лейкозы
Острые лейкозы Флоренс Найтингейл
Флоренс Найтингейл Gingivitis or periodontal disease
Gingivitis or periodontal disease Хронический лимфолейкоз
Хронический лимфолейкоз Искусственные объекты и их внедрение
Искусственные объекты и их внедрение Травма кровеносных сосудов
Травма кровеносных сосудов Moya_professia
Moya_professia Физиология выделительной системы. Роль почек в процессах выделения
Физиология выделительной системы. Роль почек в процессах выделения Синдром “супер жінки”
Синдром “супер жінки” Клинические формы вторичного туберкулеза. Осложнения туберкулеза. Лекция 5
Клинические формы вторичного туберкулеза. Осложнения туберкулеза. Лекция 5 Тематическая беседа-викторина Как уберечься от гриппа (практикум)
Тематическая беседа-викторина Как уберечься от гриппа (практикум) Дифтерия
Дифтерия Анатомо-физиологические особенности органа зрения, органа слуха и равновесия. Лекция № 11
Анатомо-физиологические особенности органа зрения, органа слуха и равновесия. Лекция № 11 Ауруханаішілік инфекциялар, олардың алдын алу
Ауруханаішілік инфекциялар, олардың алдын алу Хирургия паразитарных заболеваний
Хирургия паразитарных заболеваний Стерилизация изделий медицинского назначения. Методы контроля эффективности стерилизации
Стерилизация изделий медицинского назначения. Методы контроля эффективности стерилизации Особенности обеспечения проходимости дыхательных путей у детей. Интубация трахеи
Особенности обеспечения проходимости дыхательных путей у детей. Интубация трахеи Современный взгляд на проблему атеросклероза
Современный взгляд на проблему атеросклероза Faculty of Medicine
Faculty of Medicine Гипергидроз. Современный взгляд на проблему
Гипергидроз. Современный взгляд на проблему Современные методы визуализации в стоматологии
Современные методы визуализации в стоматологии