Содержание
- 2. В основе неопластической трансформации клеток лежат наследуемые изменения сигнальных путей, контролирующих размножение, жизнеспособность и миграцию клеток.
- 3. Вероятность мутагенеза и развития опухолей повышается при: наследственных нарушениях систем контроля за целостностью генома – мутациях
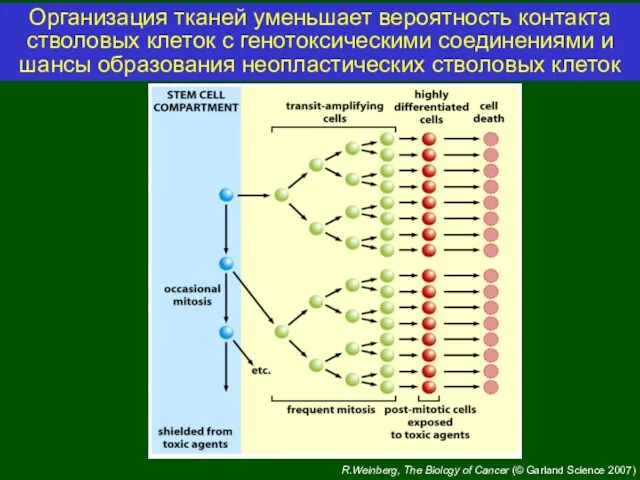
- 4. R.Weinberg, The Biology of Cancer (© Garland Science 2007) Организация тканей уменьшает вероятность контакта стволовых клеток
- 5. Химические канцерогены – соединения, контакт с которыми увеличивает вероятность развития опухолей.
- 6. Химические канцерогены – соединения, контакт с которыми увеличивает вероятность развития опухолей. Большинство из них способны вызывать
- 7. Существуют канцерогены: а) прямого действия б) непрямого действия – превращаются в электрофильные мутагенные соединения в результате
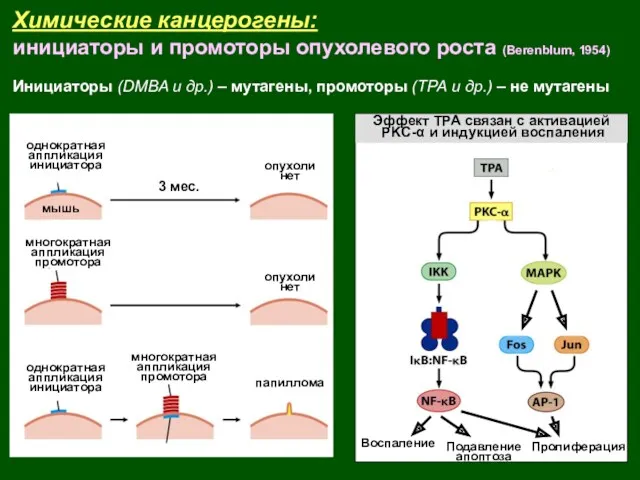
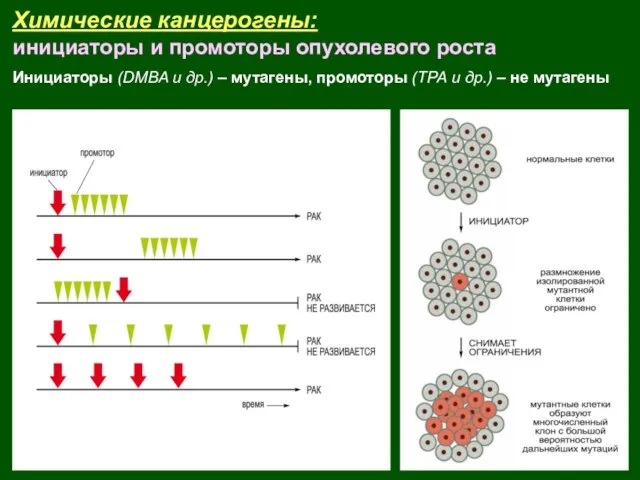
- 8. Химические канцерогены: инициаторы и промоторы опухолевого роста (Berenblum, 1954) Инициаторы (DMBA и др.) – мутагены, промоторы
- 9. Химические канцерогены: инициаторы и промоторы опухолевого роста Инициаторы (DMBA и др.) – мутагены, промоторы (ТРА и
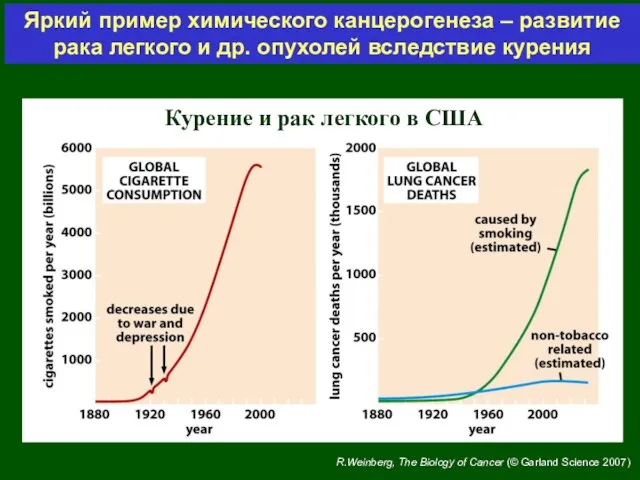
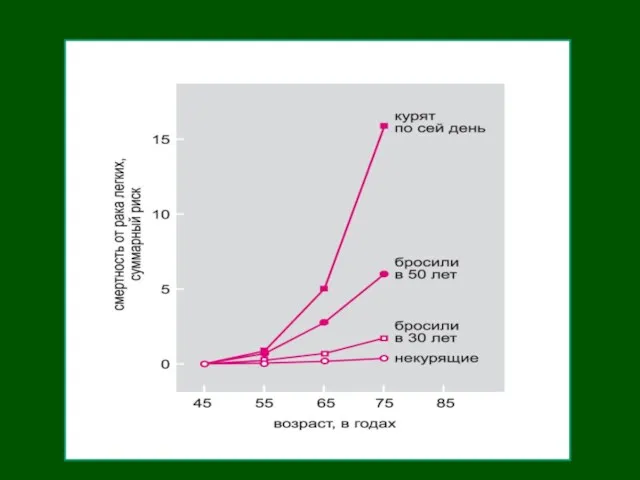
- 10. Курение и рак легкого в США Яркий пример химического канцерогенеза – развитие рака легкого и др.
- 11. Яркий пример химического канцерогенеза – развитие рака легкого и др. опухолей вследствие курения В состав табачного
- 13. Другие примеры химического канцерогенеза – развитие т.н. профессиональных раков Вид производства Злокачественные новообразования Производство фуксина, аурамина
- 14. Негенотоксические (эпигенетические) канцерогены – соединения, онкогенное действие которых в основном обусловлено не способностью индуцировать мутагенез, а
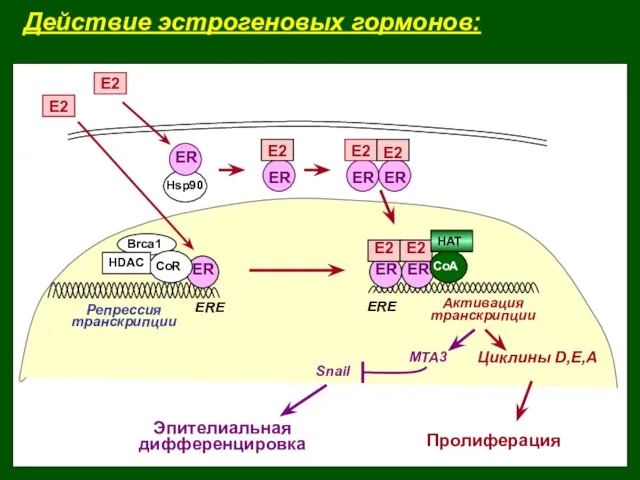
- 15. Действие эстрогеновых гормонов: Пролиферация Эпителиальная дифференцировка ER ER E2 ER E2 CoA ERE ERE Репрессия транскрипции
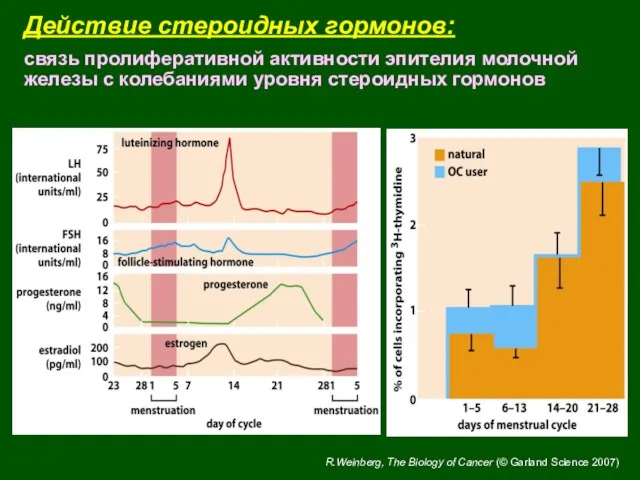
- 16. Действие стероидных гормонов: связь пролиферативной активности эпителия молочной железы с колебаниями уровня стероидных гормонов R.Weinberg, The
- 17. Повышение активности ER стимуляция размножения клеток: Активирующие миссенс-мутации в гене ER; Фосфорилирование ER (следствие активации МАРК,
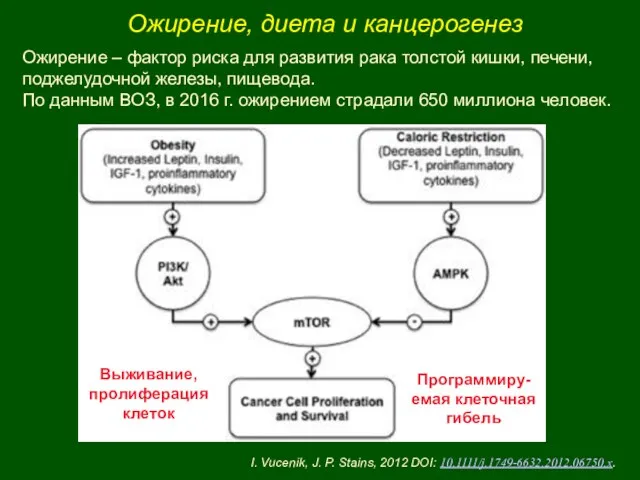
- 18. Ожирение, диета и канцерогенез Выживание, пролиферация клеток Программиру-емая клеточная гибель Ожирение – фактор риска для развития
- 19. В основе неопластической трансформации клеток лежат наследуемые изменения сигнальных путей, контролирующих размножение, жизнеспособность и миграцию клеток.
- 20. Вирусный канцерогенез Значение проблемы: 1) Вирусные инфекции ответственны за развитие 15-20% опухолей у людей и большинства
- 21. Вирусный канцерогенез Исторические вехи: 1907 г. – П. Раус (Payton Rous) доказал этиологическую роль вирусов в
- 22. 1932-1936 г. – Показано, что доброкачественные фибромы (бородавки), вызываемые у кроликов вирусом Шоупа, могут не рассасываться,
- 23. Вирусный канцерогенез Исторические вехи: 1960-1970 гг – Доказательство интеграции генома онкогенных вирусов в геном клетки и
- 24. Способность генетического материала вируса интегрироваться в геном клетки, изменяя ее наследственный потенциал Инфицирование клетки вирусом ведет
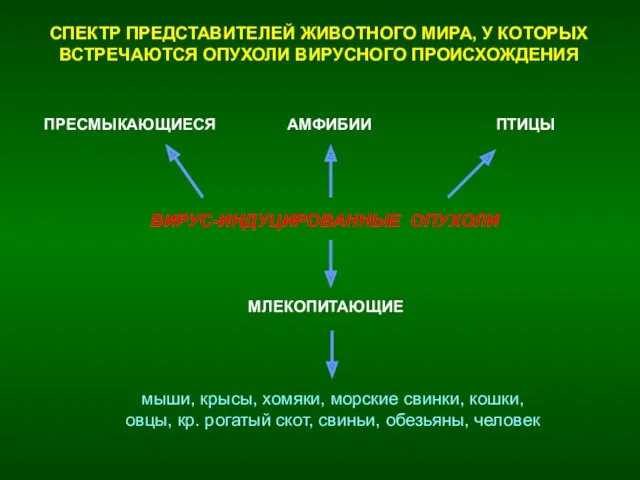
- 25. СПЕКТР ПРЕДСТАВИТЕЛЕЙ ЖИВОТНОГО МИРА, У КОТОРЫХ ВСТРЕЧАЮТСЯ ОПУХОЛИ ВИРУСНОГО ПРОИСХОЖДЕНИЯ ВИРУС-ИНДУЦИРОВАННЫЕ ОПУХОЛИ МЛЕКОПИТАЮЩИЕ ПРЕСМЫКАЮЩИЕСЯ АМФИБИИ ПТИЦЫ
- 26. Онкогенные вирусы 1. РНК-содержащие - подсемейство Oncovirinae сем. Retroviridae α-Retrovirus (вирусы лейкоза/саркомы птиц) β-Retrovirus (вирус рака
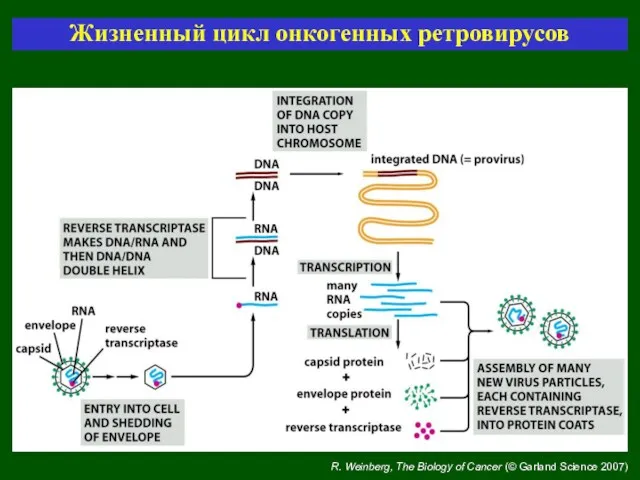
- 27. R. Weinberg, The Biology of Cancer (© Garland Science 2007) Жизненный цикл онкогенных ретровирусов
- 28. Ретровирусы: Присутствие онкогена Трансформация in vitro Медленно трансформирующие (длительный латентный период: у мышей и кур –
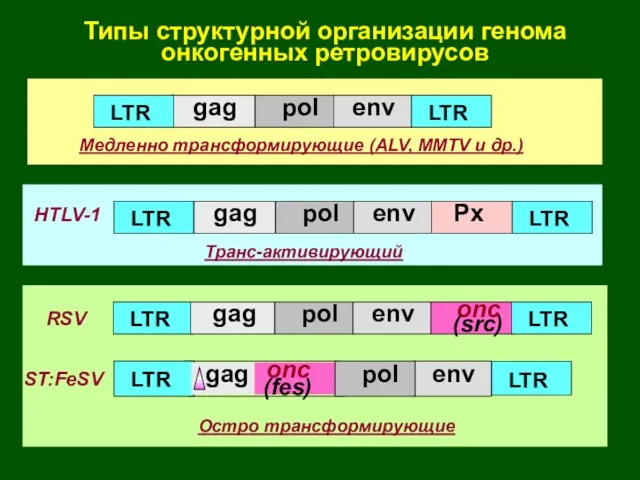
- 29. Типы структурной организации генома онкогенных ретровирусов onc (src) LTR LTR Px LTR LTR LTR gag LTR
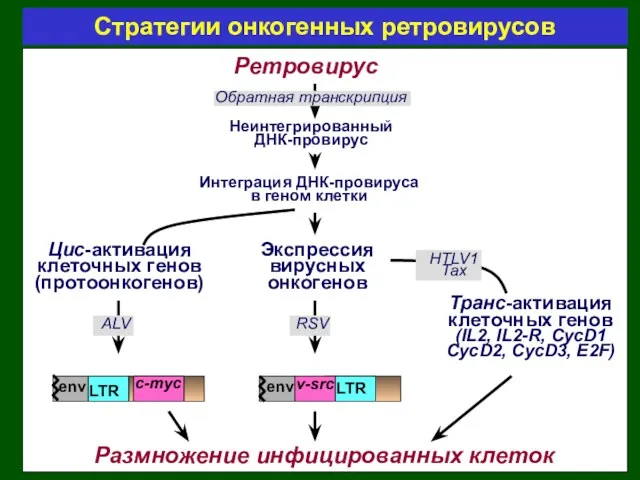
- 30. Ретровирус Неинтегрированный ДНК-провирус Интеграция ДНК-провируса в геном клетки Цис-активация клеточных генов (протоонкогенов) Транс-активация клеточных генов (IL2,
- 31. Онкогены ретровирусов невирусного происхождения: Идентифицировано >20 онкогенов, «захваченных» ретровирусами из клеток хозяина. Их прототипы – прото-онкогены,
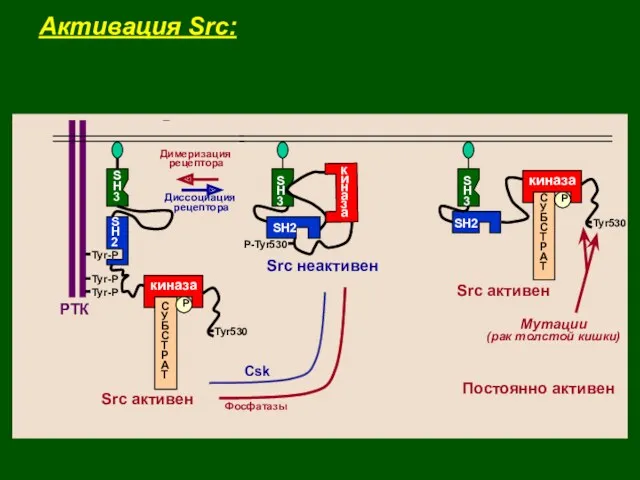
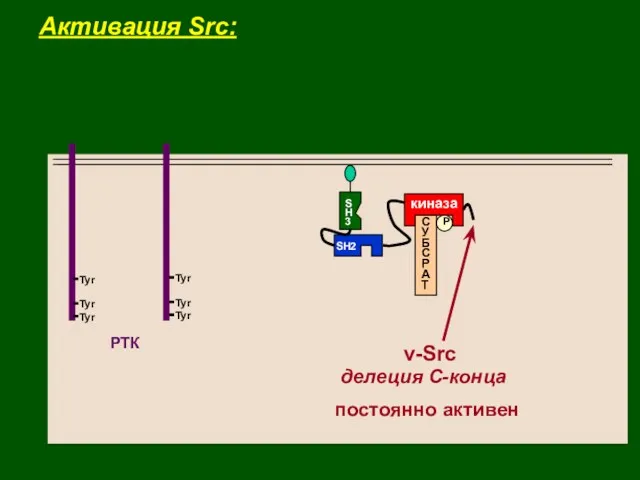
- 32. Активация Src: РТК Tyr Tyr Tyr Tyr Tyr Tyr
- 33. S H 3 P киназа С У Б С Р А Т SH2 v-Src постоянно активен
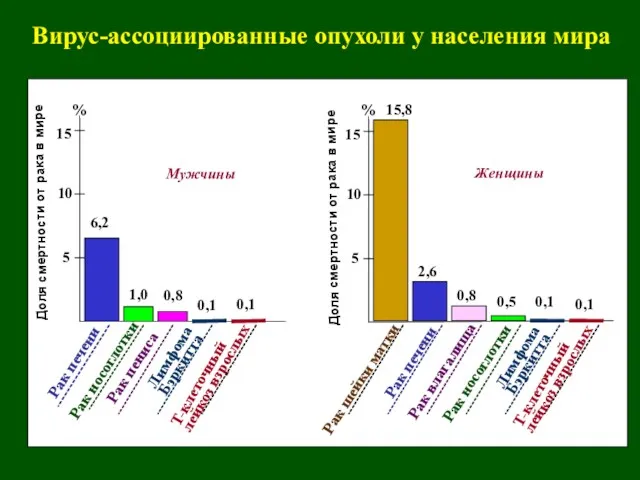
- 34. Вирус-ассоциированные опухоли у населения мира 5 10 15 Доля смертности от рака в мире 5 10
- 35. Для злокачественной трансформации инфицированных клеток необходимы дополнительные факторы и условия, ведущие к отбору опухолевого клона клеток
- 36. ДНК-содержащие Новообразования Вирус гепатита В (HBV) Рак печени Вирус папилломы (HPV) Рак шейки матки Вирус Эпштейна-Барр
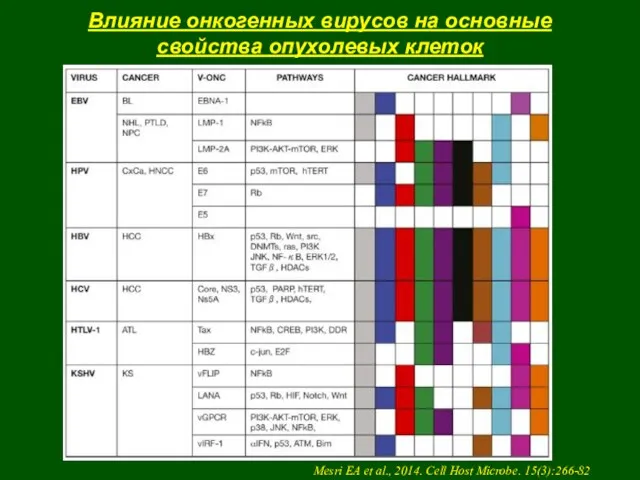
- 37. Влияние онкогенных вирусов на основные свойства опухолевых клеток Mesri EA et al., 2014. Cell Host Microbe.
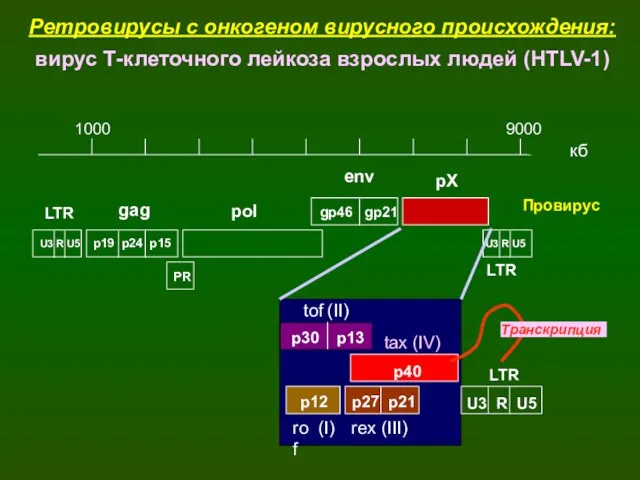
- 38. Ретровирусы с онкогеном вирусного происхождения: HTLV-1 (Human T-cell Leukemia Virus-1) – вирус Т-клеточного лейкоза взрослых людей
- 39. 1000 9000 кб U3 R U5 p19 p24 p15 PR LTR pol gp46 gp21 pX Провирус
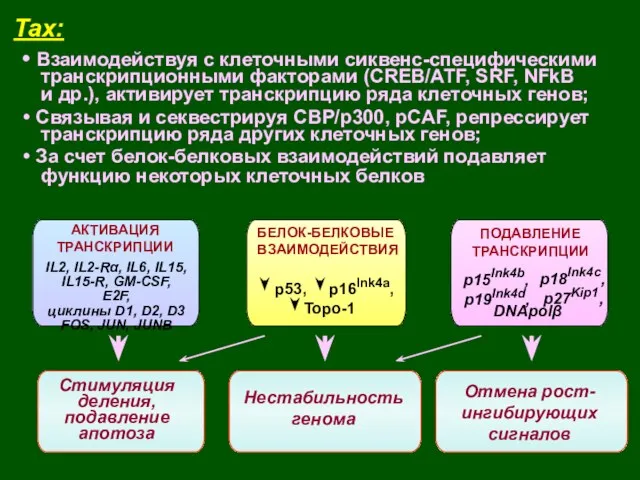
- 40. Tax: TRANCRIPTION ACTIVATION АКТИВАЦИЯ ТРАНСКРИПЦИИ TRANCRIPTION ACTIVATION БЕЛОК-БЕЛКОВЫЕ ВЗАИМОДЕЙСТВИЯ IL2, IL2-Rα, IL6, IL15, IL15-R, GM-CSF, E2F,
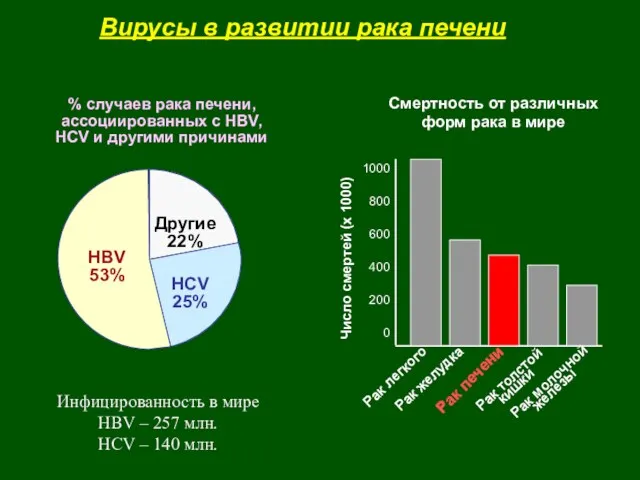
- 41. HBV 53% HCV 25% Другие 22% % случаев рака печени, ассоциированных с HBV, HCV и другими
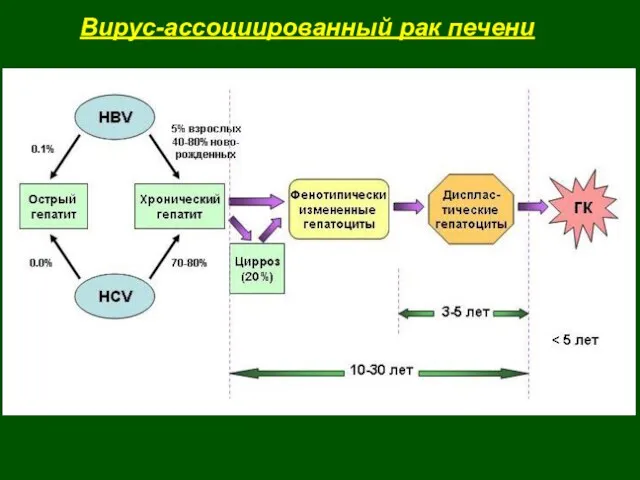
- 42. Вирус-ассоциированный рак печени
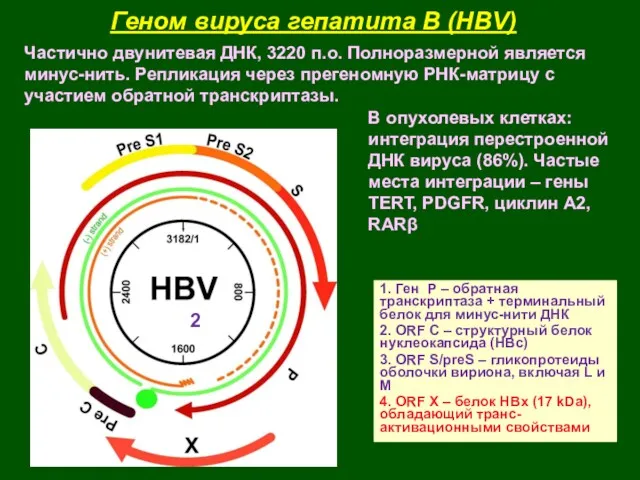
- 43. Геном вируса гепатита В (HBV) 1. Ген Р – обратная транскриптаза + терминальный белок для минус-нити
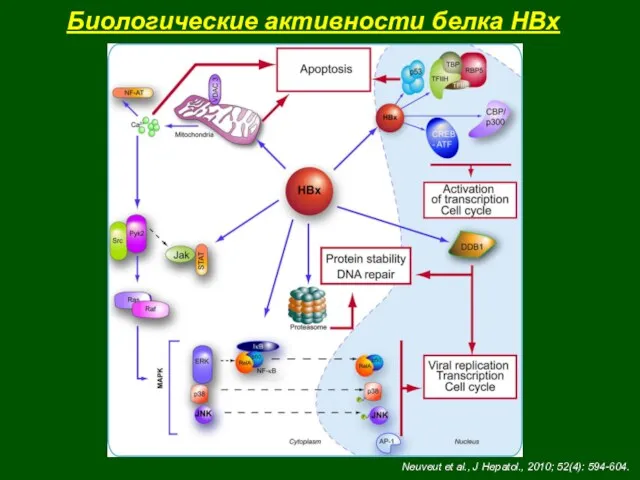
- 44. Биологические активности белка HBx Neuveut et al., J Hepatol., 2010; 52(4): 594-604.
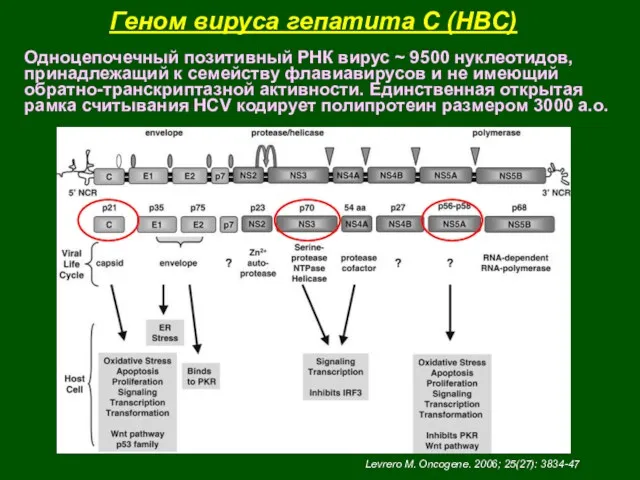
- 45. Геном вируса гепатита С (HBС) Одноцепочечный позитивный РНК вирус ~ 9500 нуклеотидов, принадлежащий к семейству флавиавирусов
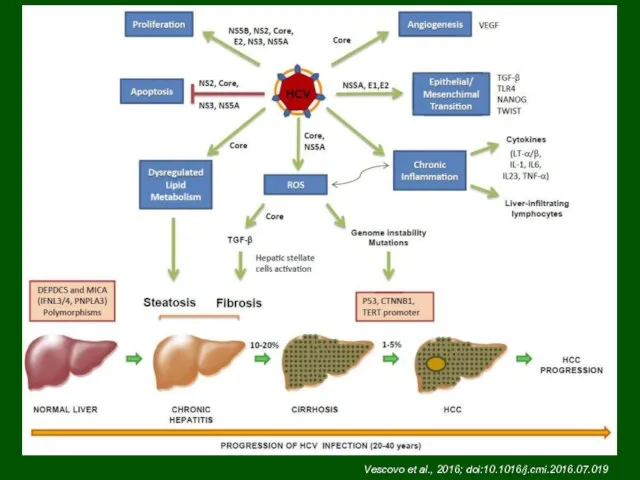
- 46. Vescovo et al., 2016; doi:10.1016/j.cmi.2016.07.019
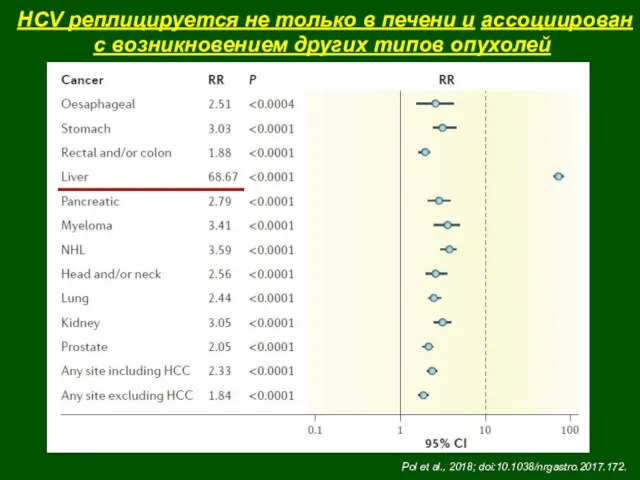
- 47. HCV реплицируется не только в печени и ассоциирован с возникновением других типов опухолей Pol et al.,
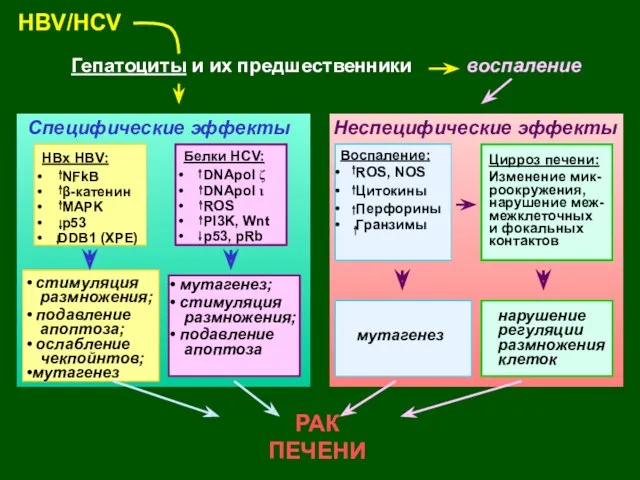
- 48. HBV/HCV Гепатоциты и их предшественники воспаление РАК ПЕЧЕНИ HBx HBV: NFkB β-катенин MAPK p53 DDB1 (XPE)
- 50. Скачать презентацию





















 Описание локального статуса хирургического больного
Описание локального статуса хирургического больного Превентивные мероприятия в ветеринарной практике
Превентивные мероприятия в ветеринарной практике Коагулограмма
Коагулограмма Диффузные болезни соединительной ткани у детей
Диффузные болезни соединительной ткани у детей Критические периоды в ходе онтогенеза человека. Пагубное влияние на развитие плода лекарственных препаратов, алкоголя, никотина
Критические периоды в ходе онтогенеза человека. Пагубное влияние на развитие плода лекарственных препаратов, алкоголя, никотина Вакцины в биотехнологии
Вакцины в биотехнологии Нехимические зависимости (аддикции)
Нехимические зависимости (аддикции) Екіншілік нейроинфекциялар
Екіншілік нейроинфекциялар Профилактикалық алгоритмдерді құрудың скринингтік бағдарламалардың нәтижелерін ендіру мен
Профилактикалық алгоритмдерді құрудың скринингтік бағдарламалардың нәтижелерін ендіру мен Гипотериоз. Этиология
Гипотериоз. Этиология Ваш путь к здоровью
Ваш путь к здоровью Воспалительные заболевания слуховой трубы
Воспалительные заболевания слуховой трубы Инфекционная безопасность профилактики профессионально обусловленных гемоконтактных инфекций у медицинских работников
Инфекционная безопасность профилактики профессионально обусловленных гемоконтактных инфекций у медицинских работников Дәрілік заттардың өзара әрекеттесуі
Дәрілік заттардың өзара әрекеттесуі Methods of examination in gynecology
Methods of examination in gynecology Физическое развитие детей. Центильные таблицы
Физическое развитие детей. Центильные таблицы Проведение профилактических медицинских осмотров целевых групп населения
Проведение профилактических медицинских осмотров целевых групп населения Современные материалы,используемые для первичной профилактики кариеса зубов детей и подростков
Современные материалы,используемые для первичной профилактики кариеса зубов детей и подростков Здоровое питание
Здоровое питание Плацентарная недостаточность. Синдром задержки развития плода
Плацентарная недостаточность. Синдром задержки развития плода Растительные антисептики и противовоспалительные средства
Растительные антисептики и противовоспалительные средства Клинические аспекты зависимостей
Клинические аспекты зависимостей Polyclinic’s work
Polyclinic’s work Сестринский уход при заболевания нервной системы
Сестринский уход при заболевания нервной системы Complicated cataract
Complicated cataract Возможности отделения физиотерапии и восстановительного лечения детской поликлиники №12. Санкт-Петербург
Возможности отделения физиотерапии и восстановительного лечения детской поликлиники №12. Санкт-Петербург Реактивный артрит
Реактивный артрит Невынашивание беременности
Невынашивание беременности