Содержание
- 2. Клинические исследования Клинические испытания
- 3. Национальный стандарт РФ Надлежащая клиническая практика (ГОСТ Р 52379-2005) клиническое испытание/исследование (clinical trial/study): Любое исследование, проводимое
- 4. Клинические исследования. Надлежащая клиническая практика (ГОСТ Р ИСО 14155-2014) Клиническое исcледование (clinical investigatigation): системное исследование с
- 5. Медицинские изделия любые инструменты, аппараты, приборы, оборудование, материалы и прочие изделия, применяемые в медицинских целях отдельно
- 6. Этические проблемы КИ: Права пациента и его безопасность Достоверность и значимость получаемой информации
- 7. Талидомидовая трагедия (1956-1962)
- 8. История трагедий 1937 год, Эликсир сульфаниламида Основа – диэтилен-гликоль (входит в состав атифриза)! Не был тестирован
- 9. История трагедий Медицинские эксперименты нацистов Врачи считали получаемые данные важными для науки Исследования инфицирования, воздействия ледяной
- 10. История трагедий Tuskegee Syphilis Study (US Public Health Service) Долговременное исследование (1930-1972) 400 черных мужчин Отсутствие
- 11. Местные аллергические реакции на латекс
- 12. Принятие Нюрнбергского кодекса. 1947 Нюрнбергский Кодекс обозначил обязательные требования для защиты интересов пациентов – участников клинических
- 13. Хельсинкская Декларация Всемирной Медицинской Ассоциации, 1964 Последняя редакция 2013 г
- 14. Стандарт Клинических Исследований, 1986 Целью GCP объявляются защита интересов пациентов- участников исследований и получение надёжных и
- 15. НАДЛЕЖАЩАЯ КЛИНИЧЕСКАЯ ПРАКТИКА СТАНДАРТ ПОДГОТОВЛЕН Ассоциацией международных фармацевтических производителей (AIPM), Международной конфедерацией обществ потребителей (КонфОП), Российской
- 16. НАДЛЕЖАЩАЯ КЛИНИЧЕСКАЯ ПРАКТИКА Настоящий стандарт идентичен Руководству по надлежащей клинической практике (Consolidated Guideline for Good Clinical
- 17. Надлежащая клиническая практика (Good Clinical Practice; GCP) представляет собой международный этический и научный стандарт планирования и
- 18. Клинические исследования. Надлежащая клиническая практика. ГОСТ Р ИСО 14155-2014 Заменил предыдущий Национальный стандарт РФ. Руководство по
- 19. ПРИНЦИПЫ НАДЛЕЖАЩЕЙ КЛИНИЧЕСКОЙ ПРАКТИКИ (GCP) Клинические исследования должны проводиться в соответствии с этическими принципами, заложенными Хельсинкской
- 20. Типы исследований эффективности вмешательств НЕКОНТРОЛИРУЕМЫЕ описание случая, серии случаев исследования взаимосвязей («поперечные») когортные исследования типа «случай
- 21. Научные исследования Для выдвижения гипотез (ПИЛОТНЫЕ) Для проверки гипотез (годятся только рандомизированные контролируемые исследования).
- 22. Многоцентровые исследования 50 стран
- 23. Информированное согласие Испытуемый информирован: о целях исследования о методах исследования о лекарственных средствах и режиме лечения
- 24. Протокол (protocol) или план клинического исследования (clinical investigation plan) Документ, который описывает цели, дизайн, методологию, статистические
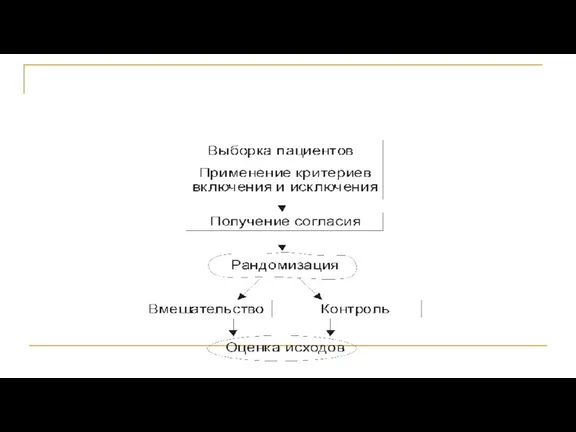
- 25. Выбор больных Критерии включения Критерии исключения
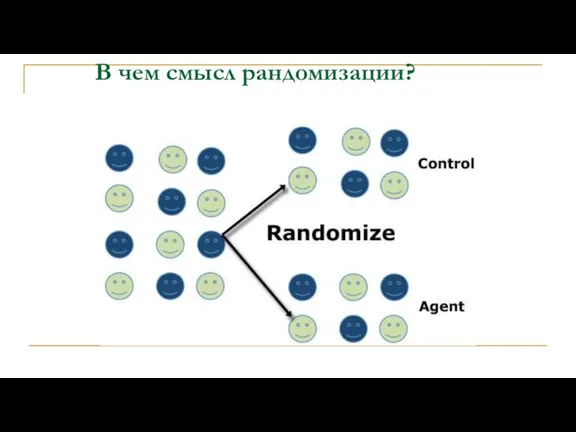
- 26. В чем смысл рандомизации?
- 28. Факторы, определяющие эффективность вмешательства
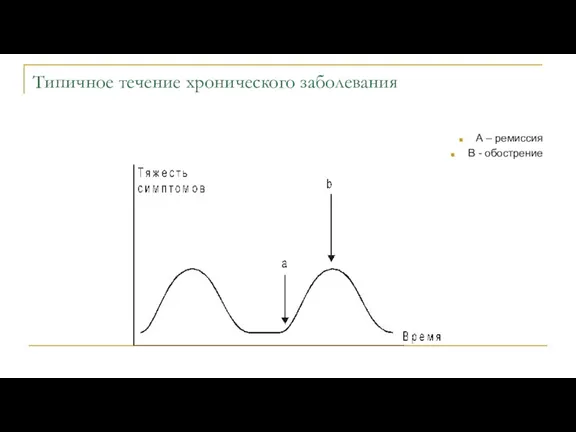
- 29. Типичное течение хронического заболевания А – ремиссия В - обострение
- 30. Пациент Собственное мнение Предпочтения Особенности восприятия
- 31. Клинический опыт и интуиция - необходимые составляющие врачебного искусства. Ни один клиницист не может иметь достаточного
- 32. Два объективных фактора, ограничивающих ценность врачебного опыта Определенный врач видит лишь определенный или «отобранный» контингент больных.
- 33. Факторы, определяющие эффективность вмешательства
- 34. Рандомизация (randomization) Процесс распределения субъектов исследования по группам лечения или контроля случайным образом, позволяющий свести к
- 35. Виды ослепления в РКИ Открытое рандомизированное исследование. Простое слепое рандомизированное исследование. Двойное слепое рандомизированное исследование. Тройное
- 36. Открытое РКИ
- 37. Простое слепое РКИ
- 38. Двойное слепое РКИ
- 39. Пероральный vs парентеральный препарат? Aктивный препарат Активный препарат Плацебо Плацебо VS
- 40. А медицинские изделия?
- 41. Статья 29 Хельсинской Декларации гласит: "Польза, риски, неудобства и эффективность нового метода должны оцениваться в сравнении
- 42. Наблюдение Нежелательные явления (серьезные и несерьезные) Нежелательное воздействия изделия Недостатки изделия Отклонения от протокола Конечные точки
- 43. Конечные точки Конечные точки - это параметры, которые будут оцениваться. Твердые конечные точки — это параметры,
- 44. Измерение QT Смерть vs
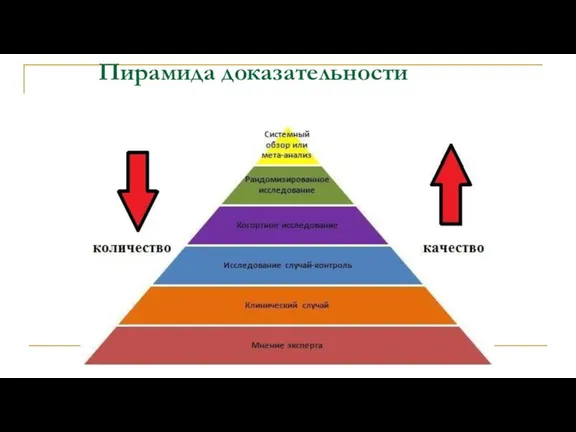
- 45. Пирамида доказательности
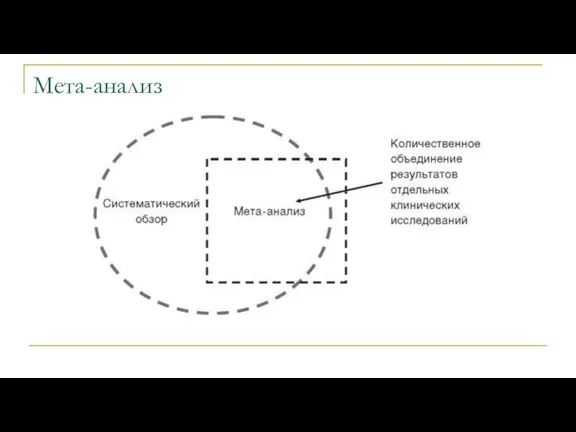
- 46. Мета-анализ
- 47. Death or MI (%) (-) A A A ASA better Pl. better 0.41 Meta-analysis Antiplatelets :
- 48. Классы рекомендаций I класс – польза >>> риск, должно быть выполнено IIа класс – польза>>риск, целесообразно
- 49. Уровни доказательности
- 50. Комитета по этике IRB#: IRB00005197 FWA#: FWA00009567 при ГБОУ ВПО «Саратовский государственный медицинский университет им. В.И.
- 51. Порядок работы этического комитета регламентируется: Конституцией РФ; Хельсинской декларацией Всемирной Медицинской Ассоциации 1964 г. и ее
- 52. Порядок работы этического комитета регламентируется (продолжение): Приказом Минздрава СССР «О мерах по дальнейшему совершенствованию организационных форм
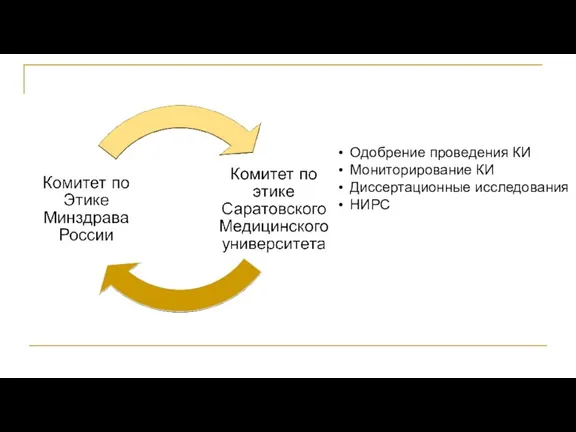
- 53. Одобрение проведения КИ Мониторирование КИ Диссертационные исследования НИРС
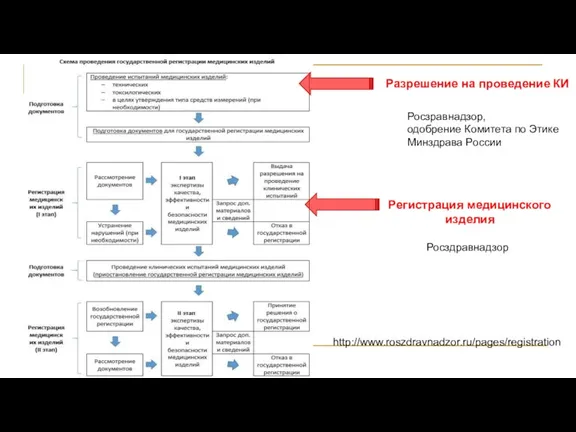
- 54. http://www.roszdravnadzor.ru/pages/registration Разрешение на проведение КИ Регистрация медицинского изделия Росзравнадзор, одобрение Комитета по Этике Минздрава России Росздравнадзор
- 55. Основные замечания и причины отказа в одобрении НИР Комитетом по Этике СГМУ: Использование медицинских изделий не
- 56. Основные замечания и причины отказа в одобрении НИР комитетом по Этике СГМУ: Отсутствие подробного описания исследуемых
- 57. Уинстон Черчиль Democracy is the worst form of government, except all the others that have been
- 59. Скачать презентацию

















































 Наркомания и ее вред
Наркомания и ее вред Автономная нервная система (вегетативная, висцеральная). Парасимпатический отдел
Автономная нервная система (вегетативная, висцеральная). Парасимпатический отдел Пневмоцистоз у детей
Пневмоцистоз у детей Пневмония у детей. Этиология. Принципы лечения
Пневмония у детей. Этиология. Принципы лечения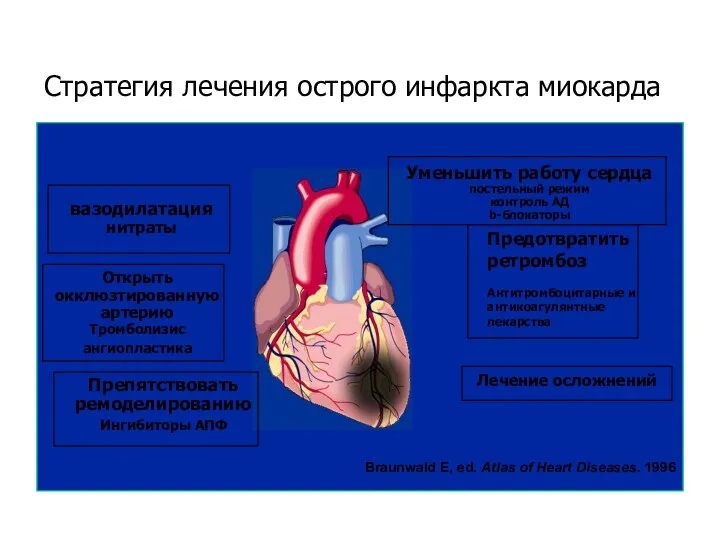 Стратегия лечения острого инфаркта миокарда
Стратегия лечения острого инфаркта миокарда Витамины и биостимуляторы
Витамины и биостимуляторы Метод использования виртуальной реальности для коррекции осанки у детей с синдромом гипермобильности суставов
Метод использования виртуальной реальности для коррекции осанки у детей с синдромом гипермобильности суставов Пломбировочные материалы в стоматологии
Пломбировочные материалы в стоматологии Опухоли
Опухоли Миокардит
Миокардит Современные шкалы в оценке тяжести хирургических больных с SIRS
Современные шкалы в оценке тяжести хирургических больных с SIRS Нагрузочные ЭКГ тесты. Тредмил тест
Нагрузочные ЭКГ тесты. Тредмил тест Лечение пациентов детского возраста. Болезни детей старшего возраста. Бронхиальная астма
Лечение пациентов детского возраста. Болезни детей старшего возраста. Бронхиальная астма Болезни молодняка раннего пренатального и постнатального периода. Диспепсия телят и поросят
Болезни молодняка раннего пренатального и постнатального периода. Диспепсия телят и поросят Комплекс сердечно-легочной реанимации, показания к ее проведению и критерии эффективности
Комплекс сердечно-легочной реанимации, показания к ее проведению и критерии эффективности Зәр шығару жүйесінің сәулелік диагностика әдістері
Зәр шығару жүйесінің сәулелік диагностика әдістері Бомбочки для ванн
Бомбочки для ванн :Остеомиелит
:Остеомиелит Лучевая диагностика костно-суставной системы
Лучевая диагностика костно-суставной системы Особенности реабилитации пациентов с туберкулезом легких
Особенности реабилитации пациентов с туберкулезом легких Кожная пластика
Кожная пластика Иммунология
Иммунология Общие принципы диагностики
Общие принципы диагностики Род Staphylococcus (Стафилококки)
Род Staphylococcus (Стафилококки) Иммобилизация. Правила наложения шин
Иммобилизация. Правила наложения шин Методы анализа лекарственных средств
Методы анализа лекарственных средств Гипертоническая болезнь
Гипертоническая болезнь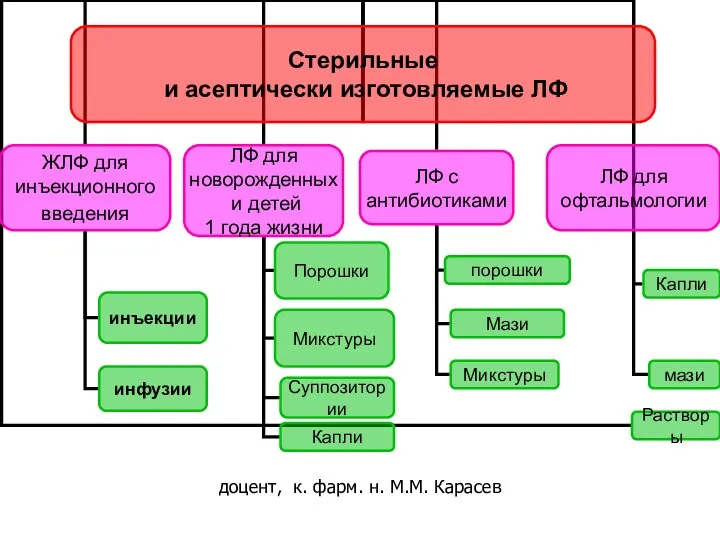 Стерильные и асептически изготовляемые ЛФ
Стерильные и асептически изготовляемые ЛФ