Содержание
- 2. Клинико-лабараториялық зерттеу кезеңі Преаналитикалық(дәрігердің анализді тағайындағаннан биологиялық материалдың лабараторияға жеткенге дейін, анализді дайындау) Аналитикалық( биоматериалды зерттеу,
- 3. Преаналитикалық кезең Науқасты зерттеуге дайындау (тамқтану, физикалық эмоциональді жүктеме, дене қалпы т.б) Материалды жинау және сақтау(антикоагулянттарды
- 4. Жоспарлы ЖҚА алуы кезіндегі шарттар: Аш қарынға (12 сағат тағамданбағаннан кейін, алкоголь мен шылым шекпеу), Таңғы
- 5. Жалпы анализге қан алу Капиллярлы қан Тұрақталған қанды бір пробиркаға алу Венозды қан Қанды тұрақтамай алу
- 6. Жалпы анализге қан алу Венозды қан алу тиімділігі Стабилизатор ретінде калий тұздарын қолдану ЭДТА (К2ЭДТА немесе
- 7. Қан алу Қан құю кезінде инеде қысым пайда болады, гемолиз болу ықтималдылығы, және ыдырауы мүмкін Қан
- 8. Венозды қан Пробирка толу ережелері: Антикоагулянтсыз қан-сарысу алу үшін, биохимиялық және серологиялық зерттеу үшін Қан нитратпен-плазма
- 9. Капиллярлы қан Капиллиярлы қанды келесі жағдайда алу қажет: Күйік кезінде, тері аумағында ауру сезімдері бар жағдайда
- 10. Жеткізу және сақтау Қанды мұздатуға болмайды. Бөлме температурасында сақтау қажет ЭДТА капиллиярлы қанды бөлме температурасында және
- 11. Аналитикалық кезең Дозалаудағы қателіктер Өлшегіш приборлардағы қателіктер, реактив сапасының нашарлығы Ескі әдістерді қолдану Төмен біліктілік және
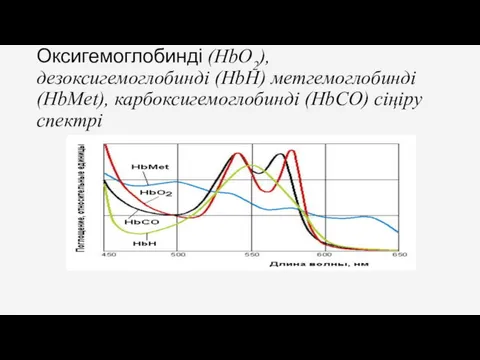
- 12. Оксигемоглобинді (HbO2), дезоксигемоглобинді (HbН) метгемоглобинді (HbMet), карбоксигемоглобинді (HbCO) сіңіру спектрі
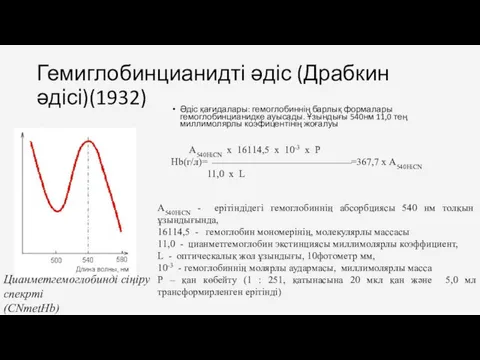
- 13. Гемиглобинцианидті әдіс (Драбкин әдісі)(1932) Әдіс қағидалары: гемоглобиннің барлық формалары гемоглобинцианидке ауысады. Ұзындығы 540нм 11,0 тең миллимолярлы
- 14. Гемихромды әдіс Әдіс қағидалары: Драбкин әдісне ұқсас, бірақ аударуда соңғы реакция жоқ- HbMet мен CNmetHb Ең
- 15. Аммиак әдісі(Дервиза-Воробьваның модифицирленген әдісі) Әдіс қағидалары: қан пробаларының аммиактың 0,04% ерітіндісінде араластырылады. (әртүрлі гемоглобиннің туындылары) Оптималды
- 16. Гемоглобин өлшеудегі мүмкін болатын қателер Гиперлипидемия, гипербилирубинемия, криоглобулинемия кезіндегі қан сарысуының тұнуы және т.б. Стабильді емес
- 17. Хилезді сынамадағы гемоглобин концентрациясының өлшеу кезіндегі қателер
- 18. ЭЖТ анықтаудағы қателіктердің негізі Зерттелетін қан бөлме температурасында болса, ЭЖТ қан алғаннан кейін 2 сағат өту
- 19. Эритроциттер мен лейкоциттердің санының өлшеуінің унифицирленген әдістері: Горяев камерасы Автоматтандырылған гематологиялық анализатор Тромбоциттер санының өлшеуінің унифицирленген
- 20. Горяев камерасында эритроциттарды есептеу кезіндегі қателердің негізі: Пипеткаға қанның дұрыс алынбауы Ұйып қалу, жасушалардың бір бөлігін
- 21. Лейкоциттердің камерадағы саналуының негізгі қателіктері: Қан мен сірке қышқылының арақатынасының қате болуы Дұрыс дайындалмаған сірке қышқылы
- 22. Біз қан анализін жеңіл, тез, сенімді істейміз. Науқас максималды пайдада болады. Coulter W.H. Coulter Jr.»
- 23. Кондуктометрлік әдістің принципі Сенімді нәтижені алу шарттары Датчик каналында әрдайым бір жасушадан көп болмауы тиіс. Сынамада
- 24. Тромбоцитопоэздың бағалануы PLT (platelet) тромбоциттер саны 180-320 х 109/л MPV (mean platelet volume) тромбоциттердің орташа көлемі
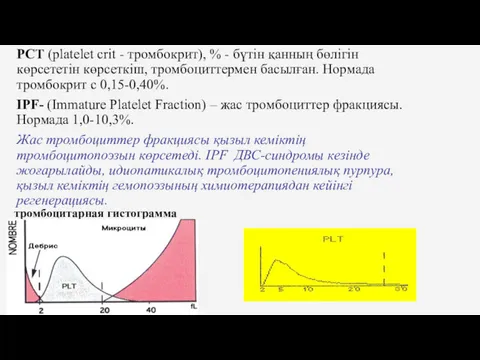
- 25. PCT (platelet crit - тромбокрит), % - бүтін қанның бөлігін көрсететін көрсеткіш, тромбоциттермен басылған. Нормада тромбокрит
- 26. Тромбоцитарлы гистограммалардың өзгеруі Тромбоцитарлы гистограмма базисты сызықта бітпейді. Тромбоциттер популяциясы эритроциттер популяциясынан анық ажыратылмайды. Мүмкін себептер:
- 27. Өлшеудің мүмкін қателері Жалған жоғарылауы Жалған төмендеуі Микроцитоз Криоглобулинемия Гемолизденген қан үлгілері Эритроциттер және лейкоциттер фрагменттер
- 28. Лейкопоэз бағалау WBC (white blood cells) CVавт. - 1-3%, CVруч. - 6,5-15% ( в зависимости от
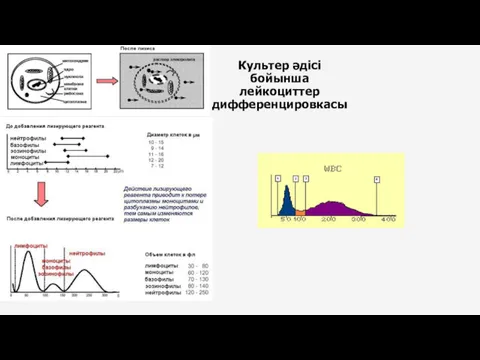
- 29. Культер әдісі бойынша лейкоциттер дифференцировкасы
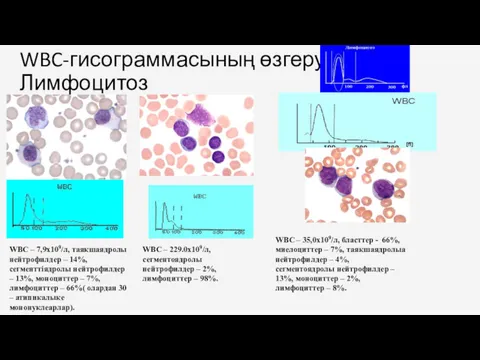
- 30. WBC-гисограммасының өзгеруі.Лимфоцитоз WBC – 7,9х109/л, таяқшаядролы нейтрофилдер – 14%, сегменттіядролы нейтрофилдер – 13%, моноциттер – 7%,
- 31. WBC-гисограмма өзгеруі.Нейтрофилез Лейкоцитарлы гистограмма перифериялық қанның лейкоцитозы бар науқаста (13,1х109/л) және таяқшаядролы шегіну (11%). WBC –
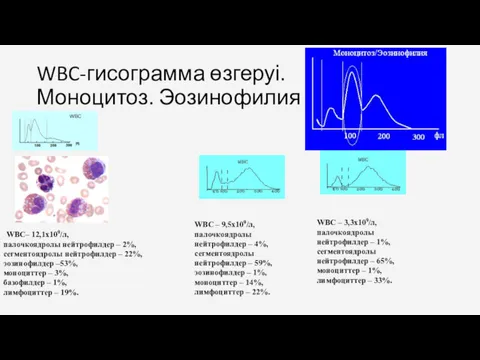
- 32. WBC-гисограмма өзгеруі. Моноцитоз. Эозинофилия . WBC– 12,1х109/л, палочкоядролы нейтрофилдер – 2%, сегментоядролы нейтрофилдер – 22%, эозинофилдер
- 33. Өлшеудегі мүмкін қателер Лейкоциттердің санының автоматты анализ кезінде жалған жоғарылауы қанда: ядролы қызыл жасушалар әлде лизиске
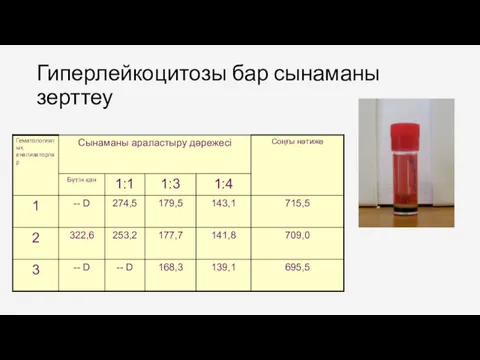
- 34. Гиперлейкоцитозы бар сынаманы зерттеу
- 35. Постаналитикалық период Зерттеу нәтижелерінің қате интерпритациясы себебі: Гипер әлде гопиволемия Фармакотерапия әсері (дәрілік препараттардың интерференциясының нәтижесі
- 36. Сапа тексерісі (СТ) – өлшеу системасы, сандық бағалау дәлдігіне бағытталған, лабораториялық зерттеудің көрінісі және дұрыстығы Негізі
- 37. Сапа тексерісі болу керек: Систематикалық(ереже бойынша), күнделіктер – контрольды сынама анализі лабораторияның әдетті жұмысына кіру қажет.
- 38. Сапа тексерісінің ішкі және сыртқы негізгі сипаттамалары
- 39. Ішкі лабораториялық зерттеудің сапасын тексеру әдістері Контрольды материальдарды қолдану әдістері Науқас мәліметтерін қолдану әдістері 1. Контрольды
- 40. Гематологиялық зерттеудегі контрольді материалдардың түрлері
- 41. Проведение ВнуКК включает 3 этапа: 1. Оценка сходимости, которая выполняется при введении новых методик и при
- 42. Есепті алу кезінде қолданады: 1-2ші кезең-стандартты орнатылған қате, қан көрсеткіші бойынша, сарысу, зәр 3кезең-орындалған стандартты бақылау
- 43. 10 өлшем нәтижесін бір материалда және бір аналитикалық серияда нәтижесін анықтау. 10нәтиже бойынша Ішкібөлімді орындау әдісінің
- 44. Ортаквадраттық ауытқулар Х-орташа арифметикалық n нәтиже өлшем нәтижесі N-өлшем саны
- 45. Ішкібөлімді орындау әдісінің есептік көрсеткіші Х = 1398 : 10 = 139,8 ≈140 S = √16:9
- 46. Ішкібөлімді орындау әдісін бағалау Ішкібөлімді вариация әдісі орнатылған нормаға жауап береді, егер теңсіздігі: CV10-10өлшемге тең жалпы
- 47. 10күн бойы екі(қалыпты немесе патологиялық) соңғы нәтижелі материал көрсеткіші (әр күні 1рет өлшеу) 10өлшем нәтижесіне қарай
- 48. Ауыстыруды және жалпы аналитикалық коэффицент вариациясының әдісін бағалау Келесілермен салыстырады В10 жәнеCV10 мүмкін болатын нәтижелер №45
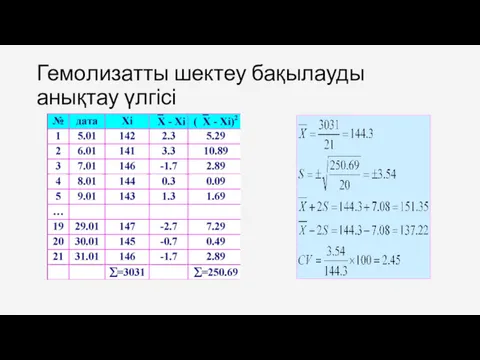
- 49. Гемолизатты шектеу бақылауды анықтау үлгісі
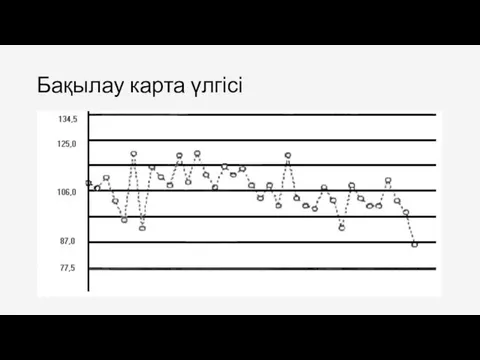
- 50. Бақылау карта үлгісі
- 51. Бір реттік бақылау нәтижесі Х±2S Тен шығады Жалғасқан келесі нәтижелерді бакылау Болмаған жағдайда серияны болдымауға әсері
- 52. Бір ғана бақылау нәтижесі Х±3S тен асады Аналитикалық серия қанағаттанбайды Кездейсок немесе жүйелі қателікті іздеу Westgard
- 53. Ең соңғы екі өлшем Х+2Sдан үлкеюі немесе Х−2S тен томен болуы Аналитикалық серия қанағаттанбайды Жүйелі қателікті
- 54. Екі бақылау өлшемі әр түрлі жерде орналасқан болады Х±2S Аналитикалық серия қанағаттанбайды. Кездейсоқ қате нәтиже Westgard
- 55. Төрт бақылау өлшемі Х+1S ке көбейеді немесе Х−1S тен төмен жатады Аналитикалық серия қанағаттанбайды. Әрқашан жүйелі
- 56. Westgard бақылау ережесі Он бақылау өлшемі Х біржақты сызықта реттеледі. Аналитикалық серия қанағаттанбайды. Әрқашан жүйелі қателік
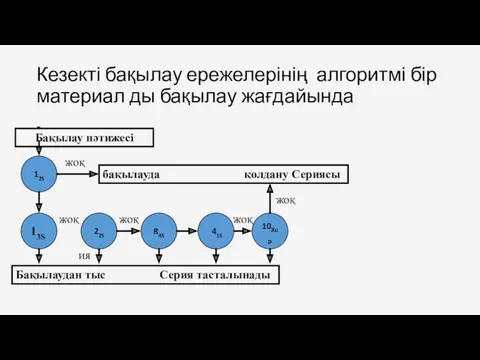
- 57. Кезекті бақылау ережелерінің алгоритмі бір материал ды бақылау жағдайында - Бақылау нәтижесі 12S бақылауда қолдану Сериясы
- 58. Дубликатпен бақылауды орындау әдісі 20сынама алынады, және параллелді турде талданады Әр сынамада салыстырмалы сыпырылуы есептеледі біріншілік
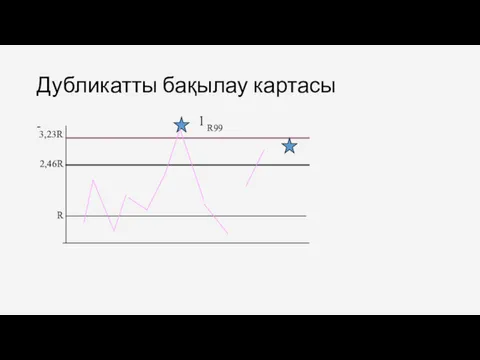
- 59. Дубликатты бақылау картасы - R 2,46R 3,23R 1 R99
- 60. Талданатын контингент біртекті болуы тиіс Тексерілген контингентті ауыстыру кезінде сол кунгі нәтиже есептелмейді Тіпті бір ғана
- 61. Әр күндік орташа дұрыстықты бақылау Орташа диапазон улкеймеуі немесе тарылмауы тиіс(әдіс сезімталдығы төмендейді) Нәтижелердің әр күндік
- 62. Дұрыс жасалынуын бақылау: Егер бақылау нәтижесі ± 2S тен ауытқыса Жаңа әдісті дұрыстау кезінде Жаңа өлшегіш
- 63. Лорда тесті Х –аналитикалық бөлімнің орташа арифметикалық олшем бірлігі Хmax-аналитикалық серияның максималді нәтижесі Хmin-аналитикалық серияның минималді
- 64. Криоглобулинемия кезіндегі жоғары нәтиже беретін қателіктер; гигант тромбоциттердің қатысуы; гиперлейкоцитозда (>100х109/л); Төменгі нәтиже беретін қателіктер эритроциттердің
- 65. Гемоглобин концентрациясының жоғарылауы эритроциттің ісігінде, сусыздануда байқалады Гемоглобин концентрациясының төмендеуі анемияда,гипергидратацияда байқалады Эритропоэзді бағалау HGB (Hb)
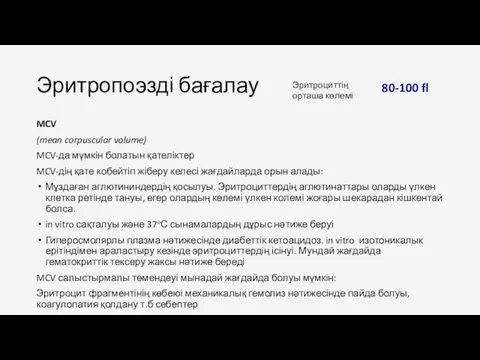
- 66. Эритропоэзді бағалау MCV (mean corpuscular volume) MCV-да мүмкін болатын қателіктер MCV-дің қате кобейтіп жіберу келесі жағдайларда
- 67. Эритропоэзді бағалау
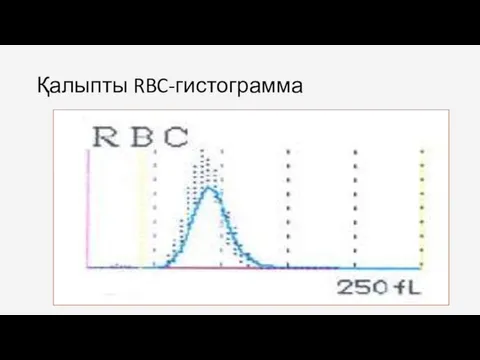
- 68. Қалыпты RBC-гистограмма
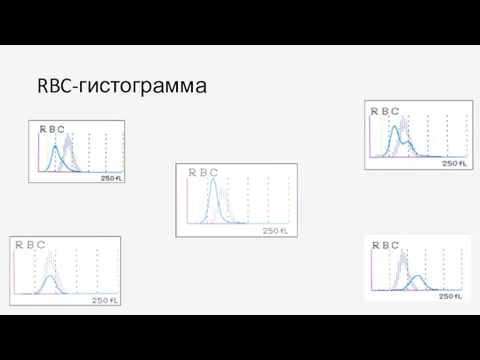
- 69. RBC-гистограмма
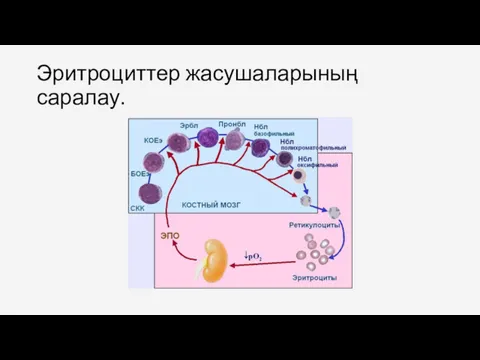
- 71. Эритроциттер жасушаларының саралау.
- 72. Ретикулоциттерді зерттеу үшін қолданылады: гемолиз немесе қан жоғалту сүйемелдеуімен мемлекетте эритропоэз қызмет, бағалау; темір тапшылығы, В12
- 73. Ретикулоциттер. (RET) Норма 0,5-1,2%
- 74. Ретикулоциттерді өзгерту санау ·коэффициенті RET% 9% 1% (CV%) 27,2 47,3 Гематологиялық анализаторлар (CV%) 5,8 6,4
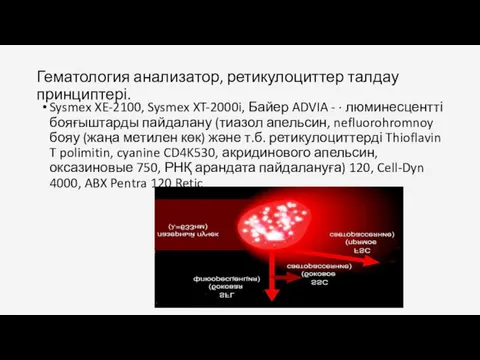
- 75. Гематология анализатор, ретикулоциттер талдау принциптері. Sysmex XE-2100, Sysmex XT-2000i, Байер ADVIA - · люминесцентті бояғыштарды пайдалану
- 76. Ретикулоциттердің көрсеткіштері. RET% - ретикулоцитов салыстырмалы саны; RET # - абсолютті ретикулоцитов · Көлемі: МСВ -
- 77. Ретикулоциттердің көрсеткіштері. ретикулоциттердің өсу дәрежесін сипаттайтын: LFR% (87-99% зрелых RET), MFR% (2-12%), HFR% (1-2%); IRF (Immature
- 78. Кейбір гематологиялық аурулар кезіндегі ретикулоциттердің өзгерісі.
- 79. Ретикулоциттердегі гемоглобин құрамын көрсететін көрсеткіштері.
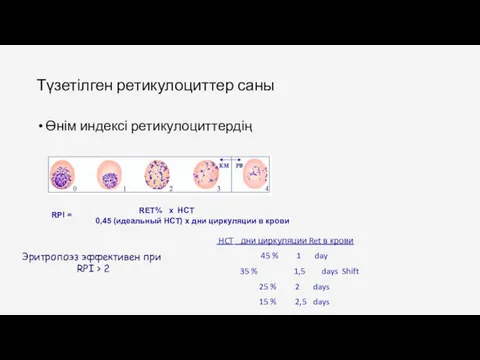
- 80. Түзетілген ретикулоциттер саны Өнім индексі ретикулоциттердің RPI = RET% x HCT 0,45 (идеальный HCT) x дни
- 81. Өнім индексі ретикулоциттердің.
- 82. гемоглобинометрияныңБасқа әдістері Геминхлоридті әдіс Қателердің негізгі себептері: Гемоглобин және тұз қышқылының арасындағы реакция туралы плазма белоктарының
- 84. Скачать презентацию
































































 Компоненты и основные этапы общей анестезии. Классификация видов обезболивания
Компоненты и основные этапы общей анестезии. Классификация видов обезболивания Хирургическая рана. Процесс заживления раны и его нарушения
Хирургическая рана. Процесс заживления раны и его нарушения Жоғарғы тыныс жолдарының аурулары. Ринит. Трахеит. Ларингит
Жоғарғы тыныс жолдарының аурулары. Ринит. Трахеит. Ларингит Заболевания желудка и двенадцатиперсной кишки. Лекция №3
Заболевания желудка и двенадцатиперсной кишки. Лекция №3 Колоректальный рак
Колоректальный рак Наркотики и беременность
Наркотики и беременность Көктамырға егу жасау техникасы жəне қан алу
Көктамырға егу жасау техникасы жəне қан алу Анестезиология и реаниматология. Введение в дисциплину
Анестезиология и реаниматология. Введение в дисциплину Терморегуляция организма. Закаливание
Терморегуляция организма. Закаливание Психотропные средства. Нейролептики. Транквилизакторы. Седативные средства
Психотропные средства. Нейролептики. Транквилизакторы. Седативные средства Папулосквамозні та бульозні дерматози
Папулосквамозні та бульозні дерматози Атопический дерматит
Атопический дерматит Гормоны
Гормоны Синдром эмоционального выгорания. Распространенность синдрома
Синдром эмоционального выгорания. Распространенность синдрома Травматизм. Виды травматизма. Травматический токсикоз. Травмы головы, груди, живота
Травматизм. Виды травматизма. Травматический токсикоз. Травмы головы, груди, живота Функциональные пробы и тесты, применяемые для оценки функционального состояния организма
Функциональные пробы и тесты, применяемые для оценки функционального состояния организма Основы эпидемиологии, инфекционные заболевания
Основы эпидемиологии, инфекционные заболевания Бактериальный вагиноз при беременности
Бактериальный вагиноз при беременности Ас қорыту жүйесі. Сүт тістерінің құрылыс ерекшелігі. Тіс алмасу
Ас қорыту жүйесі. Сүт тістерінің құрылыс ерекшелігі. Тіс алмасу Балалардағы хейлиттер
Балалардағы хейлиттер Миома матки
Миома матки Предмет и задачи патофизиологии
Предмет и задачи патофизиологии Процессы адаптации и компенсации. Регенерация и репарация. Склероз
Процессы адаптации и компенсации. Регенерация и репарация. Склероз Хроническая обструктивная болезнь легких
Хроническая обструктивная болезнь легких Одонтогенные флегмоны челюстно-лицевой области
Одонтогенные флегмоны челюстно-лицевой области Основные законы гемодинамики и их математическое выражение
Основные законы гемодинамики и их математическое выражение Weight Loss Challenge. Бросьте вызов лишнему весу. Углеводы, сахар и гликемический индекс
Weight Loss Challenge. Бросьте вызов лишнему весу. Углеводы, сахар и гликемический индекс Рак мочевого пузыря
Рак мочевого пузыря