Содержание
- 2. Определения. РЦРЗ (Республиканский центр развития здравоохранения МЗ РК) Версия: Клинические протоколы МЗ РК – 2018: Рассеянный
- 3. Клинические формы. В настоящее время не принято традиционное выделение клинических форм РС, основанное на ведущих проявлениях
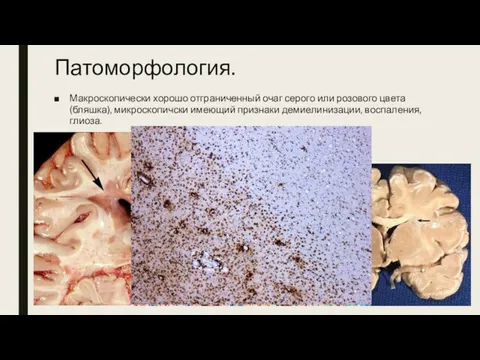
- 4. Патоморфология. Макроскопически хорошо отграниченный очаг серого или розового цвета (бляшка), микроскопичски имеющий признаки демиелинизации, воспаления, глиоза.
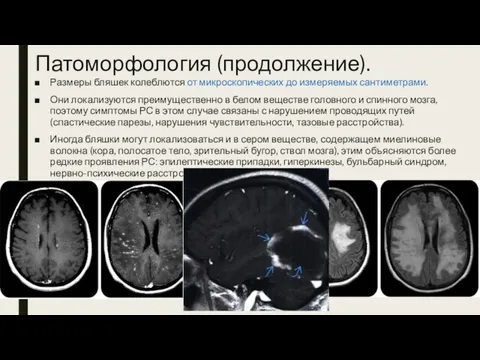
- 5. Патоморфология (продолжение). Размеры бляшек колеблются от микроскопических до измеряемых сантиметрами. Они локализуются преимущественно в белом веществе
- 6. Этиология. Этиология РС остается неясной до сих пор, но существует ряд предположений о внешних факторах, предрасполагающих
- 7. Генетическая предрасположенность. Встречаемость РС разная в пределах одной климатической зоны (например, в Сицилии в 10 раз
- 8. Положение о полигенной основе предрасположенности к РС. Генотип больных складывается из множества независимых или взаимодействующих генов,
- 9. Роль вирусов в возникновении РС. У лиц, переболевших инфекционным мононуклеозом, вызванным вирусов Эпштейна-Барр, риск развития РС
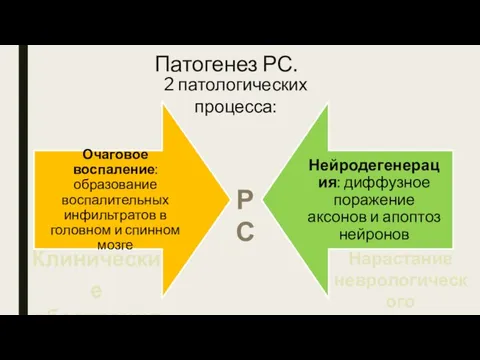
- 10. Патогенез РС. 2 патологических процесса: Клинические обострения Нарастание неврологического дефицита РС
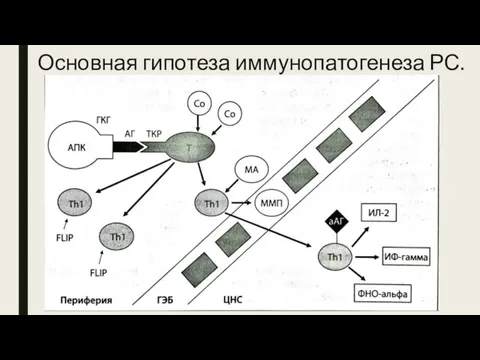
- 11. Основная гипотеза иммунопатогенеза РС. Активация (сенсибилизация) Т-лимфоцитов в периферической крови (не в мозге!), в результате которой
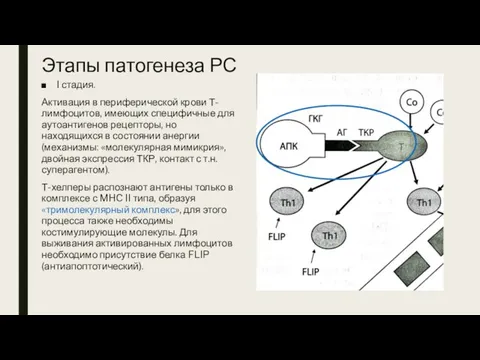
- 12. Этапы патогенеза РС I стадия. Активация в периферической крови Т-лимфоцитов, имеющих специфичные для аутоантигенов рецепторы, но
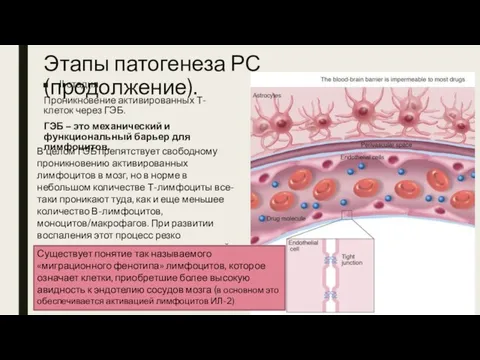
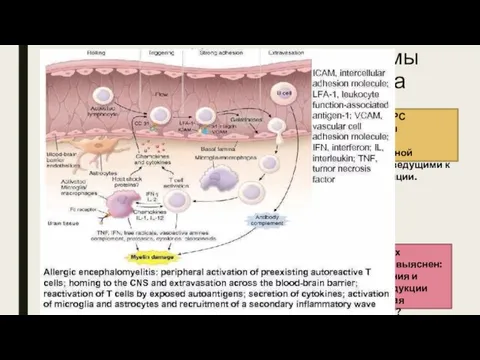
- 13. Этапы патогенеза РС (продолжение). II стадия. Проникновение активированных Т-клеток через ГЭБ. ГЭБ – это механический и
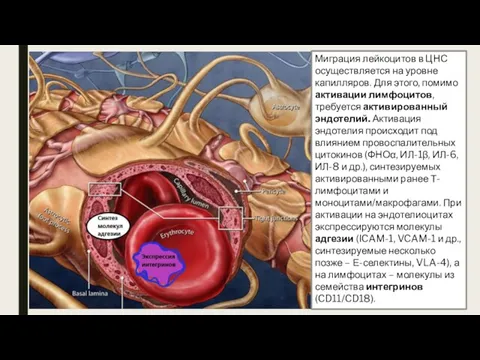
- 14. Миграция лейкоцитов в ЦНС осуществляется на уровне капилляров. Для этого, помимо активации лимфоцитов, требуется активированный эндотелий.
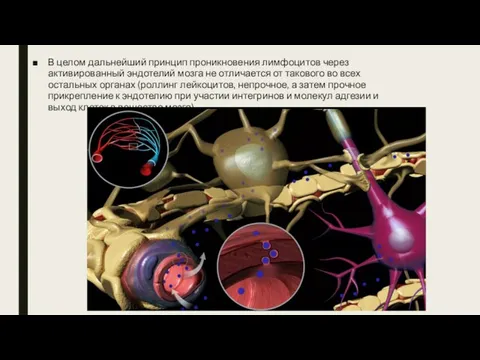
- 15. В целом дальнейший принцип проникновения лимфоцитов через активированный эндотелий мозга не отличается от такового во всех
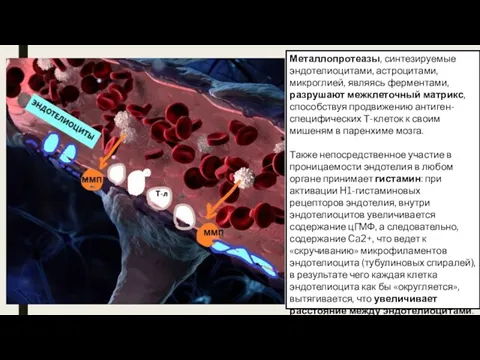
- 16. Металлопротеазы, синтезируемые эндотелиоцитами, астроцитами, микроглией, являясь ферментами, разрушают межклеточный матрикс, способствуя продвижению антиген-специфических Т-клеток к своим
- 17. Этапы патогенеза РС (продолжение). III стадия. Т-лимфоциты, мигрировавшие в воспалительный очаг мозга, остаются в периваскулярной области
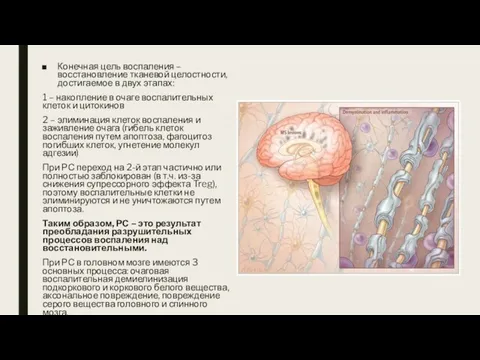
- 18. Конечная цель воспаления – восстановление тканевой целостности, достигаемое в двух этапах: 1 – накопление в очаге
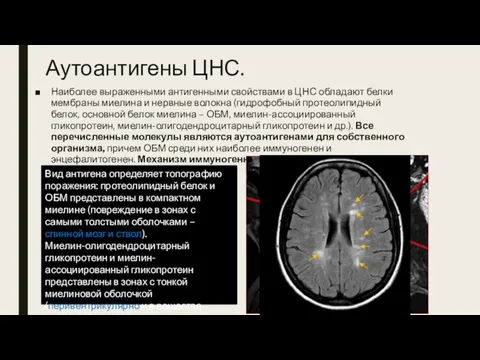
- 19. Аутоантигены ЦНС. Наиболее выраженными антигенными свойствами в ЦНС обладают белки мембраны миелина и нервные волокна (гидрофобный
- 20. Иммунные механизмы разрушения миелина 1) Воспалительная аутоиммунная демиелинизация, обусловленная цитотоксическими веществами Th-лимфоцитов 2) Антитела, выделенные В-лимфоцитами
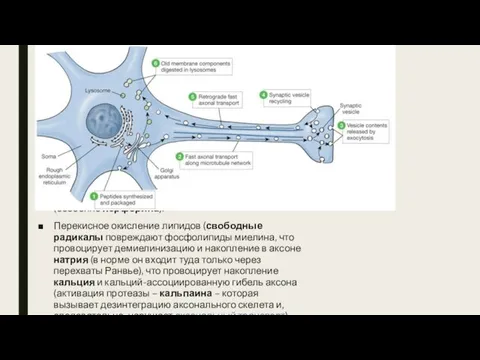
- 21. Нейродегенерация при РС. Ранее считалось, что в основе хронизации течения РС – неспособность олигодендроцитов к ремиелинизации,
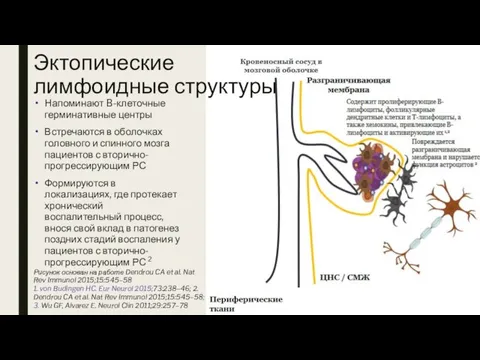
- 22. Эктопические лимфоидные структуры Напоминают B-клеточные герминативные центры Встречаются в оболочках головного и спинного мозга пациентов с
- 23. Двухфазная модель РС
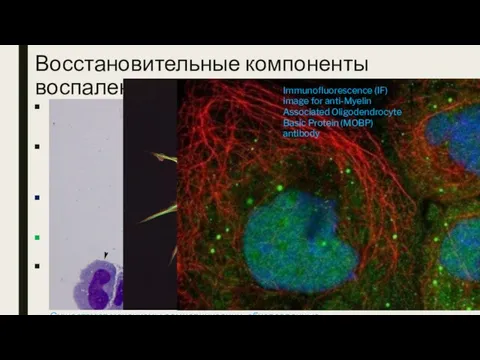
- 24. Восстановительные компоненты воспаления при РС Сами воспалительные компоненты, в зависимости от времени, могут играть роль как
- 25. Роль биогенных аминов во взаимодействии нервной и иммунной систем Дофамин оказывает ингибирующее влияние на продукцию ИЛ-17
- 26. Таким образом, воспалительные и нейродегенартивные процессы при РС взаимосвязаны и протекают параллельно, лишь с преобладанием того
- 28. Скачать презентацию








 Методы обследования больных с заболеваниями слизистой оболочки полости рта
Методы обследования больных с заболеваниями слизистой оболочки полости рта Гемолитическая болезнь плода и новорожденного. Повышение непрямого билирубина
Гемолитическая болезнь плода и новорожденного. Повышение непрямого билирубина Общая врачебная практика как основа в здравоохранении
Общая врачебная практика как основа в здравоохранении Патологическая анатомия: содержание предмета, задачи, объекты и методы исследования
Патологическая анатомия: содержание предмета, задачи, объекты и методы исследования Сифилис
Сифилис Хроническая сердечная недостаточность
Хроническая сердечная недостаточность Шок. Определение шока
Шок. Определение шока Моделировочные материалы
Моделировочные материалы Клизмы. Виды клизм
Клизмы. Виды клизм Транспортная иммобилизация
Транспортная иммобилизация Педиатрия. Рост и развитие детей
Педиатрия. Рост и развитие детей Принципы и правила биоэтики
Принципы и правила биоэтики Эшерихии - кишечная палочка. Микробиология
Эшерихии - кишечная палочка. Микробиология Жіночий таз. Плід як об'єкт родів. Акушерська термінологія
Жіночий таз. Плід як об'єкт родів. Акушерська термінологія Рак щитовидной железы
Рак щитовидной железы Основные возбудители внебольничной пневмонии
Основные возбудители внебольничной пневмонии Профилактика заболеваний прямой кишки
Профилактика заболеваний прямой кишки Рассеянный склероз
Рассеянный склероз ФР при ССЗ реаб
ФР при ССЗ реаб Острая ревматическая лихорадка, хроническая ревматическая болезнь сердца
Острая ревматическая лихорадка, хроническая ревматическая болезнь сердца Травма живота
Травма живота Производство мягких лекарственных средств. Принципы и режимы работы оснащения
Производство мягких лекарственных средств. Принципы и режимы работы оснащения Типовые нарушения системы иммунобиологического надзора
Типовые нарушения системы иммунобиологического надзора Подготовка лечебно-профилактического учреждения к работе в чрезвычайных ситуациях
Подготовка лечебно-профилактического учреждения к работе в чрезвычайных ситуациях Панкретит, холецистит, өт шығару жолдарының дискинезиясы
Панкретит, холецистит, өт шығару жолдарының дискинезиясы Местный иммунитет
Местный иммунитет Биологически активные добавки (БАД)
Биологически активные добавки (БАД) Нәрестелердің асфиксиясы
Нәрестелердің асфиксиясы