Содержание
- 2. Жизнь есть организованная последовательность ферментативных процессов. Все ферментативные процессы протекают эффективно только при оптимальной температуре, оптимальной
- 3. В организме человека массой 70 кг за сутки образуется 20 000 ммоль угольной кислоты и 80
- 4. S.P.L. Sorensen (1868-1939) pH – pondus Hydrogenii – «Сила водорода» pH = - lg [ H+]
- 5. Буферные системы организма: Гидрокарбонатный буфер Гемоглобиновый буфер Фосфатный буфер Белковый буфер
- 6. Что такое буферная система? Соль сильного основания и слабая кислота, способные в растворе поддерживать определенную концентрацию
- 7. Уравнение Гендерсона-Гессельбаха Лоуренс Джозеф Гендерсон, Карл Альберт Гессельбах, 1908 г.
- 8. Как работает буферная система? NaHCO3 + HCl → H2CO3 + NaCl → NaCl + CO2 +
- 9. Пути элиминации ионов водорода Легкие – элиминация СО2, после чего водород остается в организме в виде
- 10. Зачем нужны гемоглобиновый и белковый буфер? Нивелируют значительные перепады pH между артериальной и венозной кровью Облегчают
- 11. Почечная экскреция ионов водорода Реабсорбция ионов HCO3+ «Титруемая кислотность» Элиминация аммиака
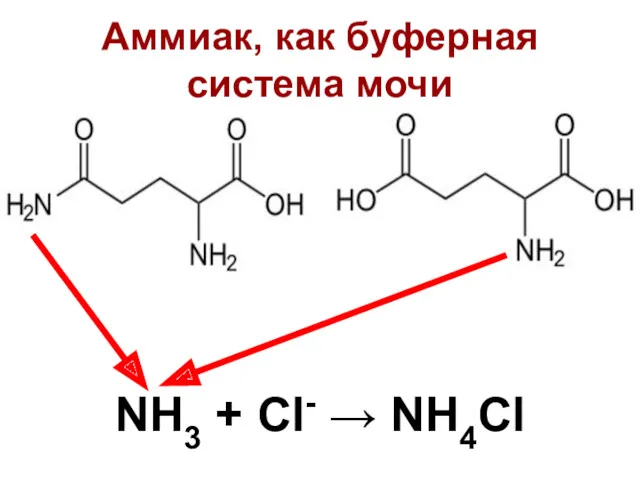
- 12. Аммиак, как буферная система мочи NH3 + Cl- → NH4Cl
- 13. Нарушения кислотно-основного баланса: Респираторный ацидоз Респираторный алкалоз Метаболический ацидоз Метаболический алкалоз
- 14. До настоящего времени ведутся споры о том, какое из нарушений встречается чаще в стационарах. В любом
- 15. Респираторный ацидоз Гиперкапния Альвеолярная гиповентиляция Повышенная продукция CO2 при отсутствии ауторегуляции дыхания
- 16. Респиртаторный алкалоз Гипокапния Гипервентиляция ИВЛ/ВВЛ Гипертермия Психическое возбуждение Циркуляторная гипоксия ЦНС
- 17. Метаболический ацидоз Нарушение элиминации ионов водорода Повышенное поступление в организм ионов водорода Повышенная потеря ионов гидрокарбоната
- 18. Сумма заряда положительно заряженных ионов в любом из секторов организма и в организме в целом равна
- 19. Из закона электронейтральности организма следует, что любое увеличение концентрации не гидрокарбонатных анионов при сохраненном количестве катионов
- 21. Метаболический ацидоз Лактат-ацидоз Кетоацидоз Гиперхлоремический ацидоз Ацидоз при экзогенных отравлениях
- 22. Метаболический ацидоз Повышенные потери гидрокарбоната Ретенционный при почечной недостаточности Гипоальдостеронизм
- 23. Метаболический ацидоз – кетоацидоз Сахарный диабет Алкоголизм Голодание
- 24. «Кетоновые тела»: - ацетон - ацетоуксусная к-та - β-гидроксимасляная к-та
- 25. Метаболический ацидоз – лактат-ацидоз «Быстрый» лактат-ацидоз (лактат-ацидоз А по Cohen & Woods) – гипоксия «Медленный» лактат-ацидоз
- 26. Лактат-ацидоз (по Cohen & Woods) Лактат-ацидоз ГИПОКСИЯ Тип А Тип В Хронические заболевания Лекарства и яды
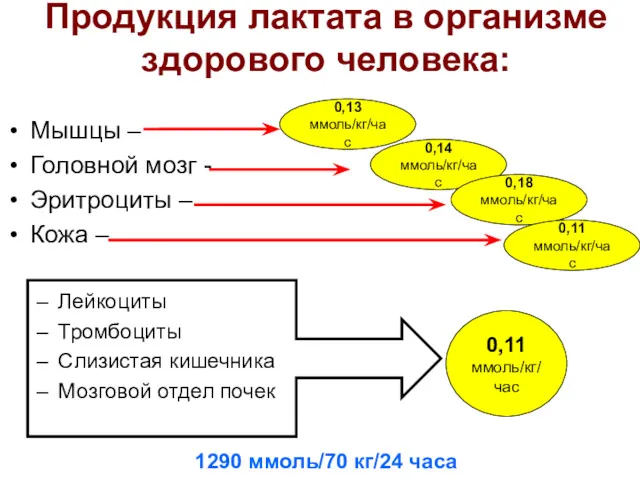
- 27. Продукция лактата в организме здорового человека: Мышцы – Головной мозг - Эритроциты – Кожа – Лейкоциты
- 28. Метаболизм лактата (цикл Кори) глюкоза пируват (2) лактат (2) лактат (2) пируват (2) глюкоза ПЕЧЕНЬ МЫШЕЧНАЯ
- 29. Что общего у этих лекарств? Диазепам Эсмолол Гидралазин Мультивитамины Фенобарбитал Фенитоин Дигоксин Этомидат Лоразепам Нитроглицерин Пентобарбитал
- 30. Особые формы лактат-ацидоза D - лактат-ацидоз: результат развития условно-патогенной флоры тонкого кишечника Не определяется лабораторными методами
- 31. Метаболический алкалоз Избыточная потеря хлоридов через ЖКТ Стеноз выходного отдела желудка Длительное зондирование желудка Упорные рвоты
- 32. Коррекция метаболического ацидоза (компоненты инфузионных сред) Гидрокарбонат натрия Лактат натрия Ацетат натрия Глюконат натрия Малат натрия
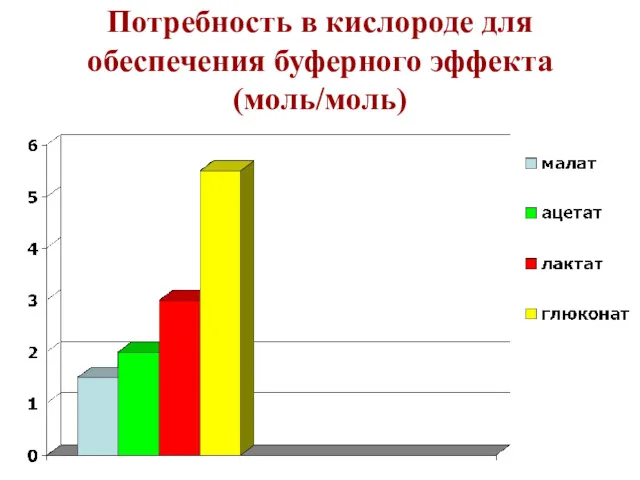
- 33. Потребность в кислороде для обеспечения буферного эффекта (моль/моль)
- 34. Основные причины отказа от гидрокарбоната натрия как терапевтической буферирующей системы: Нестабильность раствора Несовместимость с ионами кальция
- 35. Вещества, определяемые как «эндотоксины» в значительной части являются слабыми органическими кислотами и их солями. Степень эндотоксикоза
- 36. Степень ионизации эндотоксина определяет: Способность эндотоксина к проникновению через биологические мембраны (например – через ГЭБ) Способность
- 37. Растворы гидрокарбоната натрия могут применяться: Для коррекции декомпенсированного метаболического ацидоза Для смещения реакции мочи в щелочную
- 38. Новые подходы к оценке и коррекции нарушений кислотно-основного баланса
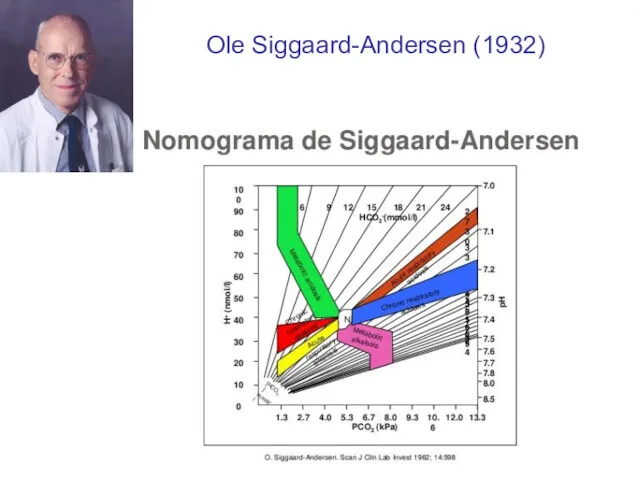
- 39. Ole Siggaard-Andersen (1932)
- 40. Основные положения концепции Питера Стюарта: Кислотами являются любые субстанции, повышающие концентрацию ионов H+ Количество ионов H+,
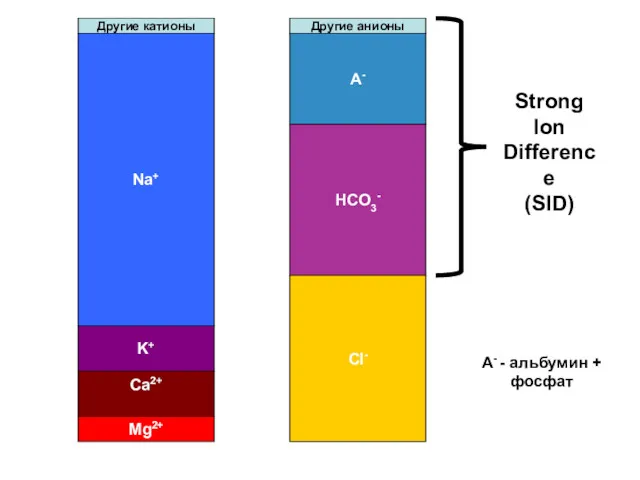
- 41. Уравнение электронейтральности: [SID] + [H+] = [HCO3-] + [A-] + [CO32-] + [OH-] Или, если пренебречь
- 42. Na+ K+ Ca2+ Mg2+ Другие катионы Другие анионы A- HCO3- Cl- Strong Ion Difference (SID) A-
- 43. Как обосновывается pH 7,20? Treatment of acute metabolic acidosis by alkali therapy is usually indicated to
- 44. В каких случаях не рекомендуется применять гидрокарбонат натрия? Диабетический кетоацидоз Лактат-ацидоз Септический шок Остановка кровообращения Интраоперационный
- 45. Нежелательные эффекты гидрокарбоната натрия: Гипокалиемия Гипокальциемия (ионизированный Ca2+) Удлинение интервала QT Гиперкапния Гемодинамическая нестабильность при проведении
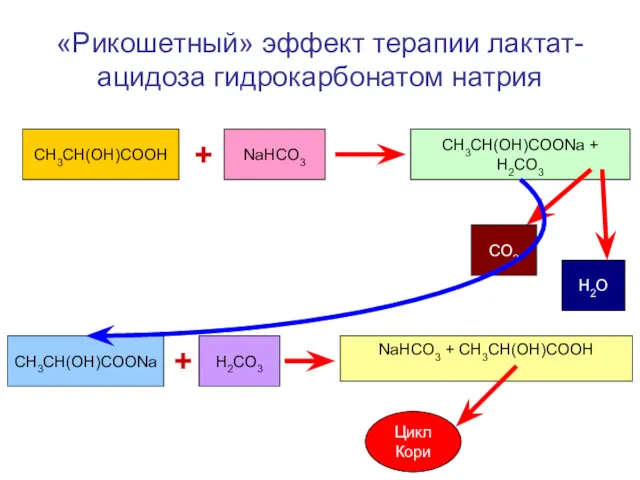
- 46. «Рикошетный» эффект терапии лактат-ацидоза гидрокарбонатом натрия CH3CH(OH)COOH + NaHCO3 CH3CH(OH)COONa + H2CO3 CO2 H2O CH3CH(OH)COONa +
- 47. Так ли уж плох гидрокарбонат натрия в интенсивной терапии?
- 48. Зачем это все нужно (с точки зрения практического клинициста)? pH 7,30 CO2 20 mm Hg HCO3-
- 49. Как мы узнаем избыток оснований? BE = 0,93 × ([HCO3-] – 24,4 + (pH – 7,4)
- 50. Что делать тем, кто не хочет нарушать установленных границ?
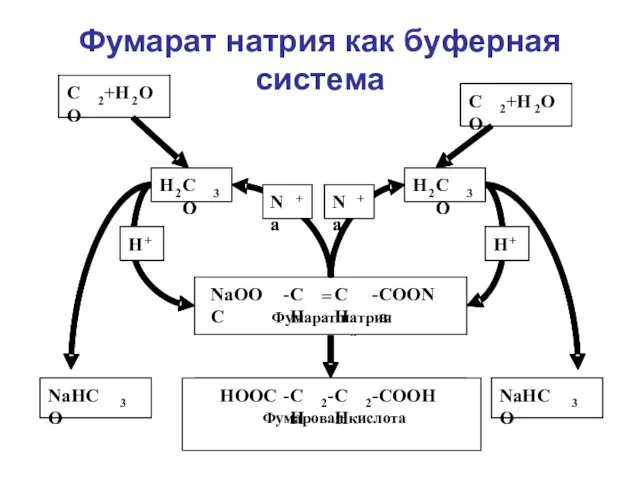
- 51. Фумарат натрия как буферная система
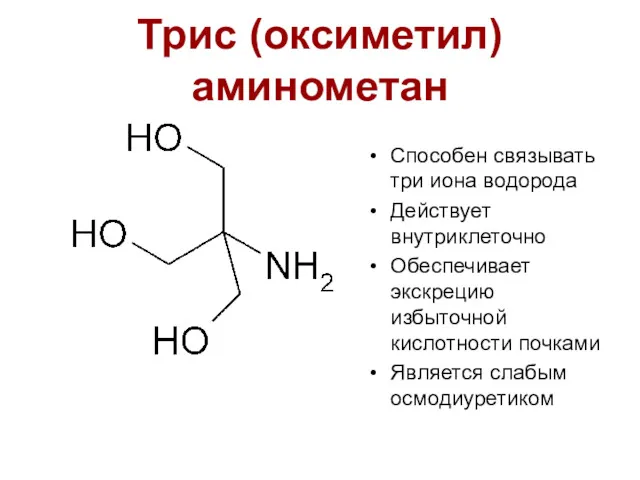
- 52. Триc (оксиметил) аминометан Способен связывать три иона водорода Действует внутриклеточно Обеспечивает экскрецию избыточной кислотности почками Является
- 53. Клинические ситуации, подходящие для использования THAM Диабетический кетоацидоз Астматический статус Токсический отек головного мозга с метаболическим
- 54. Энтеральная коррекция метаболического ацидоза: Гидрокарбонат натрия Раствор Шола (Shohl’s solution) – 140 гр. лимонной кислоты и
- 55. На что нужно смотреть в первую очередь? рН ВЕ НСО3- Cl- K+ SID
- 57. Скачать презентацию



































![Уравнение электронейтральности: [SID] + [H+] = [HCO3-] + [A-] +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/166032/slide-40.jpg)





![Как мы узнаем избыток оснований? BE = 0,93 × ([HCO3-]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/166032/slide-48.jpg)




 Логопедические технологии
Логопедические технологии Введение в токсикологию
Введение в токсикологию Фермент. Ферменттерді ауруларды диагностикалауға және емдеуге қолдану
Фермент. Ферменттерді ауруларды диагностикалауға және емдеуге қолдану Халықтың радиациялық қауіпсіздігін қамтамасыз ету мен қоршаған ортаны
Халықтың радиациялық қауіпсіздігін қамтамасыз ету мен қоршаған ортаны Организация медико-социальной помощи
Организация медико-социальной помощи Микроорганизмдер экологиясы. Адам ағзасының микрофлорасы. Дисбактериоз
Микроорганизмдер экологиясы. Адам ағзасының микрофлорасы. Дисбактериоз Еріту. Сұйықтықтарды араластыру. Қатты заттарды және сұйықтықтарды бөліп алу
Еріту. Сұйықтықтарды араластыру. Қатты заттарды және сұйықтықтарды бөліп алу Санитарно-эпидемиологические требования к организациям, осуществляющим медицинскую деятельность
Санитарно-эпидемиологические требования к организациям, осуществляющим медицинскую деятельность Прогноз и реабилитация больных в современной детской хирургии
Прогноз и реабилитация больных в современной детской хирургии Периоперационная жидкостная терапия
Периоперационная жидкостная терапия Патології серця. Порушення провідності
Патології серця. Порушення провідності Вегетарианство - взгляд прогрессивного человека
Вегетарианство - взгляд прогрессивного человека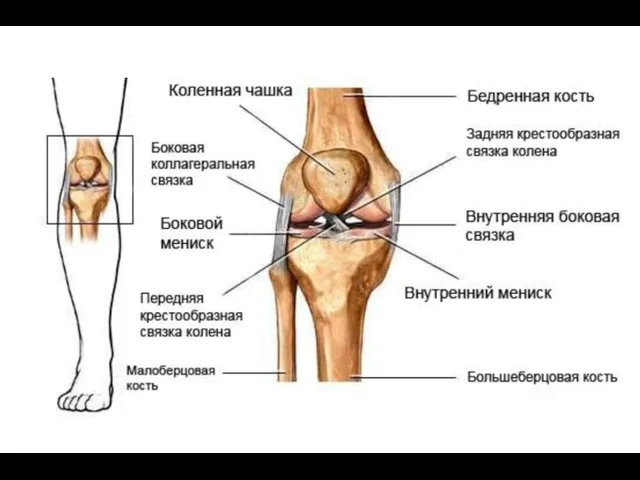 Коленный сустав
Коленный сустав Тактика лечения хронического тонзиллита
Тактика лечения хронического тонзиллита Үрпінің және еннің аномалиялары
Үрпінің және еннің аномалиялары Острый живот
Острый живот Иммунитеттің жасушалық жүйесі Т-лимфоциттер құрылысы, қызметтері Т- және В-лимфоциттердің негізгі белгілері
Иммунитеттің жасушалық жүйесі Т-лимфоциттер құрылысы, қызметтері Т- және В-лимфоциттердің негізгі белгілері Коматозні стани
Коматозні стани Основные виды шока
Основные виды шока Инсульт. Факторы риска инсульта
Инсульт. Факторы риска инсульта Малярия. Стадии развития малярийного плазмодия. (Лекция 12)
Малярия. Стадии развития малярийного плазмодия. (Лекция 12) Сосудистый шов
Сосудистый шов Перинатология, как наука
Перинатология, как наука Ефективність використання лфк у фізичній реабілітації при дифектах постави
Ефективність використання лфк у фізичній реабілітації при дифектах постави Мультисистемная атрофия. Оливопонтоцеребеллярная атрофия
Мультисистемная атрофия. Оливопонтоцеребеллярная атрофия Одонтогенді және одонтогенді емес қабыну аурулары
Одонтогенді және одонтогенді емес қабыну аурулары Основные синдромы при патологии дыхательной системы
Основные синдромы при патологии дыхательной системы Методы диагностики микобактерий туберкулеза
Методы диагностики микобактерий туберкулеза