Клінічна морфологія, онкологія і патологія. Вступ. Методи досліджень у клінічній патології презентация
Содержание
- 2. Питання лекції Предмет та зміст дисципліни. Історія розвитку дисципліни. Правила формулювання клінічного та патологоанатомічного діагнозів. Методи
- 3. Література Патологічна анатомія тварин. П.П. Урбанович, М.К. Потоцький, Г.А. Гевкан. – 2008. Ветеринарная клиническая онкология. П.Ф.
- 4. Література 4. Микроскопические исследования в диагностике заболеваний мелких домашних животных. С.В. Середа и др. 5. Опухоли
- 5. 1. Предмет та зміст дисципліни Мета дисципліни – набуття теоретичних і практичних навичок для проведення клінічних
- 6. 2. Історія розвитку дисципліни Анатомічний (до початку XIX ст) Дж. Морган‘ї К. Рокитанський Мікроскопічний (XIX ст
- 7. 3. Правила формулювання клінічного і патологоанатомічного діагнозів Діагноз – це краткий медичний висновок про хворобу, відхилення
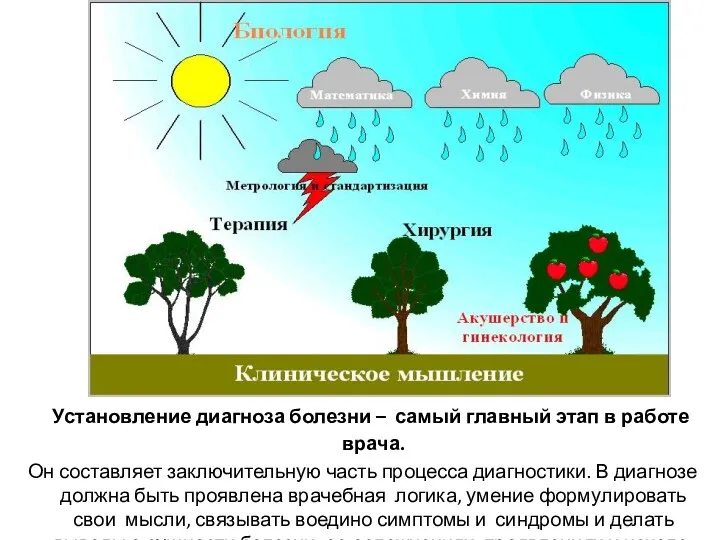
- 8. Установление диагноза болезни – самый главный этап в работе врача. Он составляет заключительную часть процесса диагностики.
- 9. Основні види діагнозів: Клінічний (прижиттєвий) – попередній (при недостатній повноті обстеження, діагноз може бути симптоматичним або
- 10. Розділи діагнозу: Основне захворювання; Ускладнення основного захворювання, які необхадно згрупувати за ступенем важкості; Фонові та конкуруючі
- 11. Основне захворювання (комбіноване основне захворювання) – одна або декілько нозологічних одиниць (захворювання, травми, синдроми), які сами
- 12. Фонове захворювання – патологічний стан патогенетично пов’язаний з основним захворюванням, що є однією з причин його
- 13. Ускладнення основного захворювання – патологічний процес, патогенетично пов’язаний з основним захворюванням, що ускладнює його протікання і
- 14. Захворювання, що не мають безпосереднього відношення до смерті тварини Супутні хвороби – одне або кілька захворювань,
- 16. «Если диагноз основан на лабораторных данных, врач должен быть уверен в надежности метода и в качестве
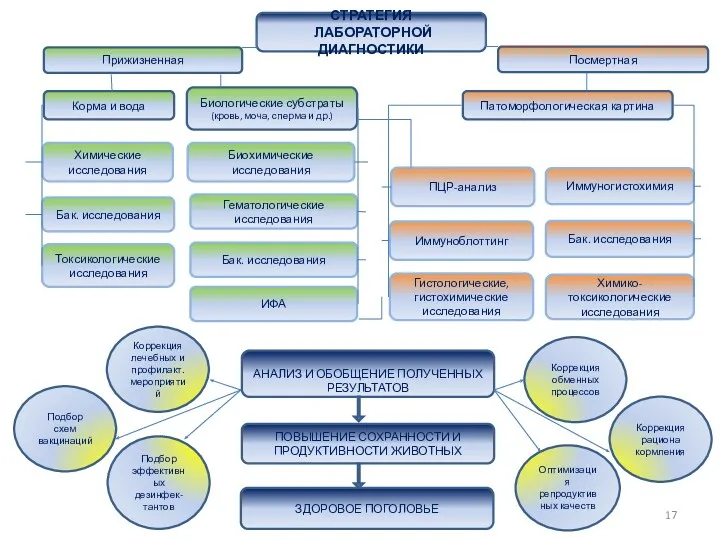
- 17. СТРАТЕГИЯ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ Прижизненная Посмертная Патоморфологическая картина Корма и вода Биологические субстраты (кровь, моча, сперма и
- 18. 4. Методи досліджень в патології Основной метод патологічної анатомії – розтин (аутопсія) Біопсия – (bios –
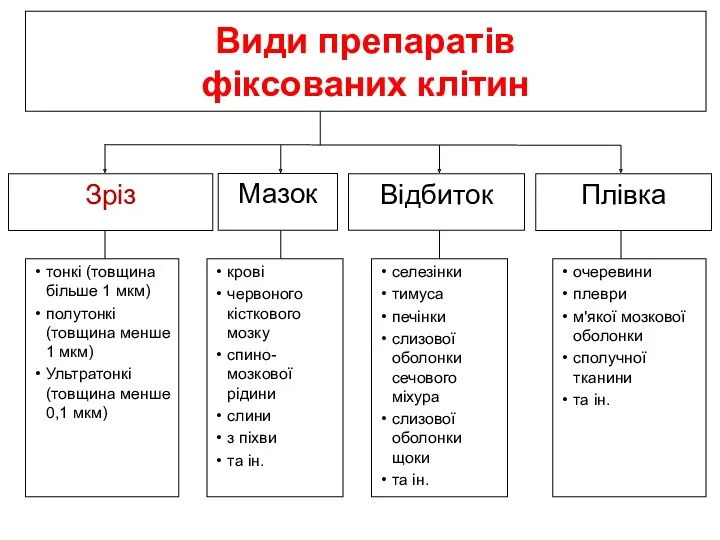
- 19. Види препаратів фіксованих клітин Мазок Відбиток Зріз Плівка крові червоного кісткового мозку спино-мозкової рідини слини з
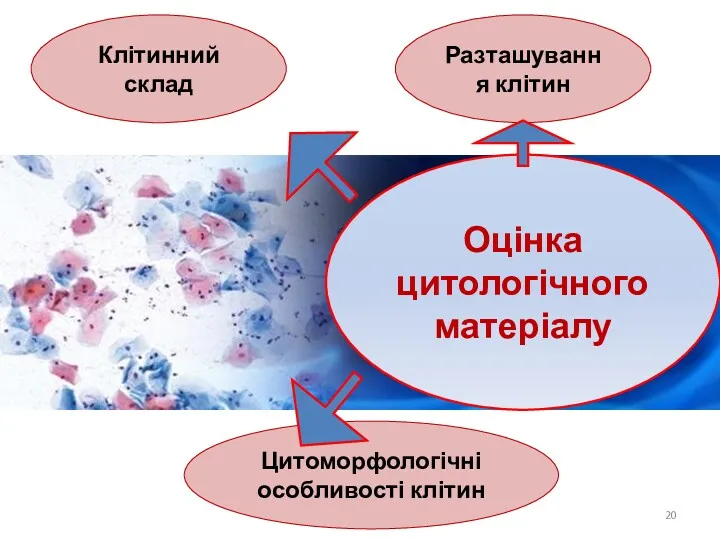
- 20. Оцінка цитологічного матеріалу Клітинний склад Разташування клітин Цитоморфологічні особливості клітин
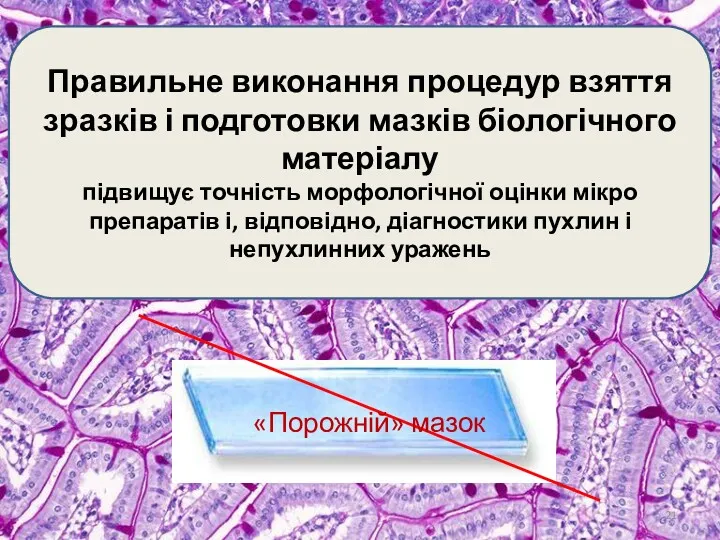
- 21. Правильне виконання процедур взяття зразків і подготовки мазків біологічного матеріалу підвищує точність морфологічної оцінки мікро препаратів
- 22. Переваги цитологічного дослідження Мінімум обладнання (шприци та голки) Не потрібна анестезія і седативні препарати (як правило)
- 23. Види біопсій пункційна - матеріал отримують шляхом пункції спеціальною голкою через шкіру або через невеликий розріз
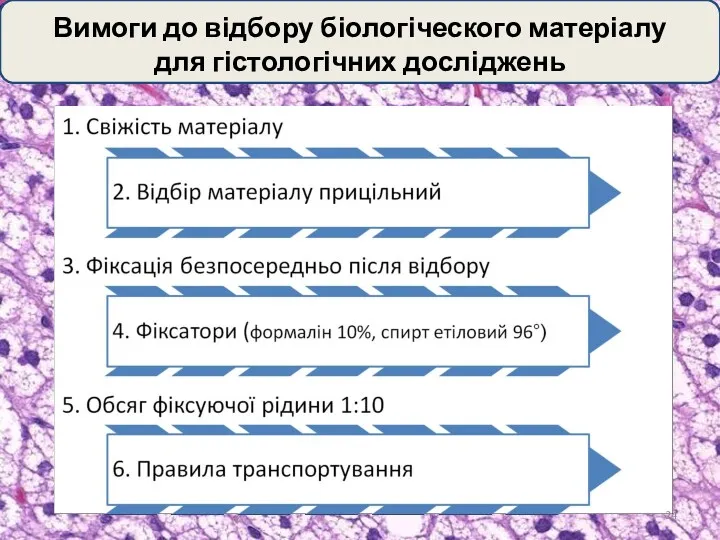
- 24. Вимоги до відбору біологіческого матеріалу для гістологічних досліджень
- 25. кличка
- 28. У НДЦ біобезпеки та екологічного контролю ресурсів АПК ДДАЕУ відділ морфологічних досліджень Лист-Заявка Підприємство-замовник: ___________________________________________________________________________ Адреса
- 30. Лабораторія патоморфології і паразитології Лабораторія гістології і імуноцитохімії
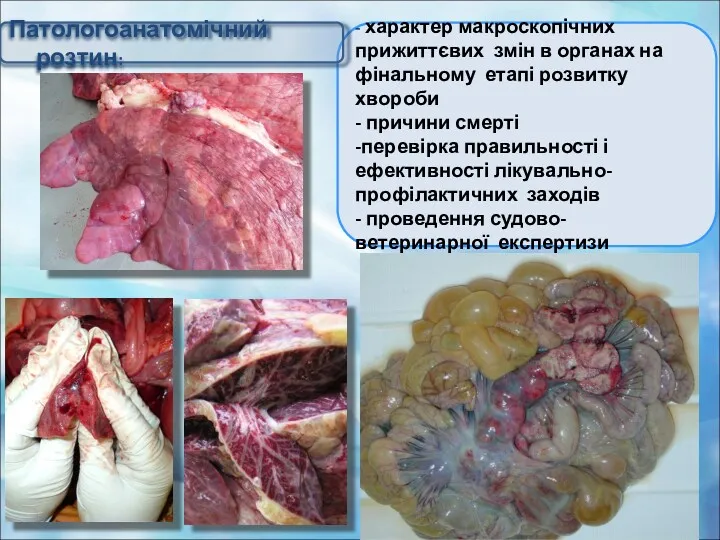
- 31. - характер макроскопічних прижиттєвих змін в органах на фінальному етапі розвитку хвороби - причини смерті -перевірка
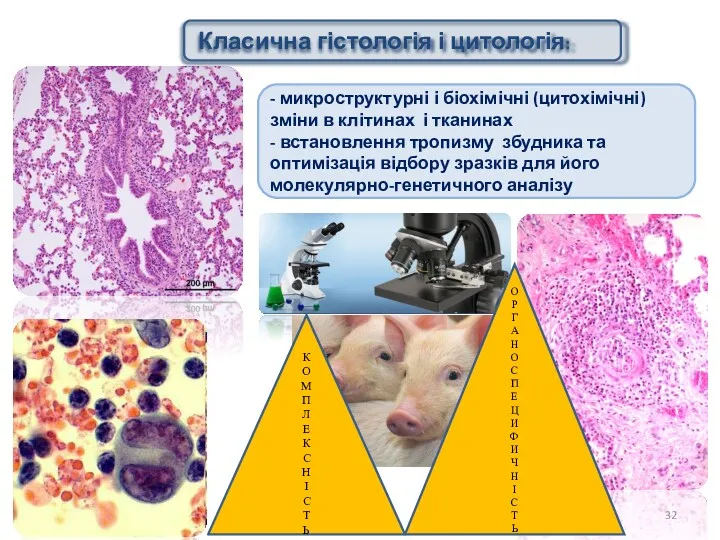
- 32. - микроструктурні і біохімічні (цитохімічні) зміни в клітинах і тканинах - встановлення тропизму збудника та оптимізація
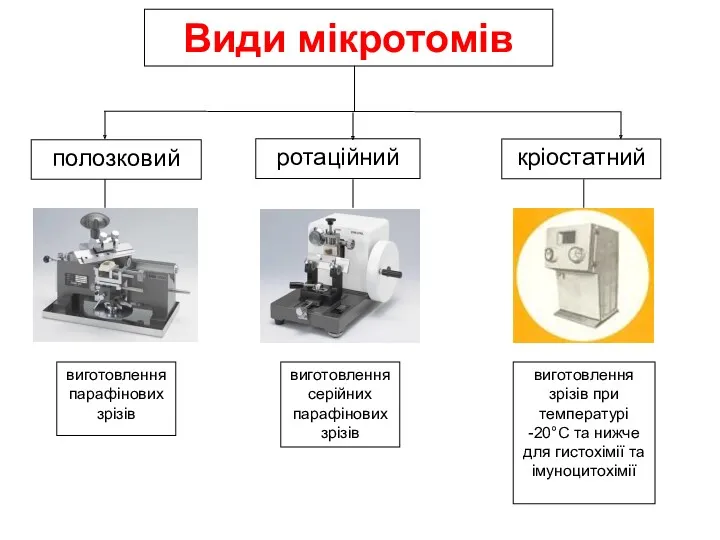
- 33. Види мікротомів ротаційний кріостатний полозковий виготовлення серійних парафінових зрізів виготовлення парафінових зрізів виготовлення зрізів при температурі
- 34. ЗОВНІШНІЙ ВИГЛЯД МИКРОТОМА
- 35. М Е Т О Д И Ч Н І ОСОБЛИВОСТІ ВИКОРИСТАННЯ ІМУНОГІСТОХІМІЧНОГО АНАЛІЗУ ДЛЯ ДІАГНОСТИКИ ЗАХВОРЮВАНЬ
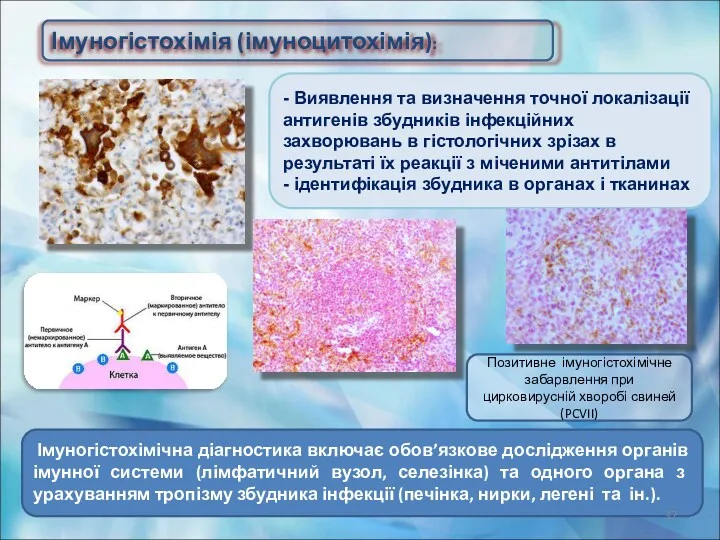
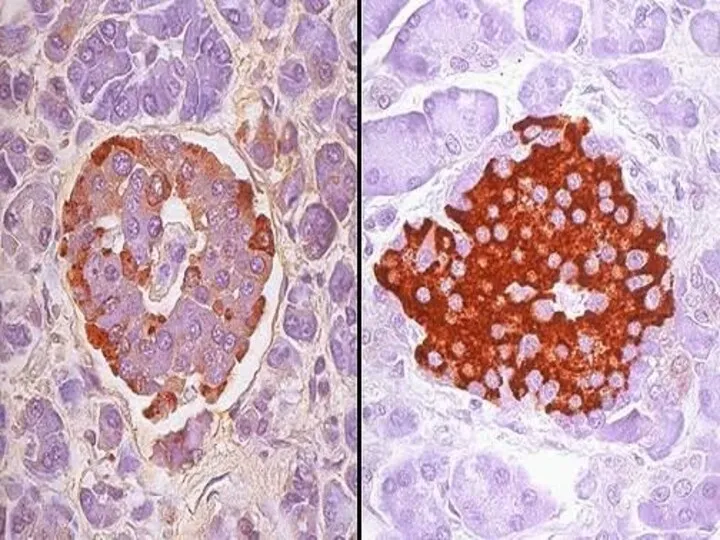
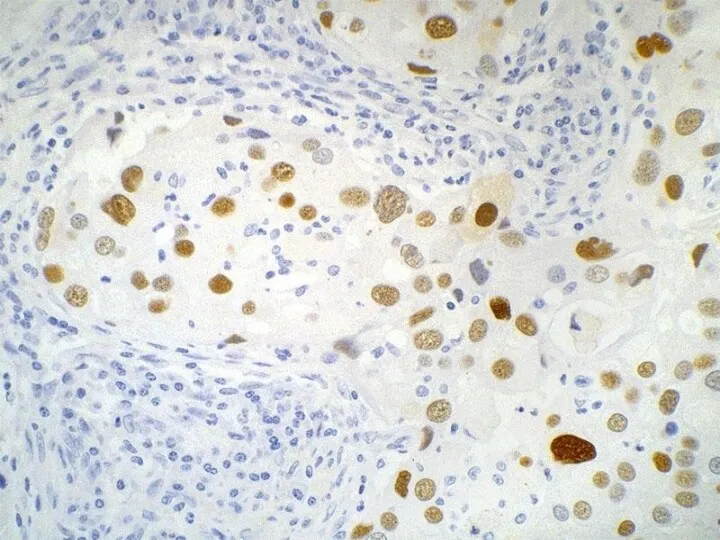
- 36. Імуногістохімічні методи В основі є специфічна взаємодія тканинних і клітинних антигенів тварин або людини із спеціально
- 37. - Виявлення та визначення точної локалізації антигенів збудників інфекційних захворювань в гістологічних зрізах в результаті їх
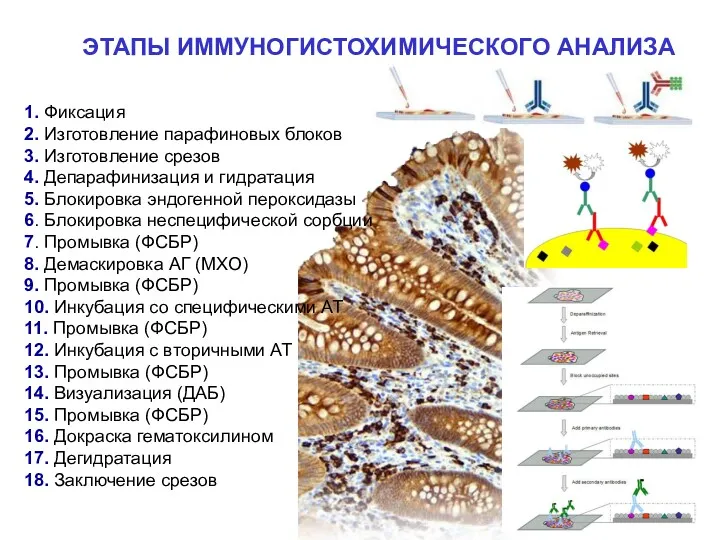
- 38. ЭТАПЫ ИММУНОГИСТОХИМИЧЕСКОГО АНАЛИЗА 1. Фиксация 2. Изготовление парафиновых блоков 3. Изготовление срезов 4. Депарафинизация и гидратация
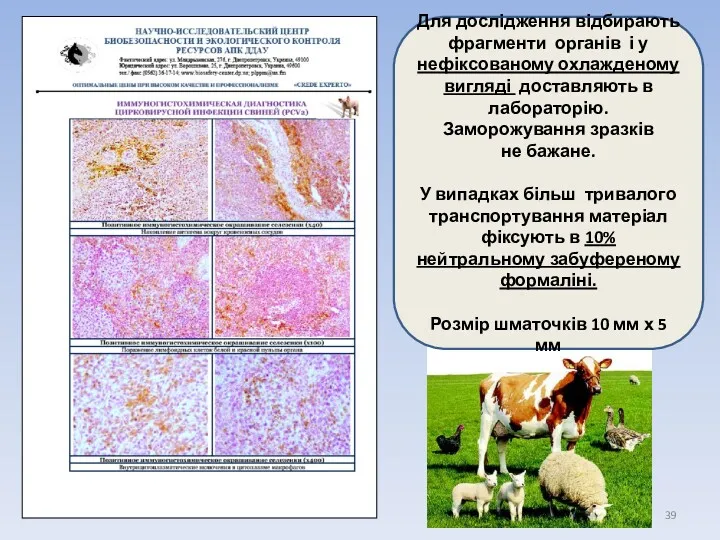
- 39. Для дослідження відбирають фрагменти органів і у нефіксованому охлажденому вигляді доставляють в лабораторію. Заморожування зразків не
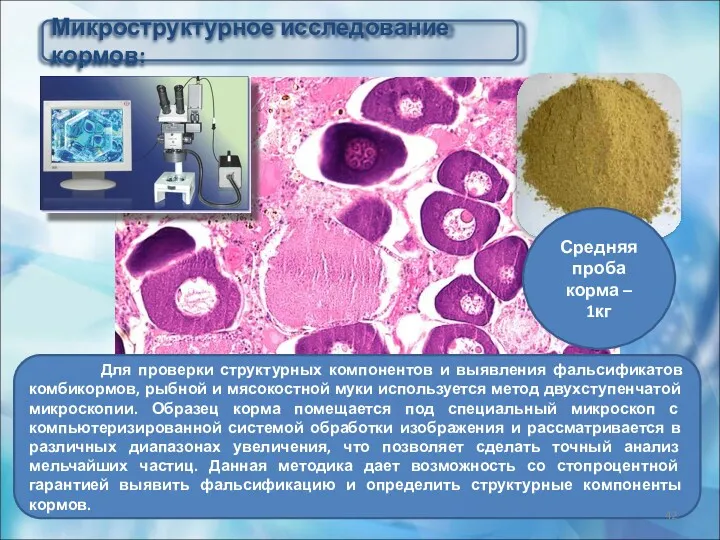
- 42. Микроструктурное исследование кормов: Для проверки структурных компонентов и выявления фальсификатов комбикормов, рыбной и мясокостной муки используется
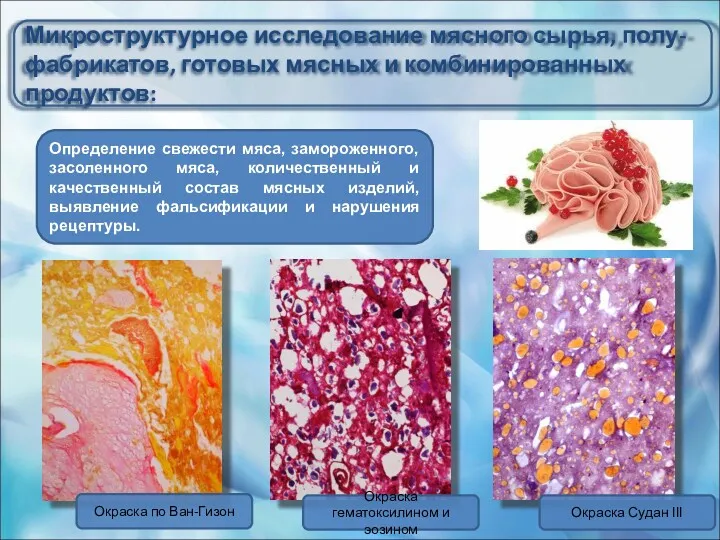
- 43. Микроструктурное исследование мясного сырья, полу-фабрикатов, готовых мясных и комбинированных продуктов: Определение свежести мяса, замороженного, засоленного мяса,
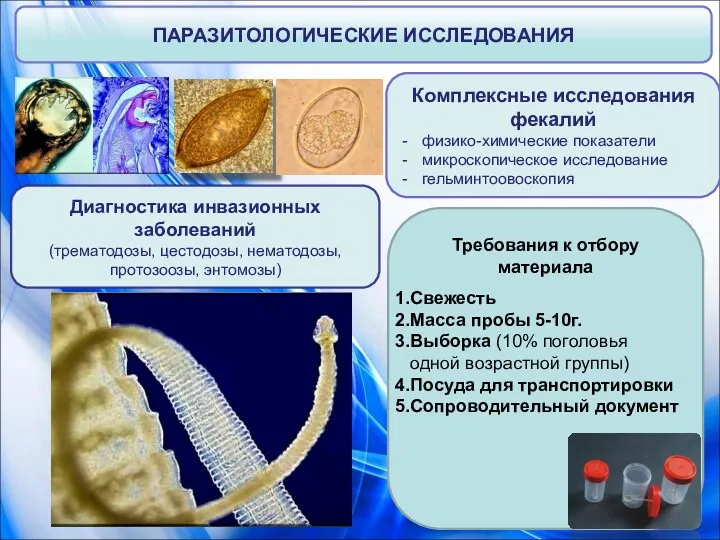
- 44. ПАРАЗИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ Комплексные исследования фекалий физико-химические показатели микроскопическое исследование гельминтоовоскопия Диагностика инвазионных заболеваний (трематодозы, цестодозы, нематодозы,
- 45. ПАРАЗИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ
- 46. Исследование биологических субстратов и органов животных Кровь отбирают одноразовым шприцом вместимостью 5-10 мл. Переливать кровь по
- 47. Исследование биологических субстратов и органов животных Для биохимических исследований используют сыворотку и плазму крови. Сыворотка: кровь
- 48. Исследование биологических субстратов и органов животных Паренхиматозные органы (печень, почки) или образцы мышечной ткани для проведения
- 49. Полимеразная цепная реакция метод определения конкретных последовательностей ДНК или РНК в любом биологическом образце ПЦР –
- 50. ПРАВИЛА ОТБОРА И ТРАНСПОРТИРОВКИ МАТЕРИАЛА ДЛЯ ПЦР ИССЛЕДОВАНИЯ СТАБИЛИЗИРОВАННАЯ КРОВЬ Для ПЦР исследования кровь отбирают в
- 51. ПРАВИЛА ОТБОРА И ТРАНСПОРТИРОВКИ МАТЕРИАЛА ДЛЯ ПЦР ИССЛЕДОВАНИЯ ПАТОЛОГИЧЕСКИЙ МАТЕРИАЛ И АБОРТИРОВАННЫЕ ПЛОДЫ С КУСОЧКАМИ ПЛАЦЕНТЫ
- 52. ПРАВИЛА ОТБОРА И ТРАНСПОРТИРОВКИ МАТЕРИАЛА ДЛЯ ПЦР ИССЛЕДОВАНИЯ СМЫВЫ Для отбора смывов нужно использовать стерильные ватные
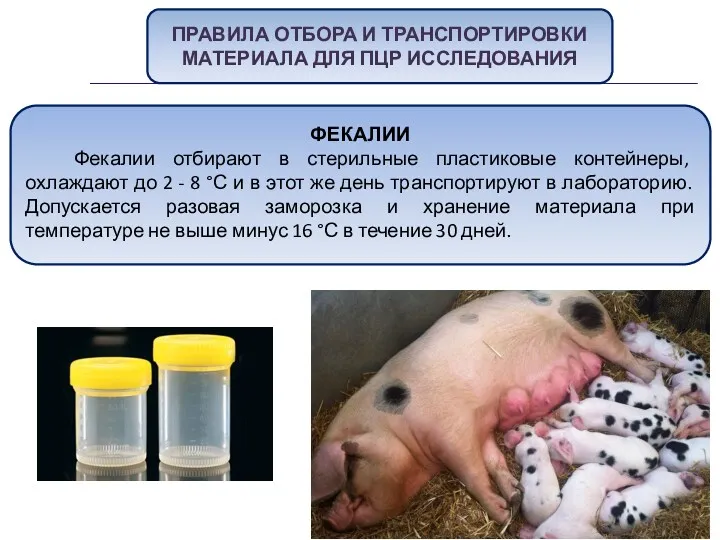
- 53. ПРАВИЛА ОТБОРА И ТРАНСПОРТИРОВКИ МАТЕРИАЛА ДЛЯ ПЦР ИССЛЕДОВАНИЯ ФЕКАЛИИ Фекалии отбирают в стерильные пластиковые контейнеры, охлаждают
- 54. ПРАВИЛА ОТБОРА И ТРАНСПОРТИРОВКИ МАТЕРИАЛА ДЛЯ ИФА ИССЛЕДОВАНИЯ Для иммуноферментного анализа используют сыворотку крови Кровь для
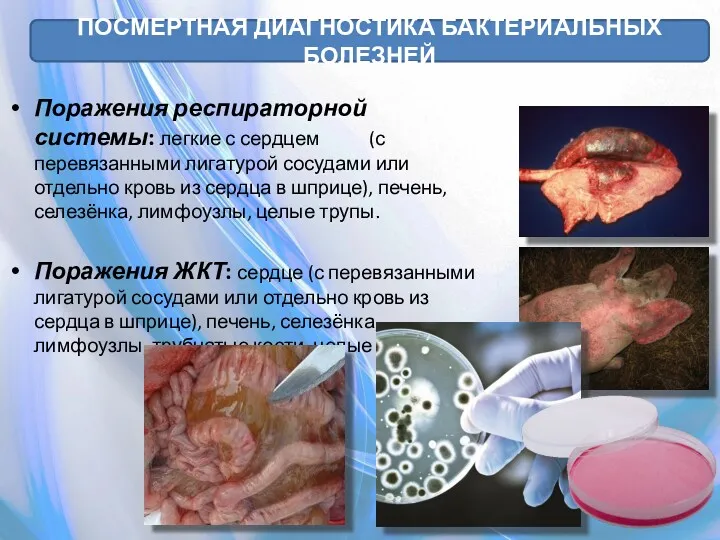
- 55. ПОСМЕРТНАЯ ДИАГНОСТИКА БАКТЕРИАЛЬНЫХ БОЛЕЗНЕЙ Поражения респираторной системы: легкие с сердцем (с перевязанными лигатурой сосудами или отдельно
- 56. Упаковка и транспортировка патологического материала Отбор производится как можно быстрее после гибели животного Упаковывается в водонепроницаемую
- 57. Витальная диагностика бактериальных болезней Респираторные болезни – отбирают мазки из носовой полости свабами. Поражения ЖКТ –
- 58. Упаковка и транспортировка биологического материала Мазки без транспортных сред и материалы в стерильной таре упаковывают с
- 60. Скачать презентацию




































 Первая помощь при ожогах
Первая помощь при ожогах Museum of the human body
Museum of the human body Эндокринопатии. Патология гипофиза, надпочечников
Эндокринопатии. Патология гипофиза, надпочечников Нарушения сердечного ритма
Нарушения сердечного ритма Лечение инфекционных больных
Лечение инфекционных больных Антисептика. Виды химической антисептики
Антисептика. Виды химической антисептики Норма и патология речи. Речевое поведение. Эмоциональность, скорость и громкость речи
Норма и патология речи. Речевое поведение. Эмоциональность, скорость и громкость речи Неотложные состояния в урологии
Неотложные состояния в урологии Әйел жыныс мүшелерінің қабыну аурулары
Әйел жыныс мүшелерінің қабыну аурулары Болезни цивилизаций: Атеросклероз
Болезни цивилизаций: Атеросклероз Синдром множественных эндокринных неоплазий
Синдром множественных эндокринных неоплазий Вегетарианство: за и против
Вегетарианство: за и против Клинико-психологическое сопровождение пожилых людей страдающих инволлюционным паранойдом
Клинико-психологическое сопровождение пожилых людей страдающих инволлюционным паранойдом Корь. Таксономия
Корь. Таксономия Оказание медицинской помощи при переломах
Оказание медицинской помощи при переломах Ахалазия пищевода
Ахалазия пищевода Сон - как основа жизнедеятельности организма
Сон - как основа жизнедеятельности организма Оказание медицинской помощи при одноплодных родах в затылочном предлежании во внебольничных условиях
Оказание медицинской помощи при одноплодных родах в затылочном предлежании во внебольничных условиях Эссенциальная артериальная гипертензия
Эссенциальная артериальная гипертензия Карантинные мероприятия. Алгоритм действия медицинского персонала. Особо опасные инфекции
Карантинные мероприятия. Алгоритм действия медицинского персонала. Особо опасные инфекции Операция гайморотомия
Операция гайморотомия Печеночная энцефалопатия
Печеночная энцефалопатия Эпигенетические механизмы регуляции в патогенезе опухолевой болезни
Эпигенетические механизмы регуляции в патогенезе опухолевой болезни Венерические заболевания
Венерические заболевания :Вильмс ісігі немесе Нефробластома
:Вильмс ісігі немесе Нефробластома Angina pectoris
Angina pectoris Основы сосудистой хирургии. Линии разрезов при перевязке сосудов на протяжении
Основы сосудистой хирургии. Линии разрезов при перевязке сосудов на протяжении Осложнения желудочно-кишечного тракта внутриутробного развития
Осложнения желудочно-кишечного тракта внутриутробного развития