Коллоидные растворы. Методы получения и очистки коллоидных растворов. Строение мицеллы гидрофобных систем. (Часть 1) презентация
Содержание
- 2. Коллоидная химия («коллоид» – от греческого κόλλα – клей) – наука, изучающая физико-химические свойства гетерогенных высокодисперсных
- 3. История развития коллоидной химии Томас Грэм (Грэхэм) английский/шотладский химик впервые использовал термин «коллоид» для описания растворов
- 4. История развития коллоидной химии Николай Петрович Песков - основатель современной коллоидной химии как науки о поверхностных
- 5. Медико-биологическое значение темы
- 6. Медико-биологическое значение темы
- 7. Медико-биологическое значение темы
- 8. В любом животном или растительном организме представлены практически все коллоидные дисперсные системы: как лиофильные, так и
- 9. Медико-биологическое значение темы
- 10. . Медико-биологическое значение темы
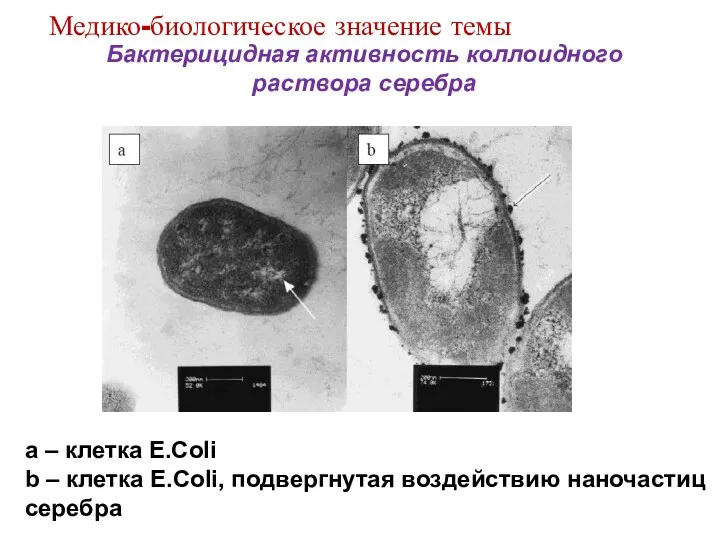
- 11. Бактерицидная активность коллоидного раствора серебра a – клетка E.Coli b – клетка E.Coli, подвергнутая воздействию наночастиц
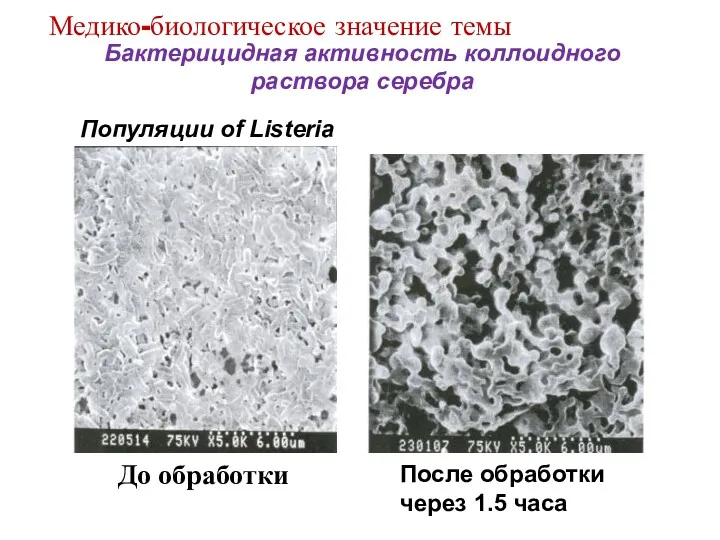
- 12. Бактерицидная активность коллоидного раствора серебра Популяции of Listeria После обработки через 1.5 часа До обработки Медико-биологическое
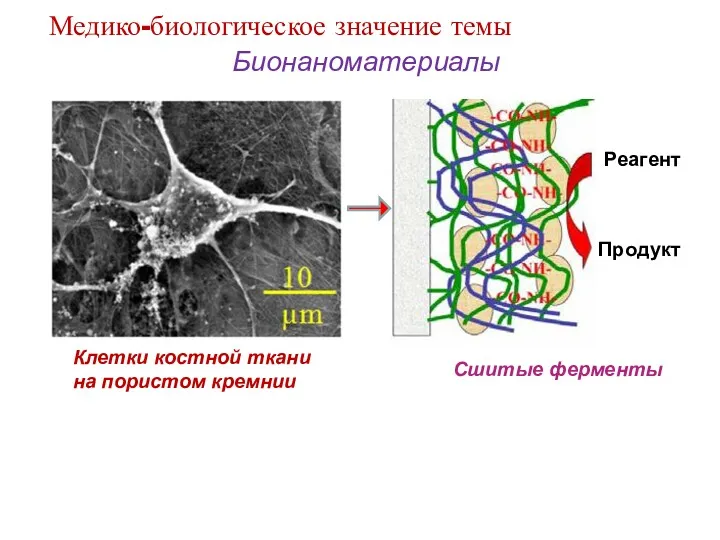
- 13. Бионаноматериалы Клетки костной ткани на пористом кремнии Сшитые ферменты Медико-биологическое значение темы Реагент Продукт
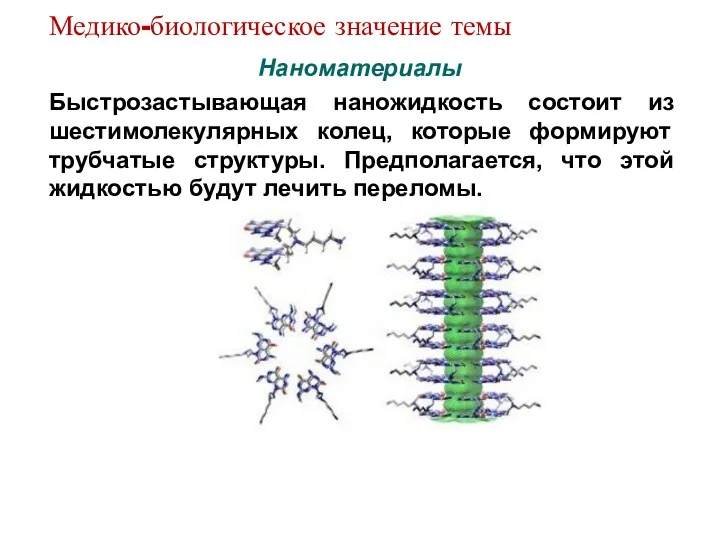
- 14. Наноматериалы Быстрозастывающая наножидкость состоит из шестимолекулярных колец, которые формируют трубчатые структуры. Предполагается, что этой жидкостью будут
- 15. Основные понятия Два общих признака дисперсных систем: гетерогенность и дисперсность. Дисперсной системой (ДС) называется система, в
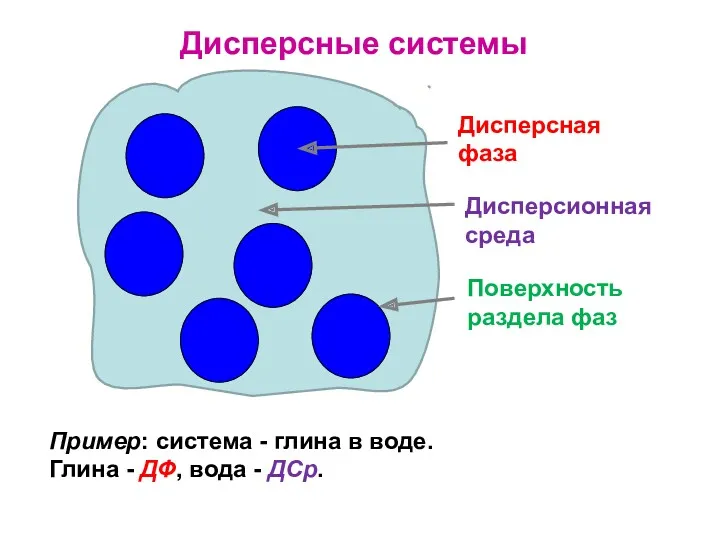
- 16. Классификация дисперсных систем Дисперсная фаза (ДФ) представляет собой частицы, а дисперсионная среда (ДСр) - сплошная среда,
- 17. Дисперсные системы Дисперсная фаза Дисперсионная среда Поверхность раздела фаз Пример: система - глина в воде. Глина
- 18. Коллоидный раствор серебра Основные понятия. Классификация дисперсных систем
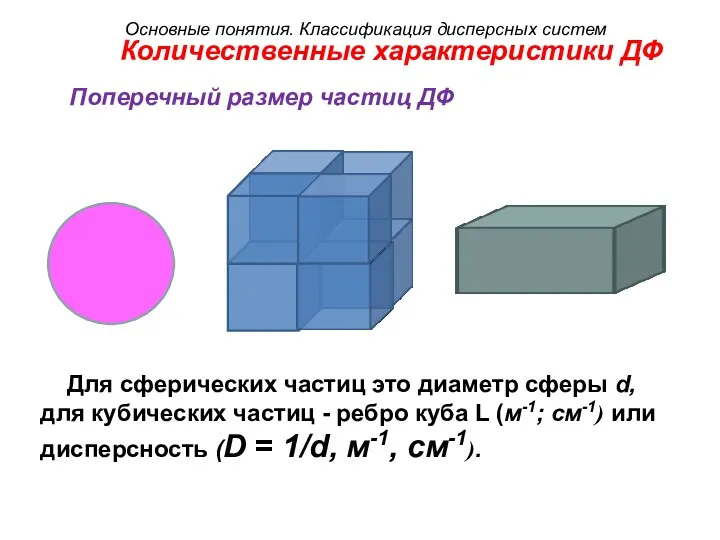
- 19. Количественные характеристики ДФ Поперечный размер частиц ДФ Для сферических частиц это диаметр сферы d, для кубических
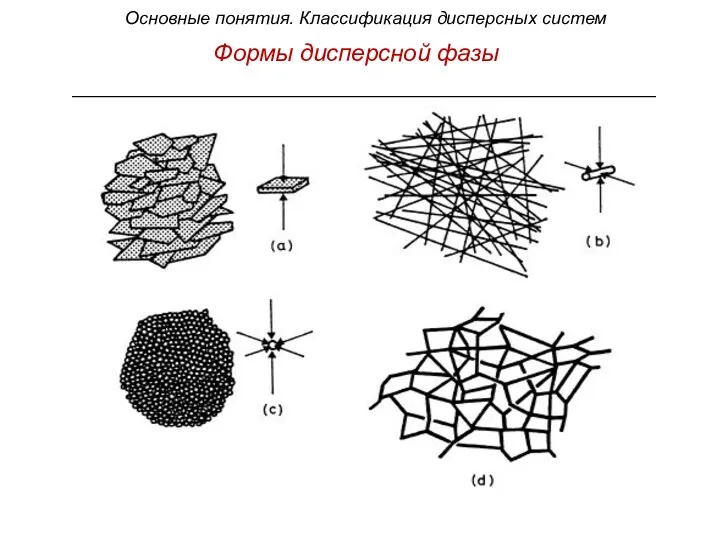
- 20. Формы дисперсной фазы n Основные понятия. Классификация дисперсных систем
- 21. Количественные характеристики ДФ Удельная поверхность Удельная поверхность для сферической частицы с радиусом r Удельная поверхность для
- 22. Важным свойством ДС является наличие большой межфазной поверхности. Характерными являются процессы, протекающие на поверхности, а не
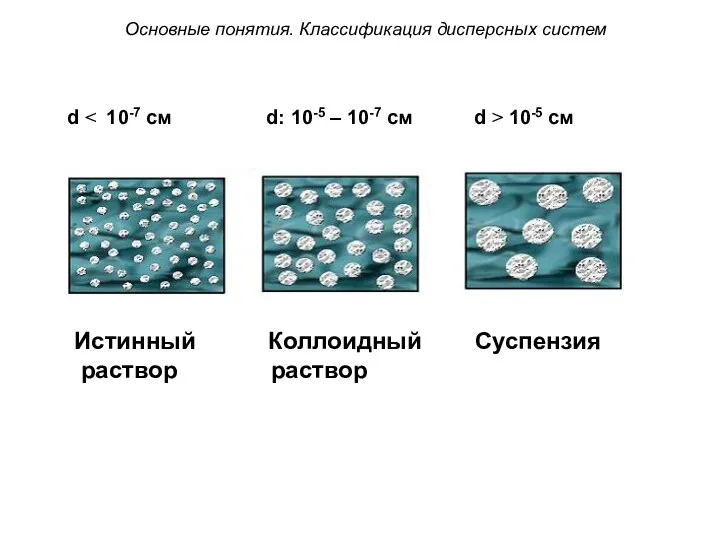
- 23. По степени дисперсности дисперсные системы классифицируют на: Грубодисперсные (d ˃ 10-5 см). Коллоидно-дисперсные (10-7 ˂ d
- 24. Истинный Коллоидный Суспензия раствор раствор d ˂ 10-7 см d: 10-5 – 10-7 см d ˃
- 25. Грубодисперсные (d ˃ 10-5 см) – не проходят через тонкие бумажные фильтры, быстро оседают, видимы в
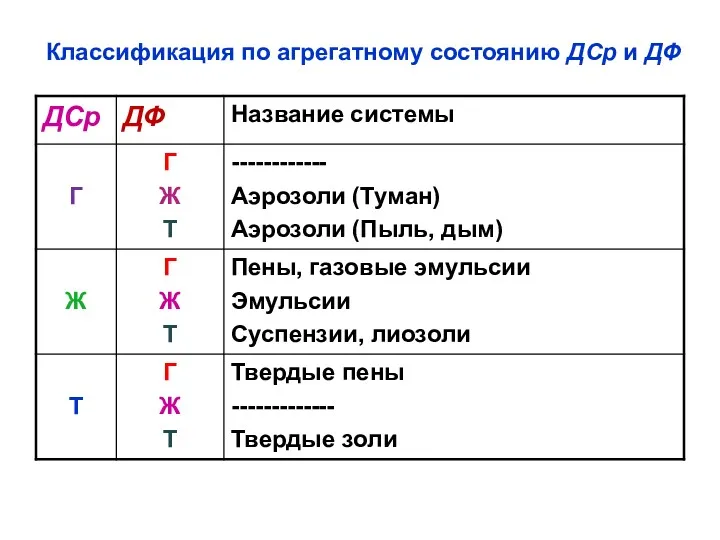
- 26. Классификация по агрегатному состоянию ДСр и ДФ
- 27. Суспензии Основные понятия. Классификация дисперсных систем
- 28. Эмульсии Основные понятия. Классификация дисперсных систем
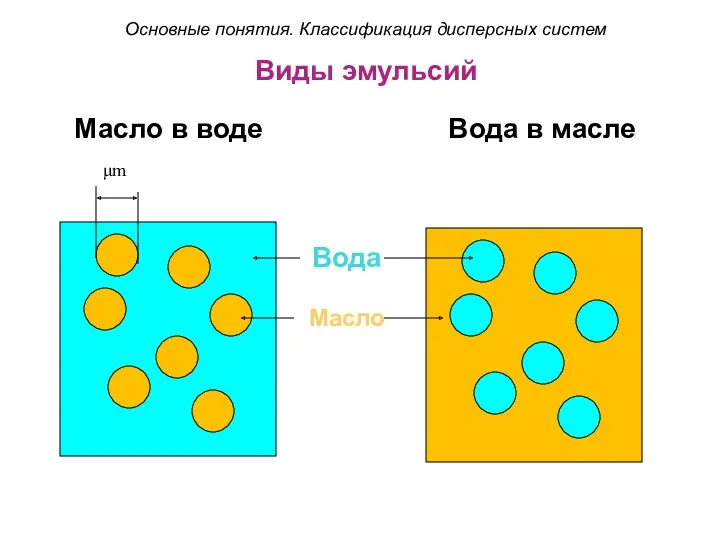
- 29. Виды эмульсий Масло в воде Вода в масле Вода Масло μm Основные понятия. Классификация дисперсных систем
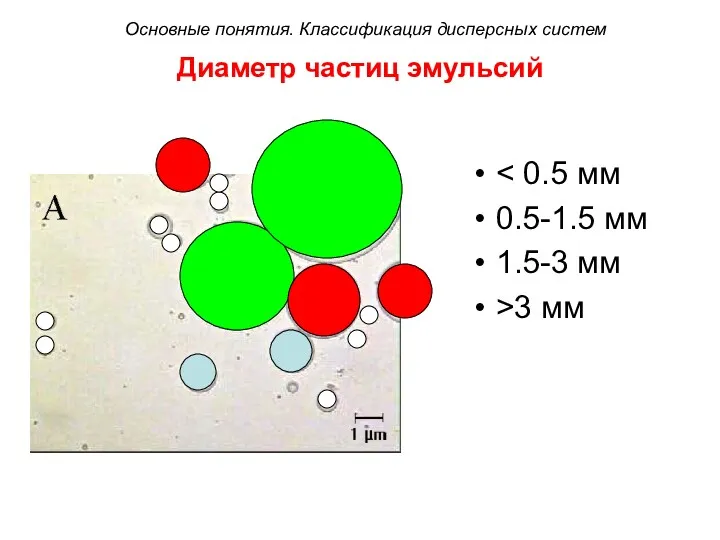
- 30. Диаметр частиц эмульсий 0.5-1.5 мм 1.5-3 мм >3 мм Основные понятия. Классификация дисперсных систем
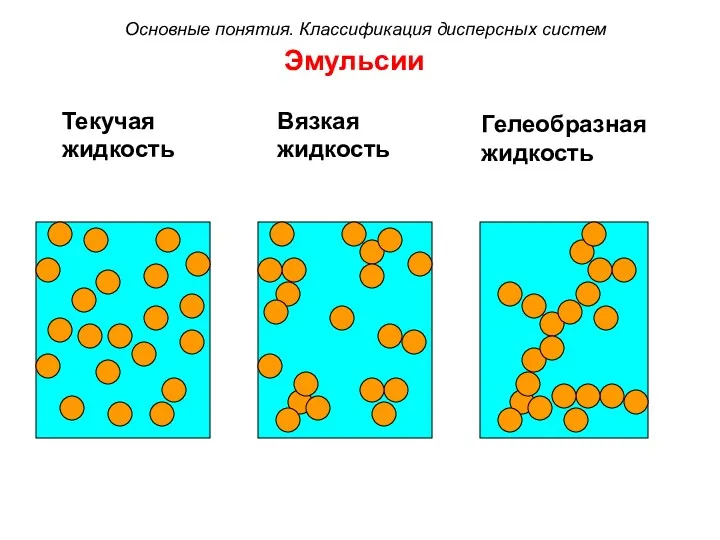
- 31. Эмульсии Текучая жидкость Вязкая жидкость Гелеобразная жидкость Основные понятия. Классификация дисперсных систем
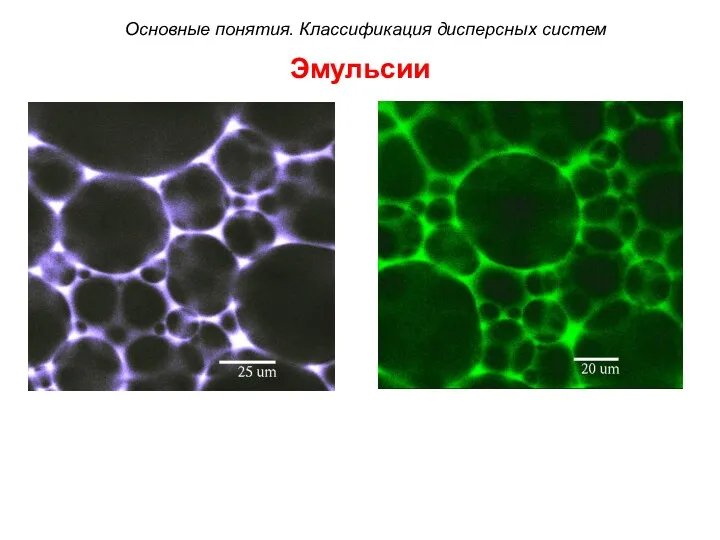
- 32. Эмульсии Основные понятия. Классификация дисперсных систем
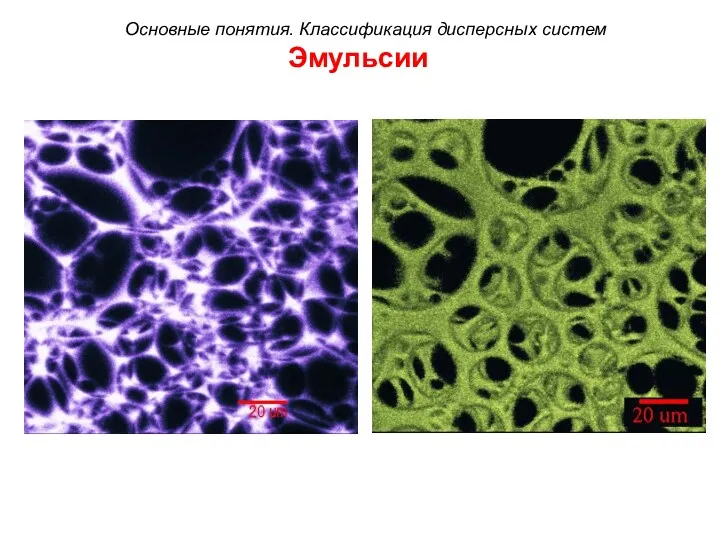
- 33. Эмульсии Основные понятия. Классификация дисперсных систем
- 34. Пена Основные понятия. Классификация дисперсных систем
- 35. Аэрозоль Основные понятия. Классификация дисперсных систем
- 36. По степени связи ДСр и ДФ: системы со слабым взаимодействием между ДФ и ДСр называют лиофобными
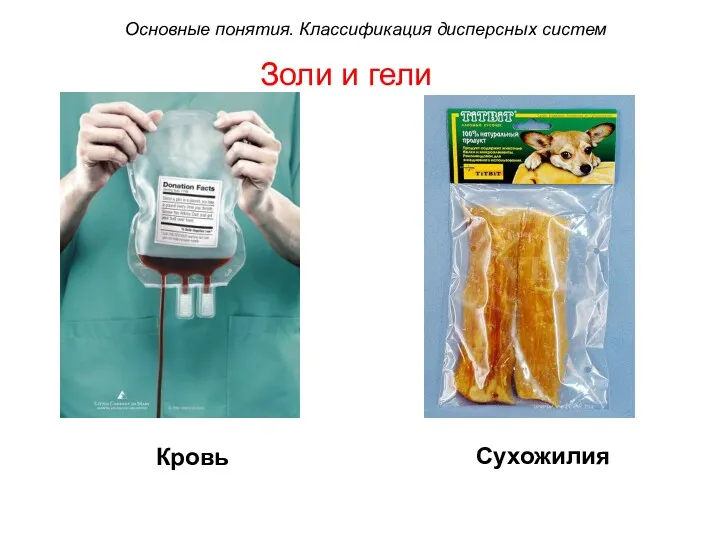
- 37. Золи и гели Кровь Сухожилия Основные понятия. Классификация дисперсных систем
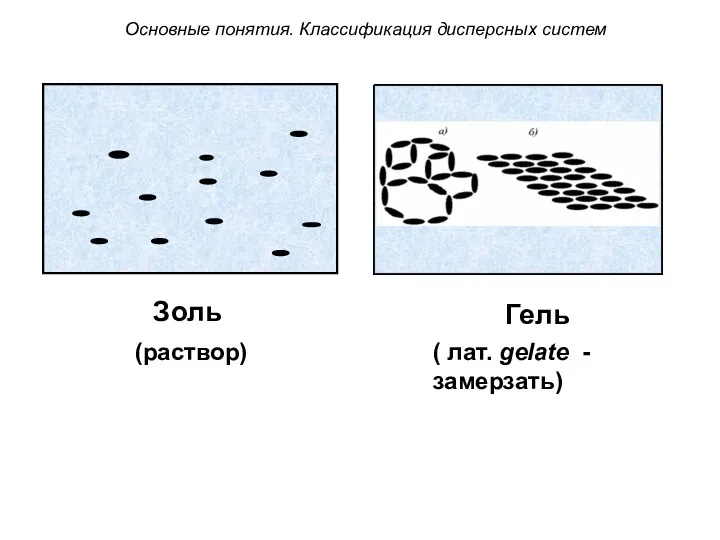
- 38. Золь – бесструктурный коллоидный раствор, в котором частицы ДФ слабо взаимодействуют между собой и свободно передвигаются
- 39. Гель – структурированный коллоидный раствор, в котором частицы ДФ связаны между собой в пространственные структуры типа
- 40. ( лат. gelate - замерзать) (раствор) Золь Гель Основные понятия. Классификация дисперсных систем
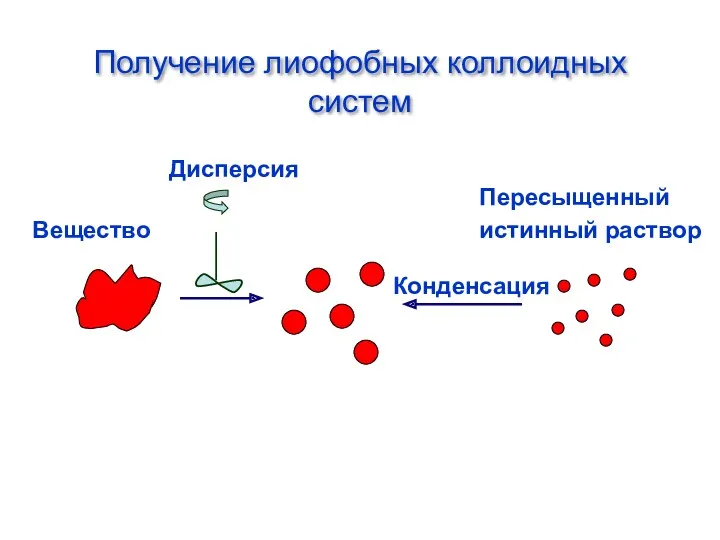
- 41. Методы получения коллоидных растворов По способу достижения коллоидной степени дисперсности различают диспергационные и конденсационные методы получения.
- 42. Получение лиофобных коллоидных систем Вещество Пересыщенный истинный раствор Конденсация Дисперсия
- 43. Методы получения коллоидных растворов Методы диспергирования (от лат. – измельчать) – получение частиц ДФ путем дробления
- 44. Методы диспергирования Коллоидная мельница
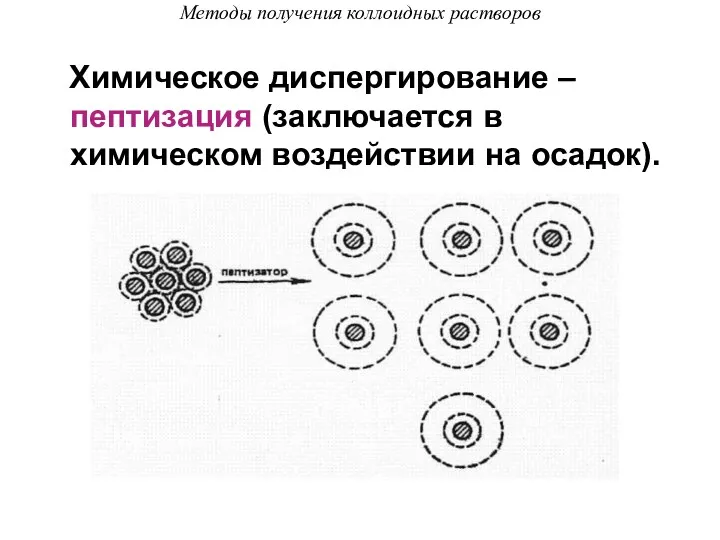
- 45. Методы получения коллоидных растворов Химическое диспергирование – пептизация (заключается в химическом воздействии на осадок).
- 46. Методы получения коллоидных растворов Конденсационные методы (от лат. – укрупнять) – получение частиц ДФ путем объединения
- 47. Методы получения коллоидных растворов Физическая конденсация – это метод замены растворителя. Сначала готовят истинный раствор вещества
- 48. Методы получения коллоидных растворов Химическая конденсация – для получения коллоидных растворов используют любые реакции, в результате
- 49. Химическая конденсация Чтобы в ходе реакции образовался коллоидный раствор, необходимо соблюдение, по крайней мере, трех условий:
- 50. Примеры реакций химической конденсации
- 51. Методы очистки коллоидных растворов На этом основана очистка коллоидных растворов от низкомолекулярных веществ (диализ, фильтрация, ультрацентрифугирование).
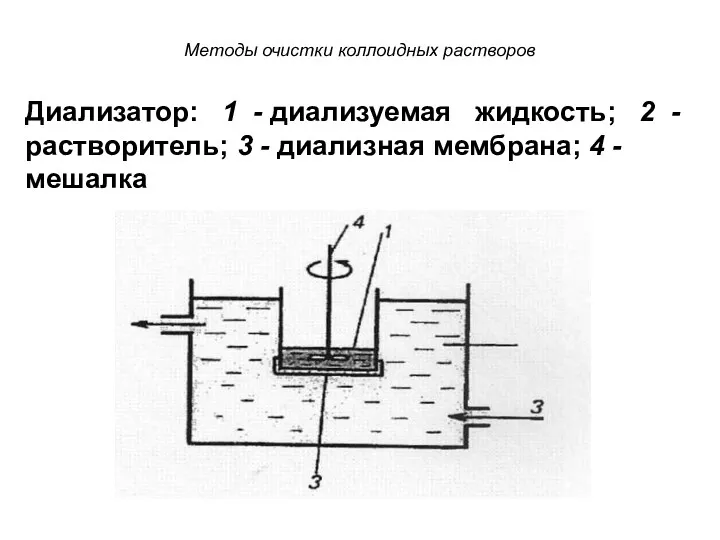
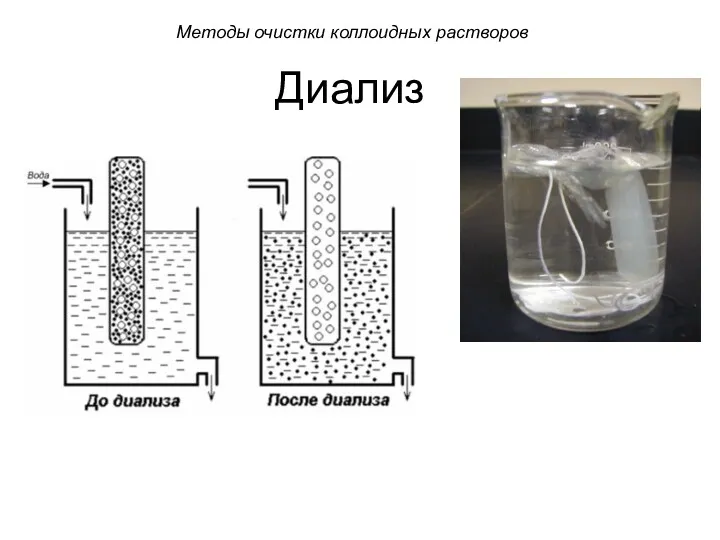
- 52. Диализ Диализ проводят с помощью прибора - диализатора. Он состоит из 2 сосудов, отделенных полупроницаемой мембраной,
- 53. Методы очистки коллоидных растворов Диализатор: 1 - диализуемая жидкость; 2 - растворитель; 3 - диализная мембрана;
- 54. Диализ Методы очистки коллоидных растворов
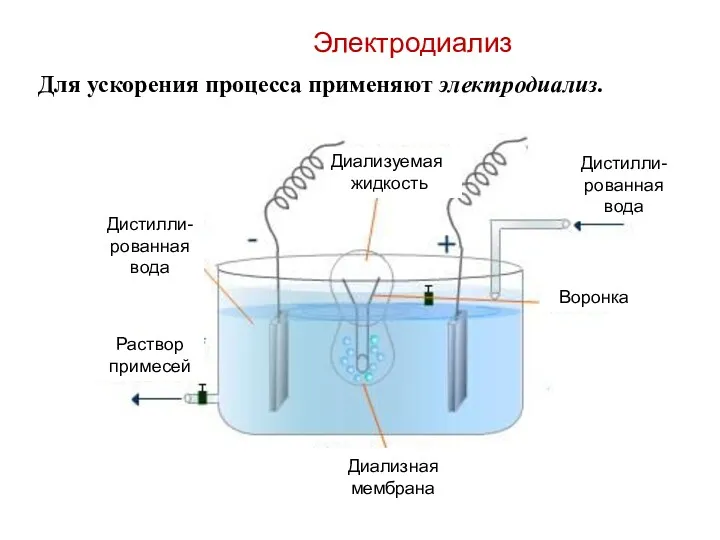
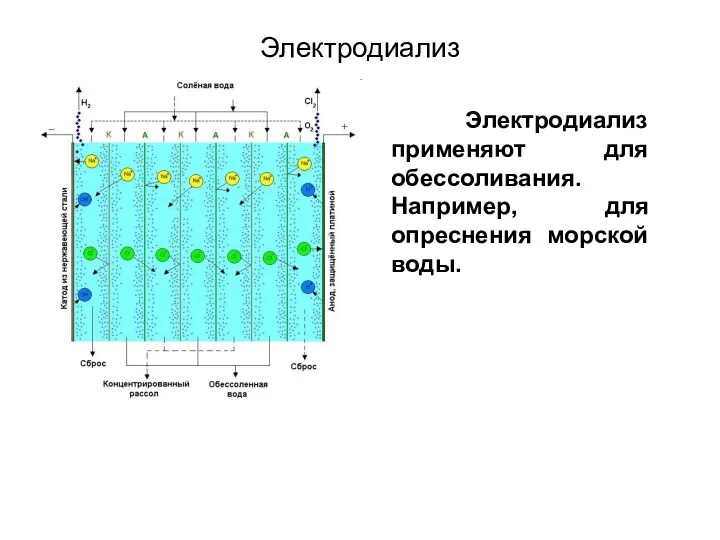
- 55. Для ускорения процесса применяют электродиализ. Электродиализ Диализуемая жидкость Диализная мембрана Раствор примесей Дистилли-рованная вода Дистилли-рованная вода
- 56. Электродиализ Электродиализ применяют для обессоливания. Например, для опреснения морской воды.
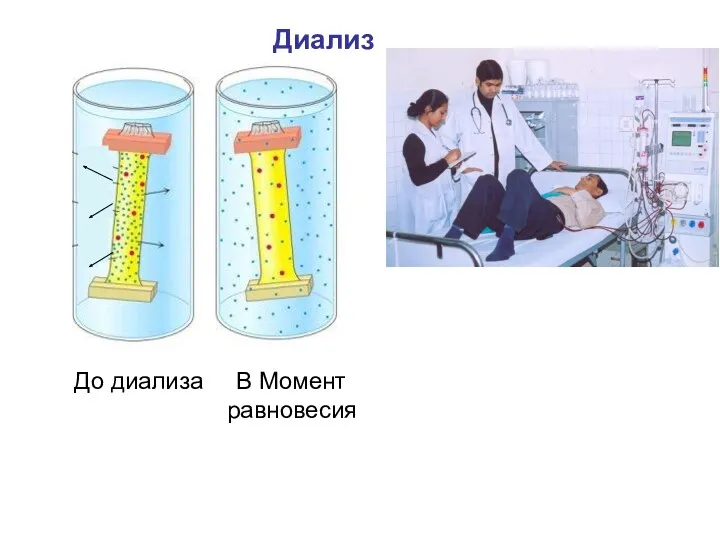
- 57. Диализ По принципу компенсационного диализа работает аппарат «искусственная почка». Аппарат подключают к системе кровообращения больного, кровь
- 58. Диализ До диализа В Момент равновесия
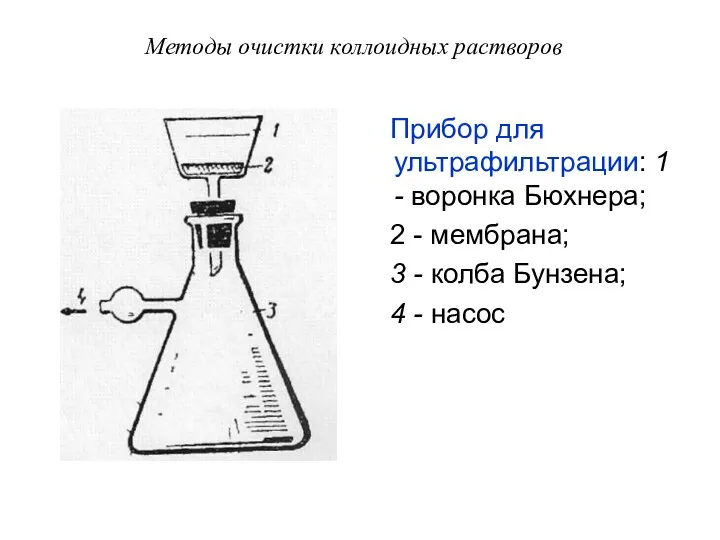
- 59. Методы очистки коллоидных растворов Для очистки коллоидных растворов от грубодисперсных частиц проводят фильтрование через обычные бумажные
- 60. Методы очистки коллоидных растворов Прибор для ультрафильтрации: 1 - воронка Бюхнера; 2 - мембрана; 3 -
- 61. Методы очистки коллоидных растворов Для разделения частиц ДФ, имеющих различную массу, применяют ультрацентрифугирование. При этом разделение
- 62. В коллоидных системах структурной единицей является мицелла. Строение мицеллы гидрофобных систем Строение коллоидных частиц и возникновение
- 63. Строение мицеллы Заряд на коллоидных частицах возникает либо за счет ионизации молекул, находящихся на поверхности твердой
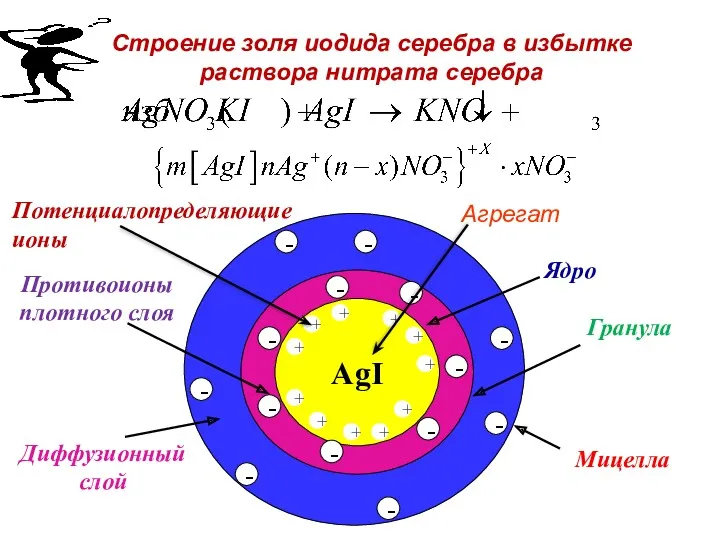
- 64. Строение мицеллы Рассмотрим второй случай – образование мицеллы AgI в KI. AgNO3 + KI (избыток) =
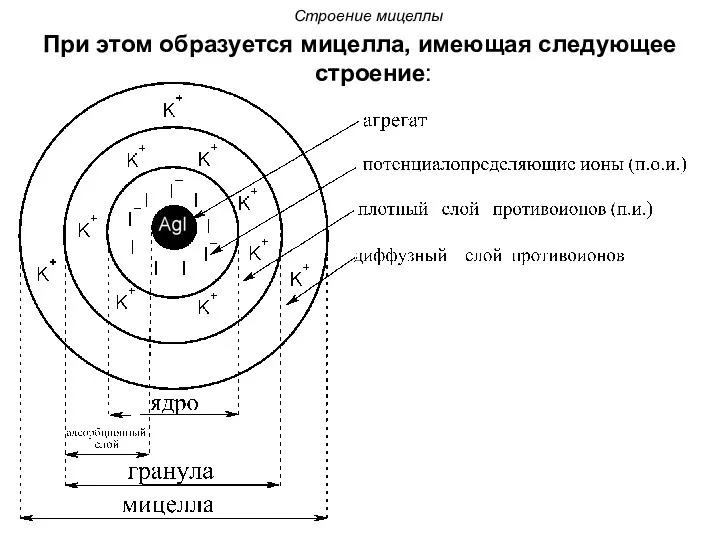
- 65. Строение мицеллы При этом образуется мицелла, имеющая следующее строение:
- 66. Строение мицеллы Осадок AgI является агрегатом мицеллы. На твердой кристаллической поверхности осадка в соответствии с правилом
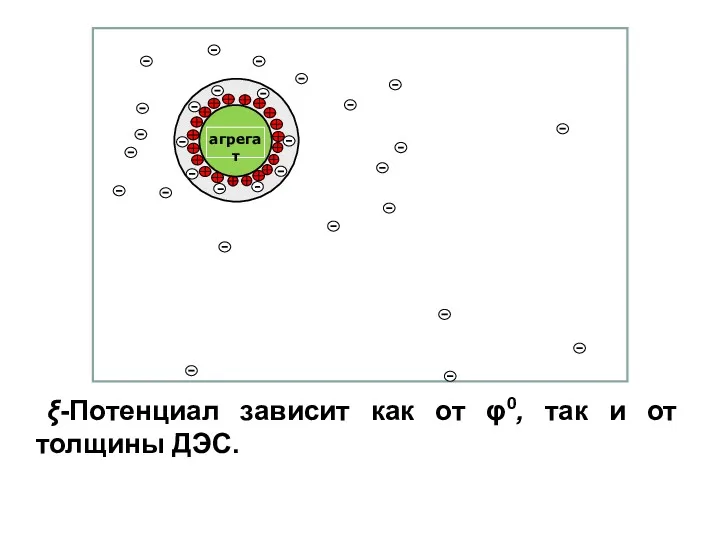
- 67. Строение мицеллы Агрегат и потенциалопределяющие ионы составляют ядро мицеллы. К отрицательному заряду будут притягиваться противоионы K+,
- 68. Строение мицеллы Адсорбционный слой вместе с агрегатом составляют гранулу (или частицу). Гранула заряжена, её заряд определятся
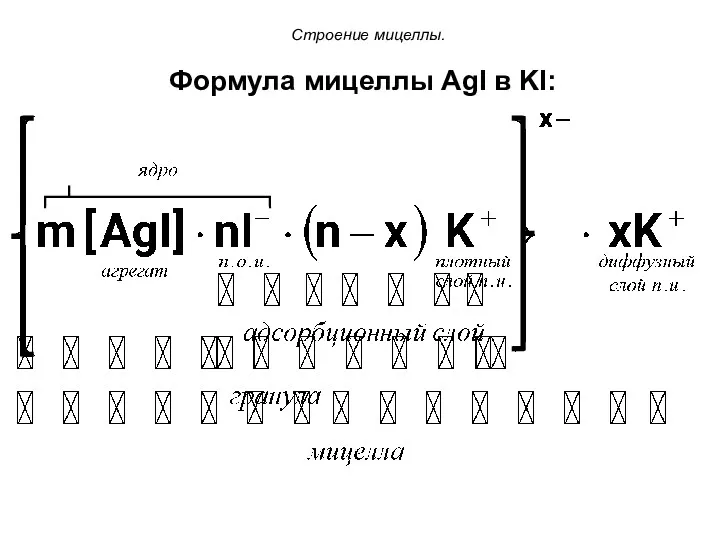
- 69. Строение мицеллы. Формула мицеллы AgI в KI:
- 70. Строение мицеллы Ионы стабилизатора, адсорбируясь на поверхности агрегата, образуют ионогенную часть мицеллы, которая по своему строению
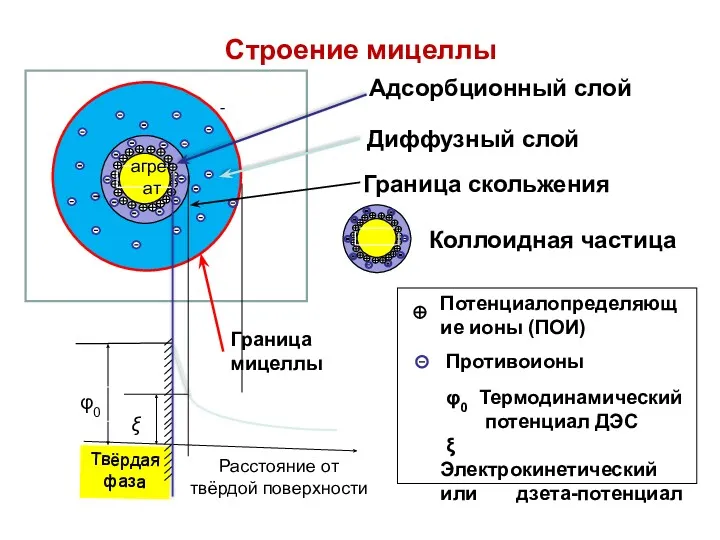
- 71. Электрокинетический потенциал В мицелле выделяют две границы: Граница раздела фаз - проходит между потенциалопределяющими ионами и
- 72. Электрокинетический потенциал Граница скольжения - проходит между гранулой и диффузным слоем. На границе скольжения возникает электрокинетический
- 73. Твёрдая фаза Расстояние от твёрдой поверхности Граница скольжения Потенциалопределяющие ионы (ПОИ) Противоионы φ0 Термодинамический потенциал ДЭС
- 74. Электрокинетический потенциал Название кинетический связано с тем, что его рассчитывают по скорости движения частиц дисперсной фазы
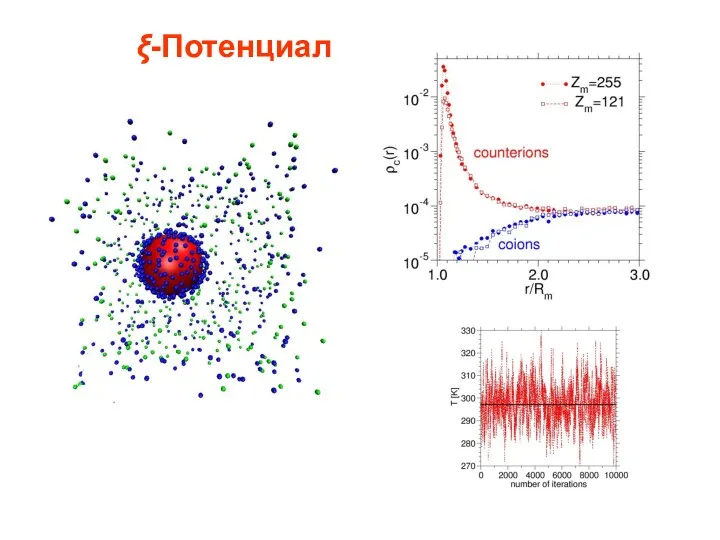
- 75. ξ-Потенциал зависит как от φ0, так и от толщины ДЭС.
- 76. ξ-Потенциал
- 77. Электрокинетический потенциал. Чем больше заряд гранулы и, соответственно, величина дзета-потенциала, тем устойчивее коллоидный раствор. Наличие одноименного
- 78. Изоэлектрическое состояние мицеллы С увеличением концентрации электролита часть ионов из диффузного слоя может перейти в адсорбционный
- 79. Изоэлектрическое состояние мицеллы В этом случае говорят об изоэлектрическом состоянии мицеллы, которое характеризуется электронейтральным состоянием гранулы.
- 80. Изоэлектрическое состояние мицеллы В изоэлектрическом состоянии коллоидные частицы наименее устойчивы, наиболее склонны к коагуляции и седиментации.
- 81. Вопросы для самоконтроля Какие дисперсные системы называются коллоидными растворами? Как можно классифицировать методы получения коллоидных растворов?
- 82. Диффузионный слой Строение золя иодида серебра в избытке раствора нитрата серебра AgI + + + +
- 84. Скачать презентацию


















































 Жұқпалы аурулар iндетi пайда болу қаупi төнген жағдайда шектеу шараларын қарастыру
Жұқпалы аурулар iндетi пайда болу қаупi төнген жағдайда шектеу шараларын қарастыру Закаливание. Польза закаливания
Закаливание. Польза закаливания Лекарственные средства используемые в анестезиологии и интенсивной терапии
Лекарственные средства используемые в анестезиологии и интенсивной терапии Тіс, тіс қатарлары ақауын емдеу
Тіс, тіс қатарлары ақауын емдеу Диссеминированный туберкулез легких
Диссеминированный туберкулез легких Острая массивная кровопотеря
Острая массивная кровопотеря Бронхоэктаз ауруы
Бронхоэктаз ауруы Венозный доступ в интенсивной терапии
Венозный доступ в интенсивной терапии Бронхиальная астма и хобл: особенности диагностики и лечения
Бронхиальная астма и хобл: особенности диагностики и лечения Антигены. Антитела
Антигены. Антитела Диффузный токсический зоб и беременность
Диффузный токсический зоб и беременность Диспансеризация беременных женщин
Диспансеризация беременных женщин Хроническая почечная недостаточность
Хроническая почечная недостаточность Аппендицит. Диагностика. Техника оперативного лечения
Аппендицит. Диагностика. Техника оперативного лечения Біохімічні механізми розвитку та зміни при карієсі. Роль фтору та інших мікроелементів в карієсрезистентності
Біохімічні механізми розвитку та зміни при карієсі. Роль фтору та інших мікроелементів в карієсрезистентності Обзор рекомендаций ESC 2017 по лечению заболеваний периферических артерий
Обзор рекомендаций ESC 2017 по лечению заболеваний периферических артерий Реабилитация больных, перенесших инсульт
Реабилитация больных, перенесших инсульт Инсульт. Первая медицинская помощь при инсульте
Инсульт. Первая медицинская помощь при инсульте Аллергия. Провоцирующие факторы и факторы риска развития аллергии
Аллергия. Провоцирующие факторы и факторы риска развития аллергии Система гигиенических мероприятий по созданию охранительного режима и благоприятных условий пребывания больных в ЛПУ
Система гигиенических мероприятий по созданию охранительного режима и благоприятных условий пребывания больных в ЛПУ ВІЛ-інфекція. СНІД-асоційовані інфекції та інвазії Історія відкриття. Етіологія. Епідеміологія. Патогенез. Клінічні прояви
ВІЛ-інфекція. СНІД-асоційовані інфекції та інвазії Історія відкриття. Етіологія. Епідеміологія. Патогенез. Клінічні прояви Артериальная гипертония, факторы риска и их коррекция
Артериальная гипертония, факторы риска и их коррекция Нейропсихологическая характеристика младших школьников (лекция 4)
Нейропсихологическая характеристика младших школьников (лекция 4) Нарушение кровообращения. Лекция
Нарушение кровообращения. Лекция Правовое обеспечение профессиональной деятельности фармацевтов (1)
Правовое обеспечение профессиональной деятельности фармацевтов (1) Психология здоровья
Психология здоровья Созылмалы гастриттердің визуальды диагностикасы
Созылмалы гастриттердің визуальды диагностикасы Выявление факторов риска и диагностика железодефицитной анемии у пациентов детского возраста
Выявление факторов риска и диагностика железодефицитной анемии у пациентов детского возраста