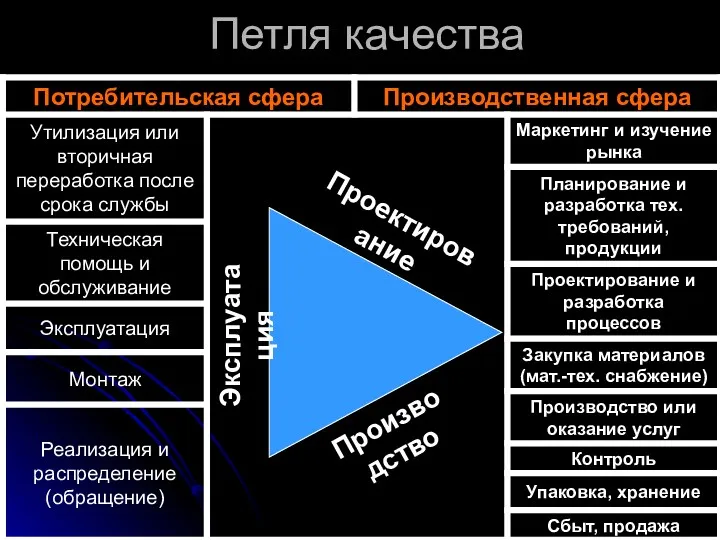
Отличия лекарственного препарата от другой продукции
Поскольку основной вид контроля качества лекарств
- разрушающий, редко используется сортировка на основе 100% проверки сомнительных по качеству серий с удалением бракованной продукции.
По этому не только потребитель, но и производитель заинтересованы в том, чтобы исключить или свести к минимуму вероятность изготовления некачественных лекарств.
Обнаружив в купленном лекарстве дефект, потребитель не может "отремонтировать" его или поменять на другой, бездефектный.
Исключена возможность официальной реализации по "сниженным ценам" субстандартных лекарств, с истекшим или истекающим сроком годности.
Пациент вынужден доверять всем:
разработчику, исследователю, производителю, врачу.
Такая особенность лекарственных препаратов как товара заставила установить требования к основным этапам их обращения: разработке, испытанию,
регистрации, производству, хранению и т. д.












 Рак предстательной железы
Рак предстательной железы Синдром Клайнфельтера
Синдром Клайнфельтера Школа здоровья для пациентов с ишемической болезнью сердца
Школа здоровья для пациентов с ишемической болезнью сердца Сущность и особенности оценки качества медицинской помощи. Формирование стандартов качества различных видов медицинской помощи
Сущность и особенности оценки качества медицинской помощи. Формирование стандартов качества различных видов медицинской помощи Экология микроорганизмов. Микрофлора почвы, воды, воздуха. Роль внешней среды в распространении и передаче патогенных микробов
Экология микроорганизмов. Микрофлора почвы, воды, воздуха. Роль внешней среды в распространении и передаче патогенных микробов Артериялық гипертензия
Артериялық гипертензия Быстропрогрессирующий гломерулонефрит
Быстропрогрессирующий гломерулонефрит Мезенхимальные дистрофии
Мезенхимальные дистрофии Боковой амиотрофический склероз
Боковой амиотрофический склероз Острый тяжелый панкреатит. Современные принципы диагностики и лечения
Острый тяжелый панкреатит. Современные принципы диагностики и лечения Классификация антибиотиков и механизмы их действия. БЛРС
Классификация антибиотиков и механизмы их действия. БЛРС Вірусні гепатити у дітей
Вірусні гепатити у дітей Monitorowanie układu krążenia
Monitorowanie układu krążenia Хронический гастрит
Хронический гастрит Здорове харчування. Поживні речовини
Здорове харчування. Поживні речовини Лоскуты в пластической хирургии головы и шеи
Лоскуты в пластической хирургии головы и шеи Острое инфекционное заболевание дифтерия
Острое инфекционное заболевание дифтерия Государственная политика и система здравоохранения в Российской Федерации
Государственная политика и система здравоохранения в Российской Федерации Первинний огляд новонародженої дитини
Первинний огляд новонародженої дитини Оценка эффективности оперативного вмешательства при ДГПЖ (доброкачественная гиперплазия предстательной железы)
Оценка эффективности оперативного вмешательства при ДГПЖ (доброкачественная гиперплазия предстательной железы)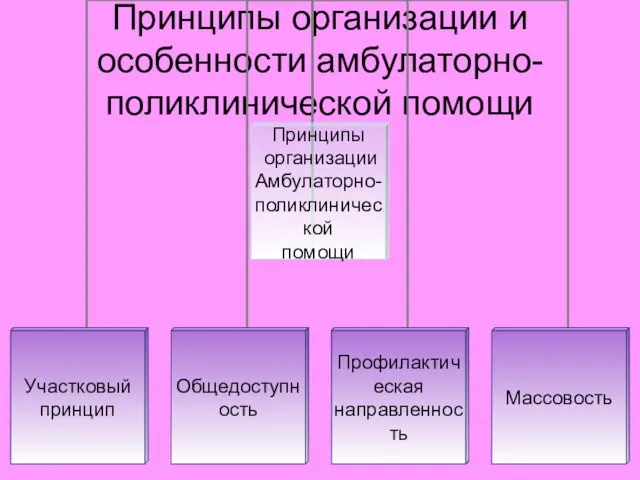 Принципы организации и особенности амбулаторно-поликлинической помощи
Принципы организации и особенности амбулаторно-поликлинической помощи Клиническая классификация туберкулеза
Клиническая классификация туберкулеза Основы детского массажа
Основы детского массажа Қызыл иектің ультраструктурасы, қызыл иек сайы,қызыл иек сұйықтығы
Қызыл иектің ультраструктурасы, қызыл иек сайы,қызыл иек сұйықтығы Первая медицинская помощь при неотложных состояниях
Первая медицинская помощь при неотложных состояниях Техника забора анализов, правила хранения и транспортировки
Техника забора анализов, правила хранения и транспортировки Жүрек гистологиясы. Жүректің өткізуші жүйесінің морфофункциялық ерекшеліктері
Жүрек гистологиясы. Жүректің өткізуші жүйесінің морфофункциялық ерекшеліктері Вирус папилломы человека (ВПЧ)
Вирус папилломы человека (ВПЧ)