Інструментальні методи проведення загального аналізу крові: помилки та інтерпритація результатів гематологічного аналізатора презентация
Содержание
- 2. Підготував: спеціаліст по продукції ТОВ «Діамеб» к.х.н. , Святослав Половкович
- 3. Помилки лабораторної діагностики у гематології
- 4. Преаналітичний Позалабораторна частина Призначення аналізу Підготовка пацієнта Забір матеріалу Ідентифікація проб Транспортування проб Лабораторна частина Реєстрація
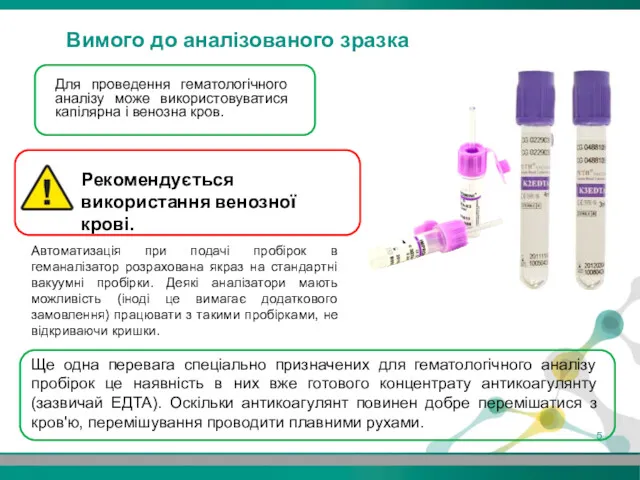
- 5. Для проведення гематологічного аналізу може використовуватися капілярна і венозна кров. Ще одна перевага спеціально призначених для
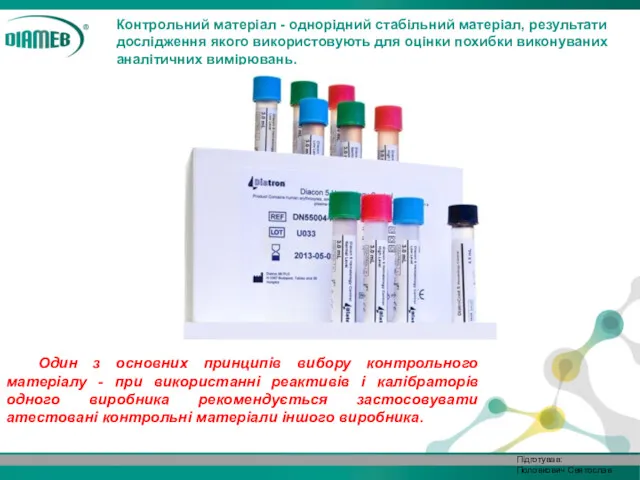
- 6. Контрольний матеріал - однорідний стабільний матеріал, результати дослідження якого використовують для оцінки похибки виконуваних аналітичних вимірювань.
- 7. якістю використовуваних реагентів; точністю дозування цільної або розведеної крові; точністю дозування ізотонічного розчину при розведенні крові;
- 8. Автоматизований аналіз крові: інтерпретація результатів та можливі відхилення
- 9. Досліджувані параметри RBC red blood cell count (еритроцити) MCV mean corpuscular volume (середній обєм еритроцитів) RDWcv
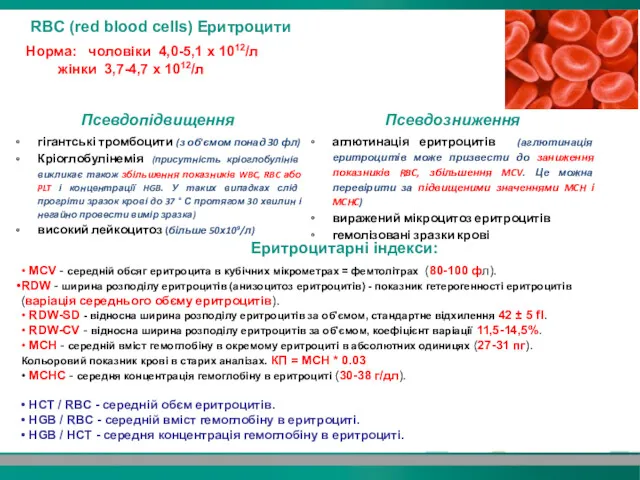
- 10. RBC (red blood cells) Еритроцити Норма: чоловіки 4,0-5,1 х 1012/л жінки 3,7-4,7 х 1012/л • MCV
- 11. МСV (Mean Corpuscular Volume) – средній обєм еритроцитів крові MCV - середній обєм еритроцитів в кубічних
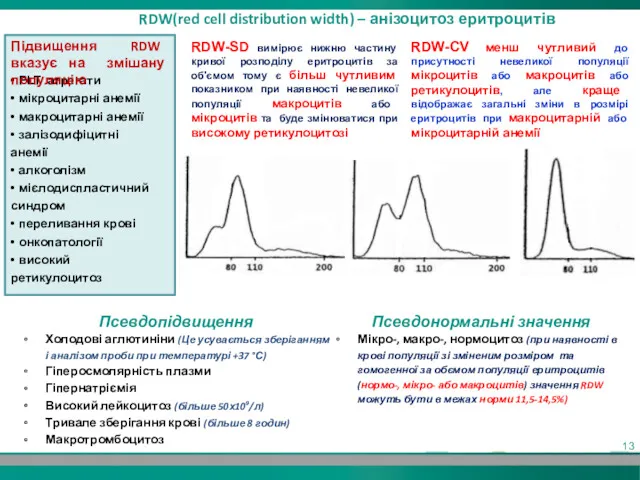
- 12. RDW(red cell distribution width) – анізоцитоз еритроцитів RDW-CV - відносна ширина розподілу еритроцитів за об'ємом (коефіцієнт
- 13. • PLT агрегати • мікроцитарні анемії • макроцитарні анемії • залізодифіцитні анемії • алкоголізм • мієлодиспластичний
- 14. HCT (hematocrit) – гематокрит Показник відображає суму прямо виміряних об'ємів еритроцитів в одиниці об'єму крові. Таким
- 15. MCH (mean corpuscular hemoglobin) - середній вміст гемоглобіну в еритроциті MCH характеризує середній вміст гемоглобіну в
- 16. Однією з можливих причин підвищення MCHC є гемоліз в пробі MCHC (mean corpuscular hemoglobin concentration) середня
- 17. PLT (platelet count) Тромбоцити Норма: 150-400 х 109/л Фізіологічні коливання відзначаються в залежності від часу доби
- 18. MPV (mean platelet volume) - середній обєм тромбоцитів MPV відображає якісні характеристики - старі клітини мають
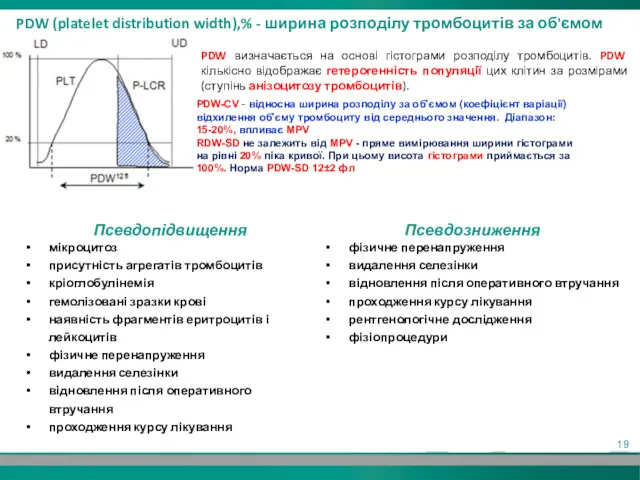
- 19. PDW (platelet distribution width),% - ширина розподілу тромбоцитів за об'ємом PDW визначається на основі гістограми розподілу
- 20. P-LCR (Large Platelet Ratio) - відносна кількість великих тромбоцитів P-LCR (Large Platelet Ratio) -% обєму великих
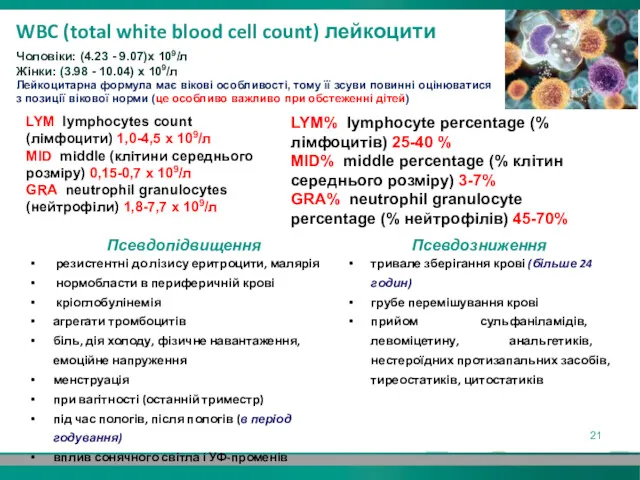
- 21. WBC (total white blood cell count) лейкоцити Чоловіки: (4.23 - 9.07)х 109/л Жінки: (3.98 - 10.04)
- 22. LY і LY%: нормобластоз, резистентні до лізису еритроцити (наприклад, еритроцити, що містять малярійний плазмодій) можуть бути
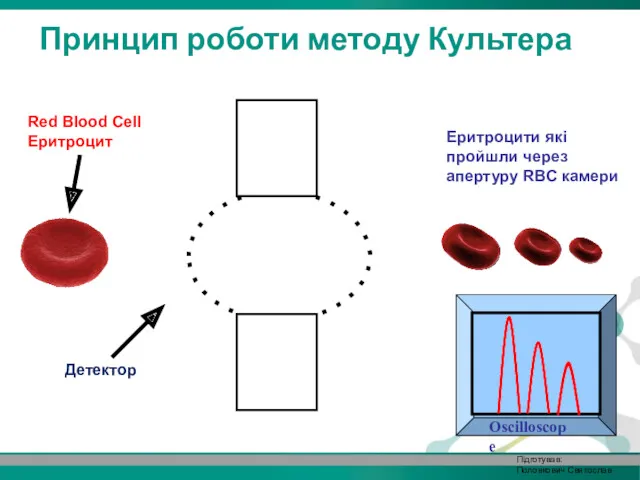
- 23. Детектор Red Blood Cell Еритроцит Принцип роботи методу Культера Еритроцити які пройшли через апертуру RBC камери
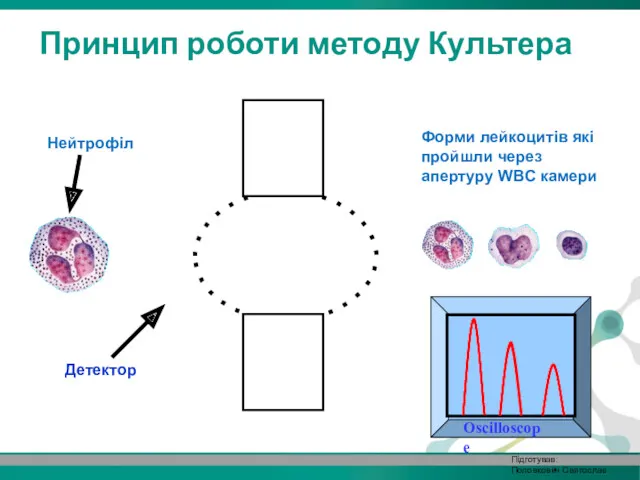
- 24. Oscilloscope Форми лейкоцитів які пройшли через апертуру WBC камери Принцип роботи методу Культера Детектор Нейтрофіл Підготував:
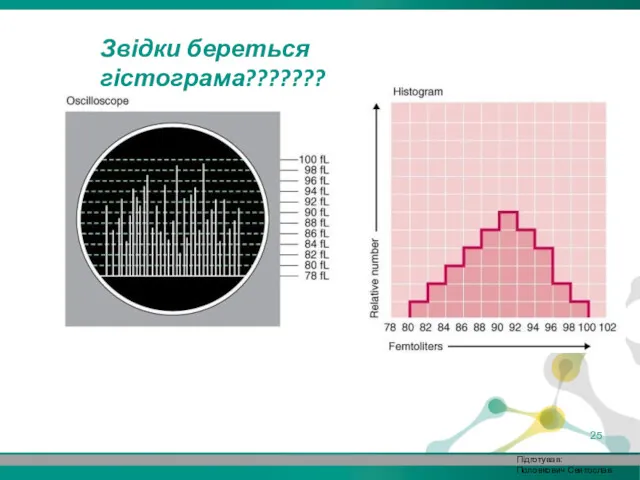
- 25. Звідки береться гістограма??????? Підготував: Половкович Святослав
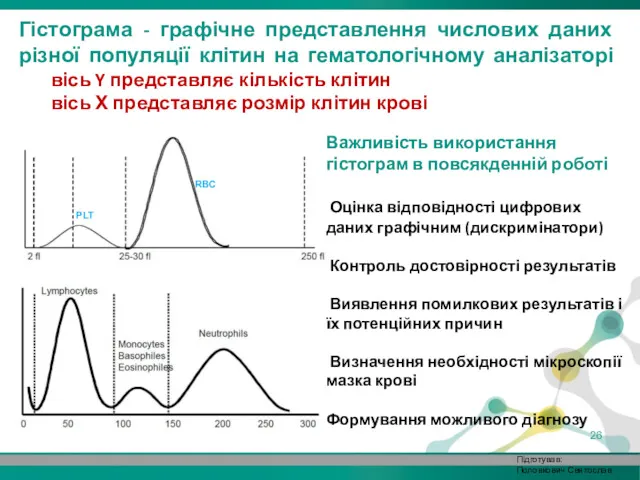
- 26. Важливість використання гістограм в повсякденній роботі Оцінка відповідності цифрових даних графічним (дискримінатори) Контроль достовірності результатів Виявлення
- 27. Дискримінатори ????????????????? Дискримінаційні границі RBC нормальні значення 80-100 fl, що визначаються у діапазоні 30 -250 fl.
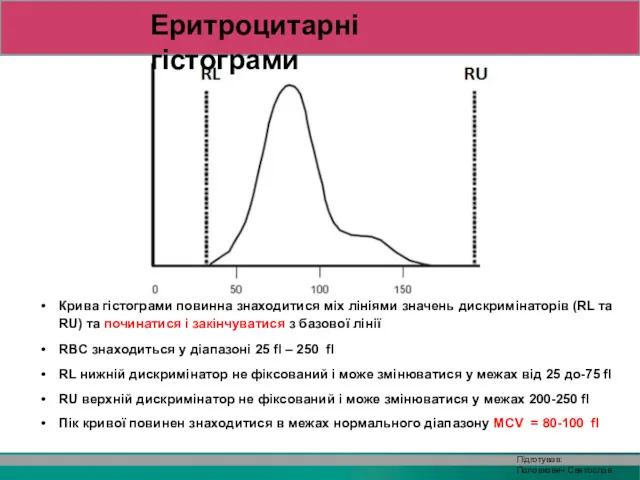
- 28. Еритроцитарні гістограми Крива гістограми повинна знаходитися міх лініями значень дискримінаторів (RL та RU) та починатися і
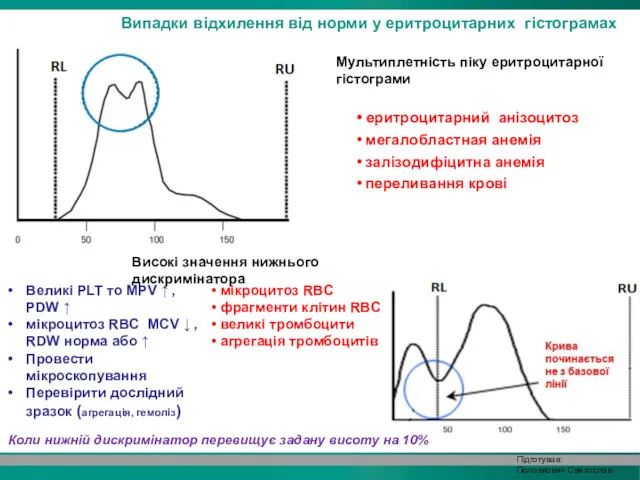
- 29. Випадки відхилення від норми у еритроцитарних гістограмах Мультиплетність піку еритроцитарної гістограми • еритроцитарний анізоцитоз • мегалобластная
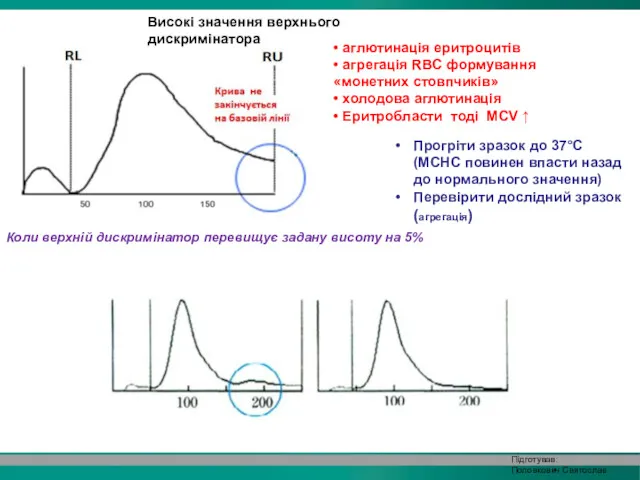
- 30. Високі значення верхнього дискримінатора • аглютинація еритроцитів • агрегація RBC формування «монетних стовпчиків» • холодова аглютинація
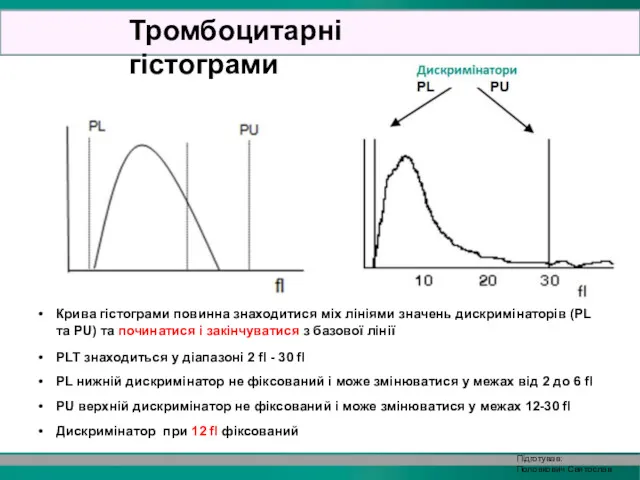
- 31. Крива гістограми повинна знаходитися міх лініями значень дискримінаторів (PL та PU) та починатися і закінчуватися з
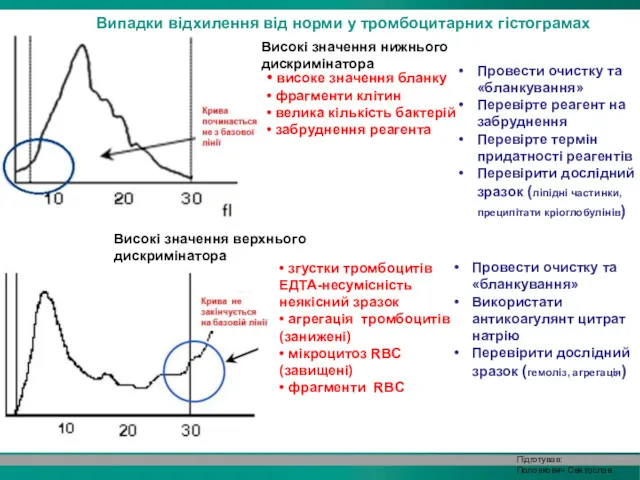
- 32. Випадки відхилення від норми у тромбоцитарних гістограмах • високе значення бланку • фрагменти клітин • велика
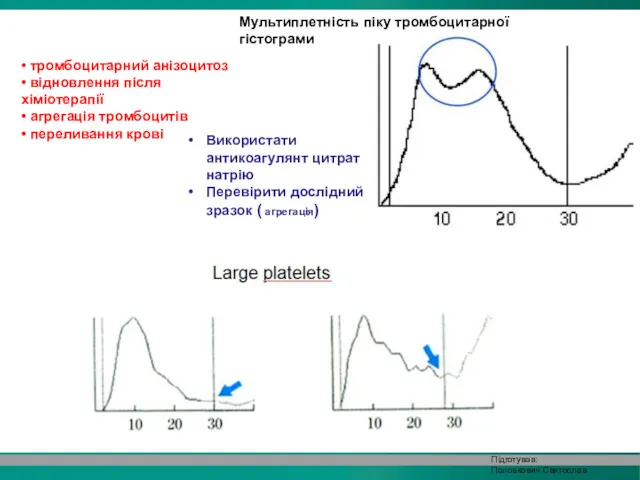
- 33. Мультиплетність піку тромбоцитарної гістограми • тромбоцитарний анізоцитоз • відновлення після хіміотерапії • агрегація тромбоцитів • переливання
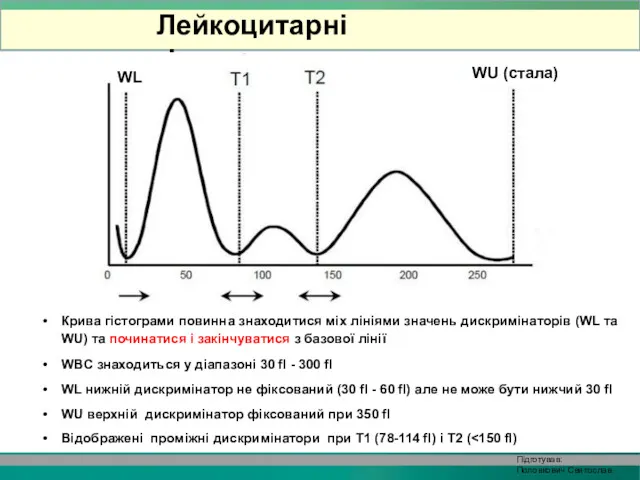
- 34. Крива гістограми повинна знаходитися міх лініями значень дискримінаторів (WL та WU) та починатися і закінчуватися з
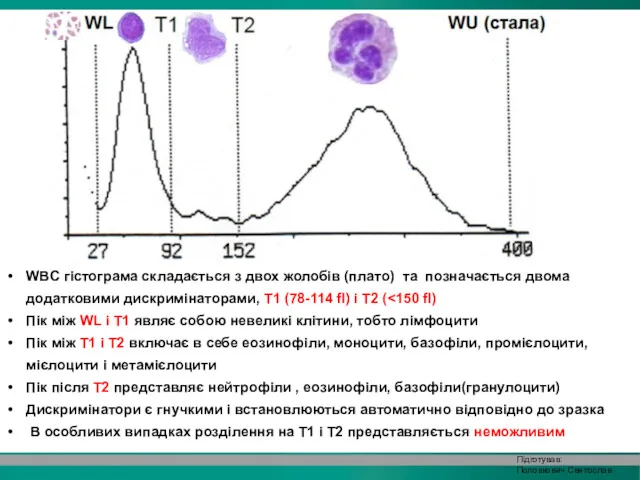
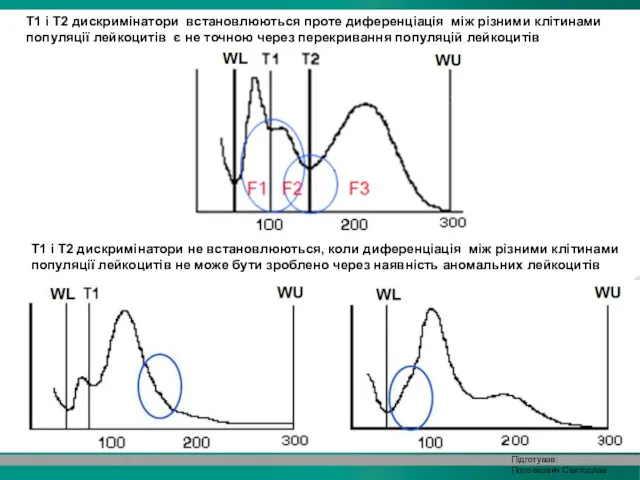
- 35. WBC гістограма складається з двох жолобів (плато) та позначається двома додатковими дискримінаторами, T1 (78-114 fl) і
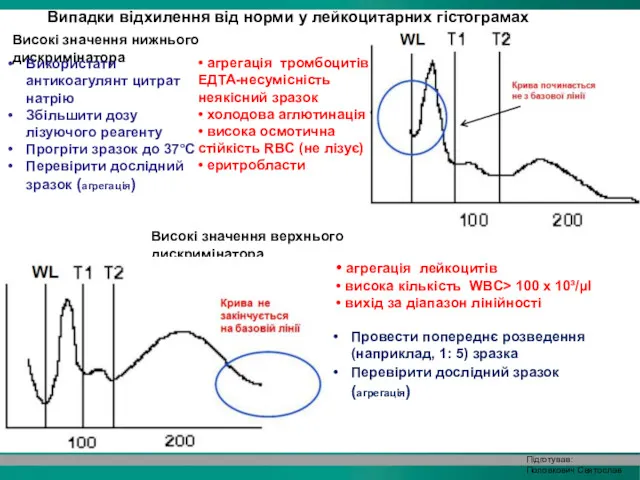
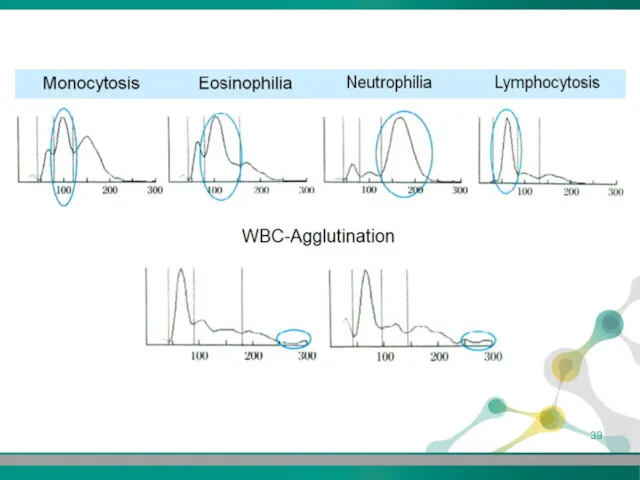
- 36. Випадки відхилення від норми у лейкоцитарних гістограмах Високі значення нижнього дискримінатора • агрегація тромбоцитів ЕДТА-несумісність неякісний
- 37. T1 і T2 дискримінатори не встановлюються, коли диференціація між різними клітинами популяції лейкоцитів не може бути
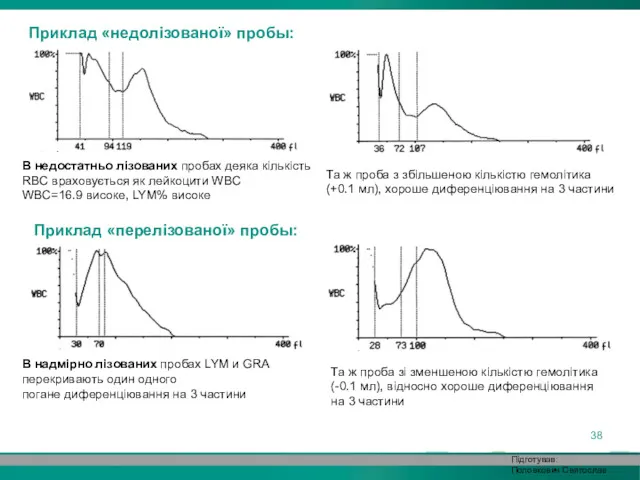
- 38. Підготував: Половкович Святослав Приклад «недолізованої» пробы: В недостатньо лізованих пробах деяка кількість RBC враховується як лейкоцити
- 40. Основні пункти на які потрібно звертати увагу Використовувати венозну кров для проведення аналізу Контролювати зразки, що
- 41. Abacus Junior 30 - ідеальне рішення для малих лабораторій Ключові характеристики та переваги: аналіз крові по
- 42. Abacus 5 Ключові характеристики та переваги: продуктивність 60 тестів/год.; аналіз крові по 26 параметрах з трьома
- 43. м. Івано-Франківськ, вул. Чорновола, 97, +38 (0342) 775 122 +38 (0342) 775 612 sales-west@diameb.ua Дніпро -
- 45. Скачать презентацию

















 Физиология питания. 5 класс
Физиология питания. 5 класс Cепсис. Бактериологические исследования при сепсисе. Антибактериальная терапия
Cепсис. Бактериологические исследования при сепсисе. Антибактериальная терапия Фармакоэкономика негіздері. Формулярлы комитетінің негізгі қызметі мен мақсаттары
Фармакоэкономика негіздері. Формулярлы комитетінің негізгі қызметі мен мақсаттары Неотложные состояния у детей
Неотложные состояния у детей Жүктілік физиологиясы
Жүктілік физиологиясы Гипотензивные средства (антигипертензивные средства)
Гипотензивные средства (антигипертензивные средства) Basics of EKG Interpretation
Basics of EKG Interpretation Опухоли и опухолевидные процессы яичников
Опухоли и опухолевидные процессы яичников Клиническая физиология нервной системы
Клиническая физиология нервной системы Дубильные вещества. Лекарственные растения и лекарственное растительное сырье, содержащие эти вещества
Дубильные вещества. Лекарственные растения и лекарственное растительное сырье, содержащие эти вещества Переливание крови
Переливание крови Средства, влияющие на систему крови
Средства, влияющие на систему крови Острая респираторная инфекция (ОРИ): новые возможности в лечении и профилактике
Острая респираторная инфекция (ОРИ): новые возможности в лечении и профилактике Anatomy of the Breast
Anatomy of the Breast Рак печени
Рак печени Анатомия и физиология мужской половой системы
Анатомия и физиология мужской половой системы Физиология системы крови
Физиология системы крови осложнения острого аппендицита
осложнения острого аппендицита Заболевания, вызванные воздействием промышленных аэрозолей: пневмокониозы. Силикоз. Силикатозы. Металлокониозы. Бисиниозы
Заболевания, вызванные воздействием промышленных аэрозолей: пневмокониозы. Силикоз. Силикатозы. Металлокониозы. Бисиниозы Профилактика и лечение ОРИ и гриппа у беременных
Профилактика и лечение ОРИ и гриппа у беременных Влияние никотина и алкоголя на развитие зародыша человека
Влияние никотина и алкоголя на развитие зародыша человека CAD/CAM — решение для стоматологии
CAD/CAM — решение для стоматологии Основы современной анестезиологии
Основы современной анестезиологии Внутренняя среда организма. Плазма крови
Внутренняя среда организма. Плазма крови Гормональные препараты
Гормональные препараты Особливості використання засобів фізичної терапії при первинному ожирінні підлітків 12-15 років
Особливості використання засобів фізичної терапії при первинному ожирінні підлітків 12-15 років Эндемический крысиный сыпной тиф
Эндемический крысиный сыпной тиф Перевязочный материал
Перевязочный материал