Содержание
- 2. Иммуните́т (лат. immunitas) — освобождение, избавление от чего-либо. Иммунитет в биологии и медицине — невосприимчивость, сопротивляемость
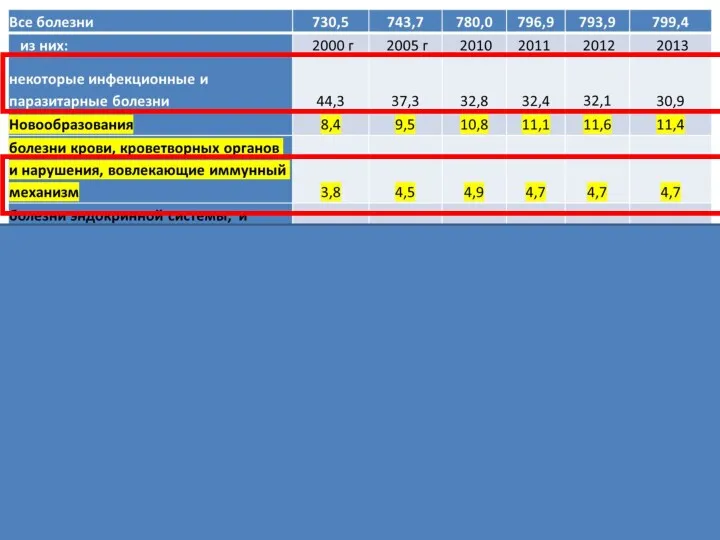
- 4. Первичные иммунодефицитные состояния относятся к группе тяжелых генетически детерминированных заболеваний, вызванных нарушением одного или нескольких иммунных
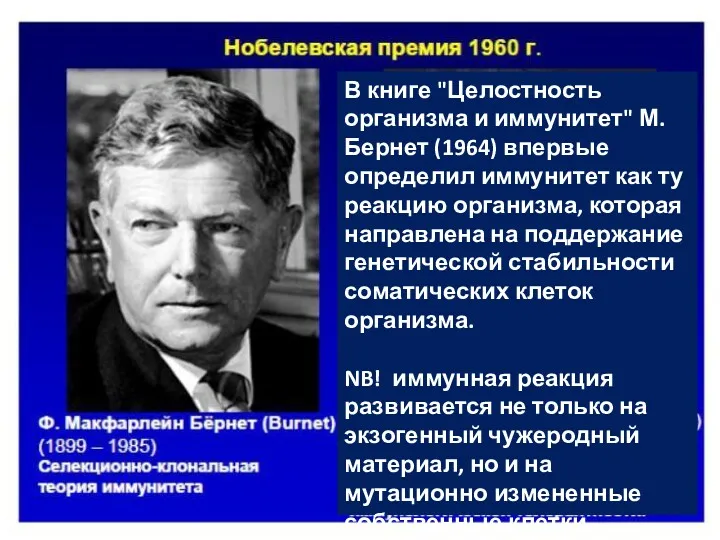
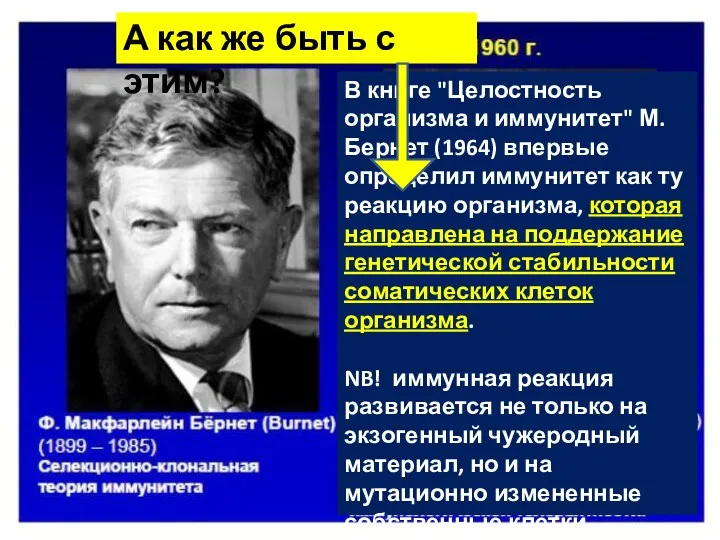
- 5. В книге "Целостность организма и иммунитет" М.Бернет (1964) впервые определил иммунитет как ту реакцию организма, которая
- 6. Неспецифические факторы защиты Противоинфекционную защиту осуществляют: 1) кожа и слизистые оболочки; 2) лимфатические узлы; 3) лизоцим
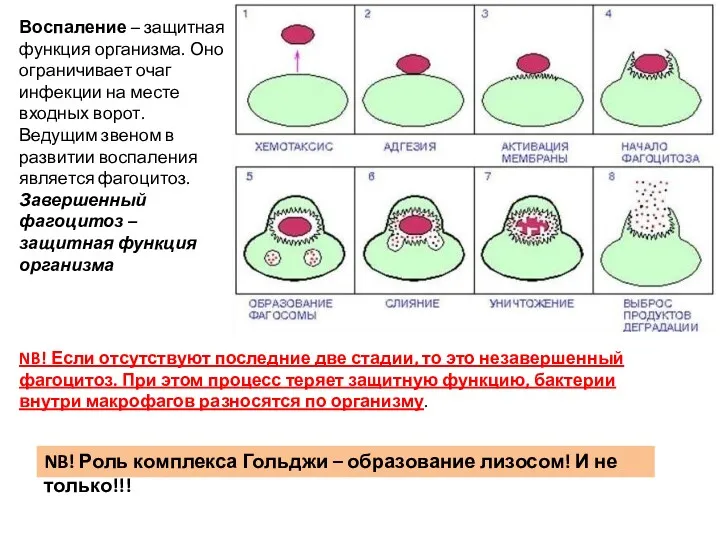
- 7. Фагоцитоз – открыт канадским врачом Уильямом Ослером. Детально изучен И. И. Мечниковым в опытах на кишечнополостных
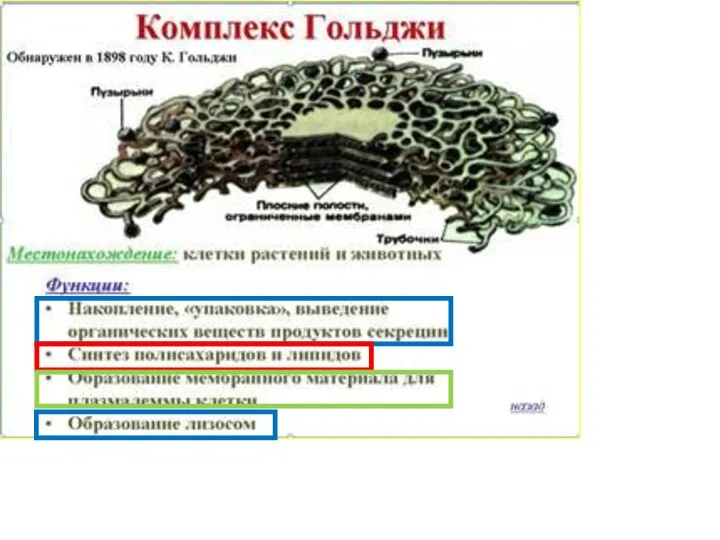
- 8. NB! Роль комплекса Гольджи – образование лизосом! И не только!!! NB! Если отсутствуют последние две стадии,
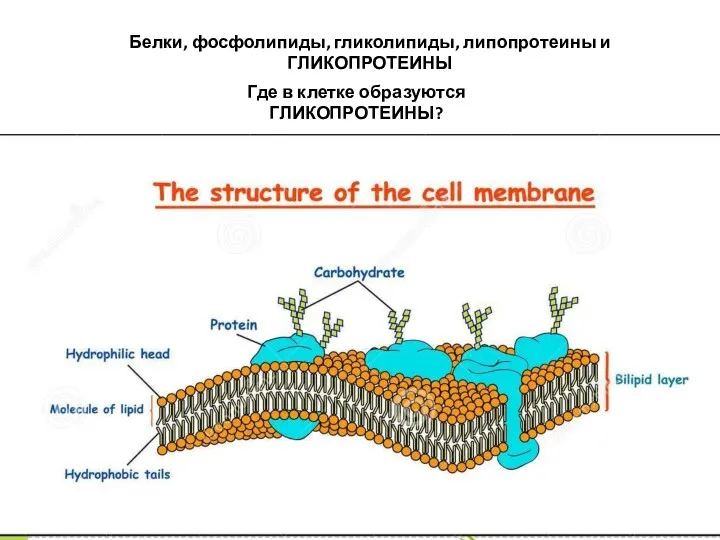
- 12. Белки, фосфолипиды, гликолипиды, липопротеины и ГЛИКОПРОТЕИНЫ Где в клетке образуются ГЛИКОПРОТЕИНЫ?
- 13. Гликопротеины – сложные белки, содержащие, помимо простого белка или пептида, группу гетероолигосахаридов. В настоящее время их
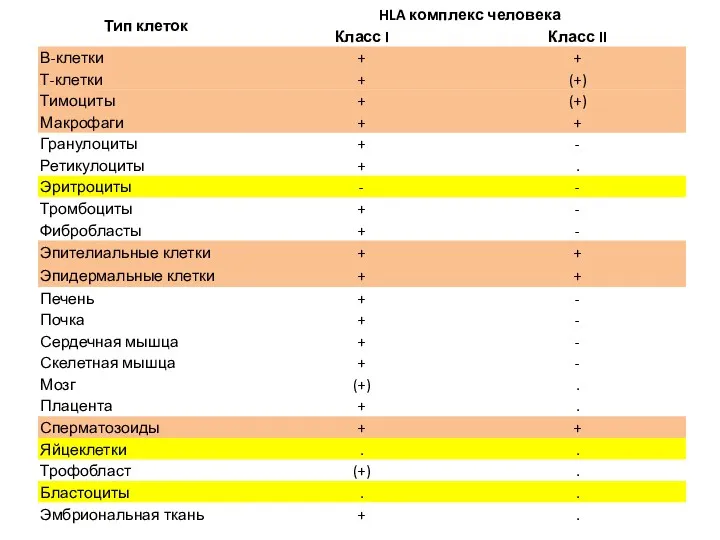
- 14. Главный комплекс гистосовместимости, ГКГ - протяженный участок генома, локализованный у человека в VI хромосоме, в котором
- 17. Важнейшая функция антигенов MHC (HLA) класса II - обеспечение взаимодействия между Т-лимфоцитами и макрофагами в процессе
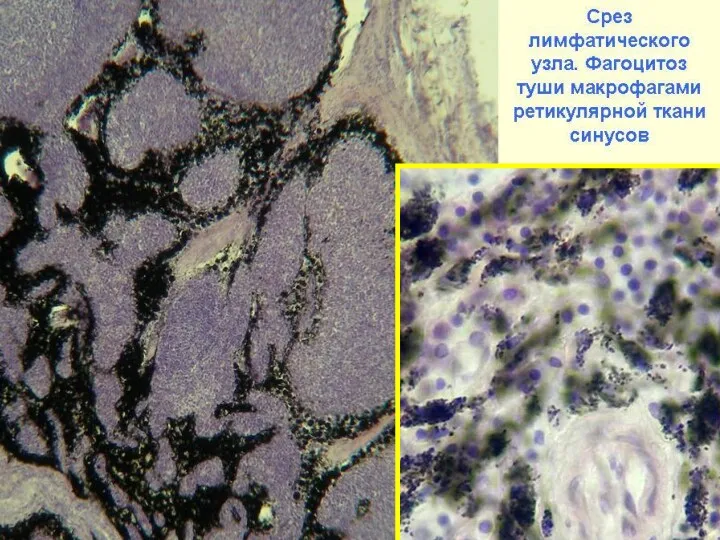
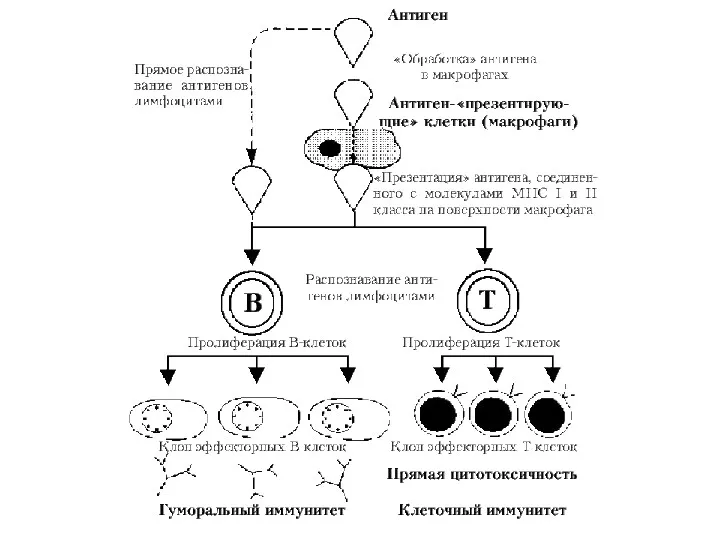
- 18. Антигенпредставляющие клетки: макрофаги, дендритные клетки и В-клетки. Функции - способны усваивать антиген и представлять его в
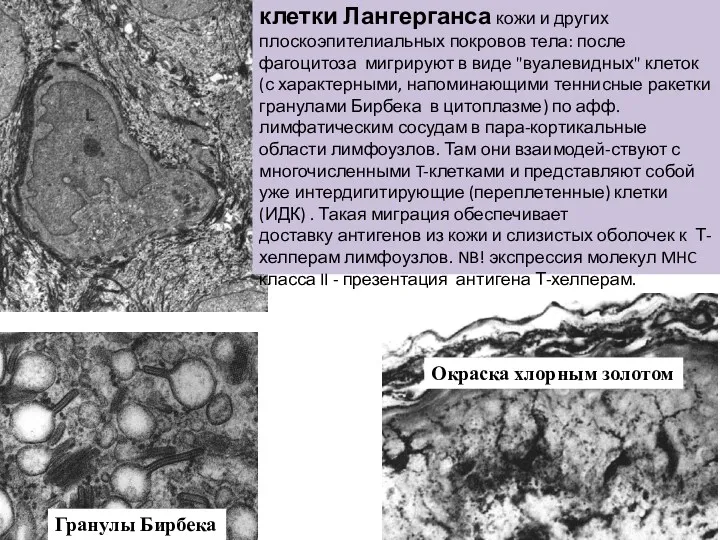
- 19. Гранулы Бирбека Окраска хлорным золотом клетки Лангерганса кожи и других плоскоэпителиальных покровов тела: после фагоцитоза мигрируют
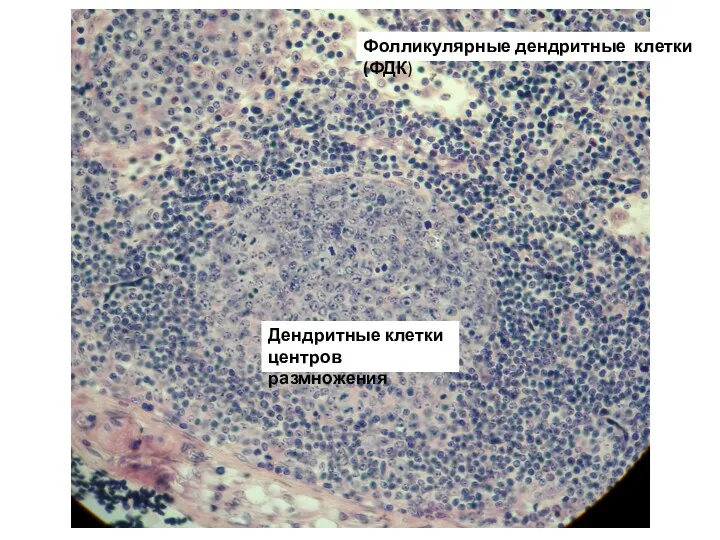
- 21. Фолликулярные дендритные клетки (ФДК) - презентируют антигены B-клеткам. Локализация - содержатся в первичных фолликулах и вторичных
- 22. Фолликулярные дендритные клетки (ФДК) Дендритные клетки центров размножения
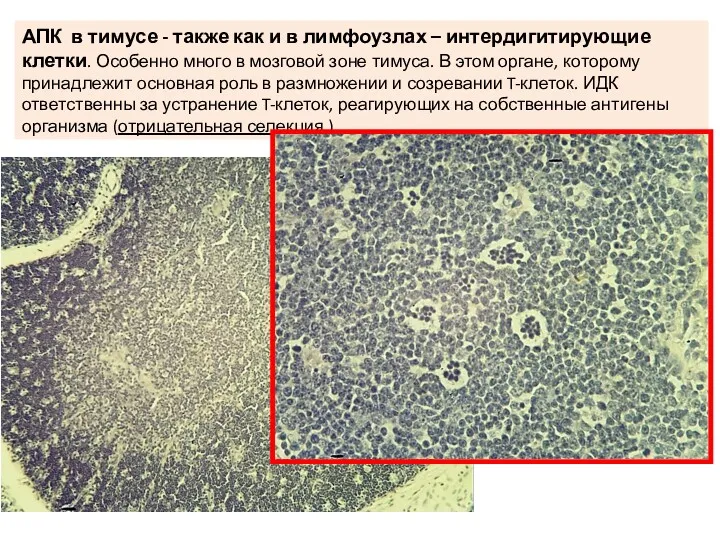
- 23. АПК в тимусе - также как и в лимфоузлах – интердигитирующие клетки. Особенно много в мозговой
- 24. Большая часть АПК образуется в костном мозге !!! (доказательство: спустя 100 суток после трансплантации костного мозга
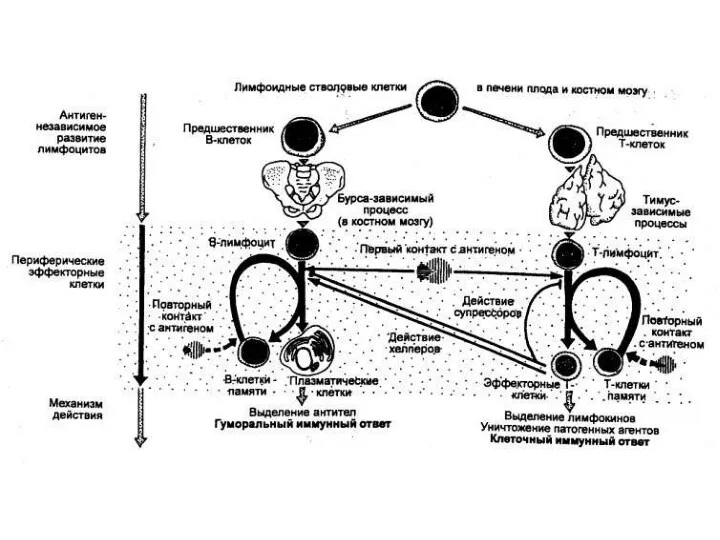
- 25. Иммунокомпетентные клетки - Т– и В-лимфоциты. T-лимфоциты возникают в эмбриональном тимусе. В постэмбриональном периоде после созревания
- 26. Субпопуляции Т-лимфоцитов: 1) Т-хелперы. Запрограммированы индуцировать размножение и дифференцировку клеток других типов. Они индуцируют секрецию антител
- 27. Основная функция В-лимфоцитов заключается в том, что в ответ на антиген они способны размножаться и дифференцироваться
- 28. В2-лимфоциты проходят дифференцировку в костном мозге, затем в красной пульпе селезенки и лимфоузлах. Их превращение в
- 29. Антитела (иммуноглобулины) – это белки, которые синтезируются плазмоцитами вследствие каскада имунологических реакций под влиянием антигена и
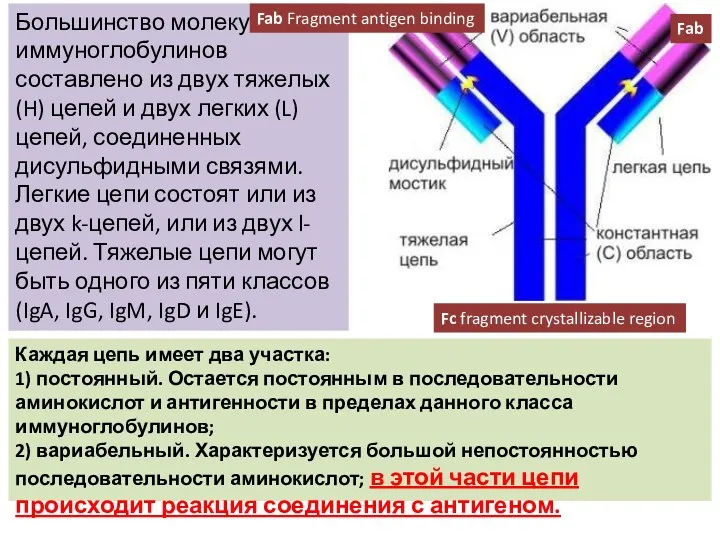
- 30. Большинство молекул иммуноглобулинов составлено из двух тяжелых (H) цепей и двух легких (L) цепей, соединенных дисульфидными
- 33. Таким образом, иммунная система осуществляет защиту организма от проникновения в организм генетически чужеродных тел: микроорганизмов, вирусов,
- 34. В эволюции выделяют три этапа формирования иммунного ответа: I этап - квазииммунное (лат. квази - наподобие,
- 35. В книге "Целостность организма и иммунитет" М.Бернет (1964) впервые определил иммунитет как ту реакцию организма, которая
- 36. Спонтанный мутационный процесс в соматических клетках представляет собой неизбежное следствие многоклеточности. Отсюда следует, что чем больше
- 37. NB! ЛЮБАЯ мутация соматических клеток, произошедшая ПОСЛЕ завершения формирования системы иммунитета и связанная с нарушением экспрессии
- 38. Первичные иммунодефицитные состояния относятся к группе тяжелых генетически детерминированных заболеваний, вызванных нарушением одного или нескольких иммунных
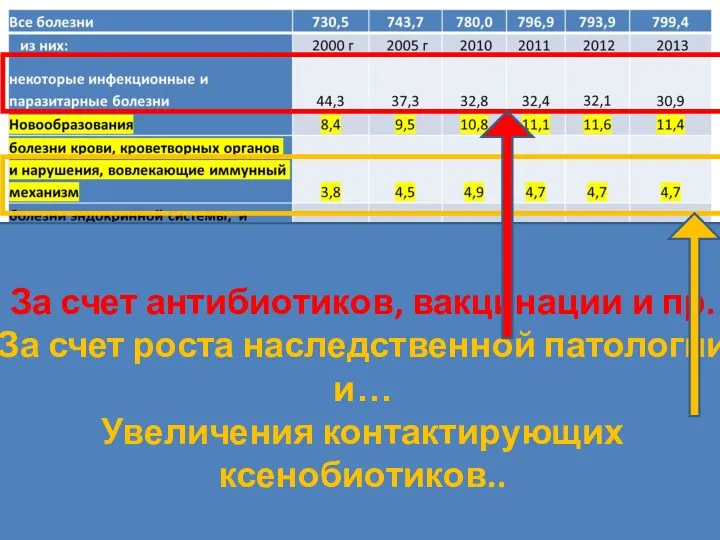
- 39. За счет антибиотиков, вакцинации и пр. За счет роста наследственной патологии и… Увеличения контактирующих ксенобиотиков..
- 40. Благодарю за внимание! И если у нас осталось время, то….
- 41. До середины 60-х годов ХХ-го столетия иммунологи проводили резкую грань между способами иммунной защиты у беспозвоночных
- 42. В середине 60-х годов была показана способность представителей семейства дождевых червей Eisenia foetida и дождевых червей
- 43. Подобная оценка строится на факте одновременного появления в эволюции нового клеточного типа - лимфоцита - у
- 44. Круглоротые способны формировать антитела, но вопрос о наличии у них вилочковой железы, как центрального органа иммуногенеза,
- 45. Центральным органом иммуногенеза у млекопитающих является тимус, где образуются Т-лимфоциты, а также красный костный мозг, где
- 47. Скачать презентацию



























 Желтухи. Новая лекция (2)
Желтухи. Новая лекция (2) Загальна характеристика групи інфекційних хвороб із фекально-оральним механізмом передачі
Загальна характеристика групи інфекційних хвороб із фекально-оральним механізмом передачі Деменция людей пожилого возраста
Деменция людей пожилого возраста Лечебная физкультура при белково-энергетической недостаточности
Лечебная физкультура при белково-энергетической недостаточности Асфиксия, родовые травмы, гемолитическая болезнь новорожденных. Лекция 4
Асфиксия, родовые травмы, гемолитическая болезнь новорожденных. Лекция 4 5 пара ЧМН - Тройничный нерв
5 пара ЧМН - Тройничный нерв Введение. Методы биохимического исследования
Введение. Методы биохимического исследования Теория Кречмера
Теория Кречмера Медицина және денсаулық сақтау теориялары
Медицина және денсаулық сақтау теориялары Рак языка. Эпидемиология
Рак языка. Эпидемиология Психологическая профилактика алкогольной зависимости у медработников в условиях медицинского учреждения
Психологическая профилактика алкогольной зависимости у медработников в условиях медицинского учреждения Методы обследования органов дыхания у детей
Методы обследования органов дыхания у детей Неотложная помощь при тепловом ударе
Неотложная помощь при тепловом ударе Столбняк. Этиология, эпидемиология, патогенез
Столбняк. Этиология, эпидемиология, патогенез Екстракорпоральне запліднення
Екстракорпоральне запліднення Индукция родов
Индукция родов Периоды детского возраста
Периоды детского возраста Алкоголизм и его влияние на развитие личности
Алкоголизм и его влияние на развитие личности Медицинское страхование
Медицинское страхование Дертке көз-қарастың түрлері Науқастың дертке психологиялық серпілісі
Дертке көз-қарастың түрлері Науқастың дертке психологиялық серпілісі Миома матки. Эндометриоз
Миома матки. Эндометриоз Периоперационное ведение пациентов с артериальной гипертензией
Периоперационное ведение пациентов с артериальной гипертензией Эндодонтический инструментарий
Эндодонтический инструментарий Қоғамдық денсаулық ғылым және оқыту пәні ретінде
Қоғамдық денсаулық ғылым және оқыту пәні ретінде Заболевания органов пищеварения
Заболевания органов пищеварения Юношеская дисфункция ВНЧС
Юношеская дисфункция ВНЧС Анемии у детей
Анемии у детей Фармакологические аспекты медикаментозной помощи при острой сосудистой недостаточности
Фармакологические аспекты медикаментозной помощи при острой сосудистой недостаточности