Содержание
- 2. PRION - акроним «Protein only infection agent» PR- protein IN - infection Полиморфное семейство белков (инфекционных
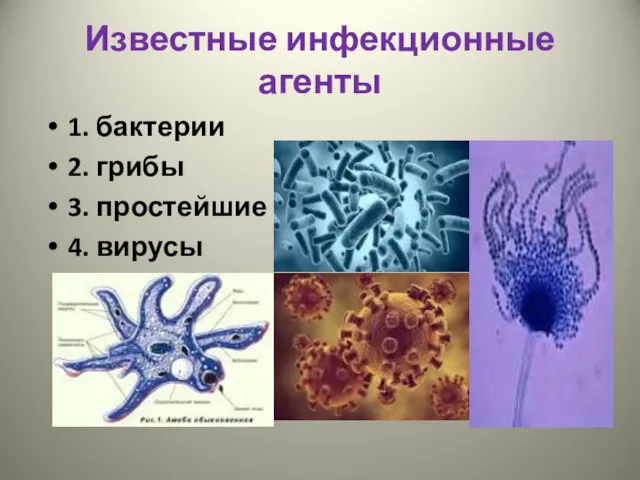
- 3. Известные инфекционные агенты 1. бактерии 2. грибы 3. простейшие 4. вирусы
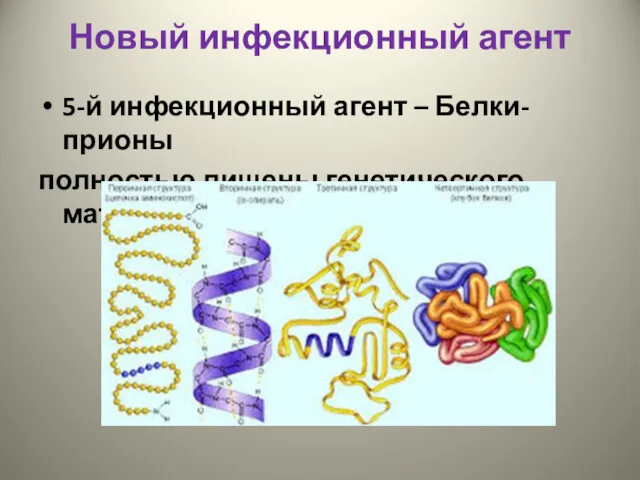
- 4. Новый инфекционный агент 5-й инфекционный агент – Белки-прионы полностью лишены генетического материала
- 5. Прио́ны Вызывают тяжёлые заболевания центральной нервной системы человека и животных, заканчивающиеся смертельным исходом (медленные инфекции)
- 6. Заболевания прионовой природы человека 1. куру - болезнь каннибалов 2. болезнь Крейтцфельдта-Якоба (CDJ – Creutzfeldt-Jakob-Diseas) 3.
- 7. Куру- тяжелое расстройство ЦНС Клинические проявления инк. период от 2-3 мес. до 5-10 лет. Повышенная возбудимость,
- 8. Куру - болезнь каннибалов В 1932 г. в горах Новой Гвинеи обнаружено ранее неизвестное папуасское племя
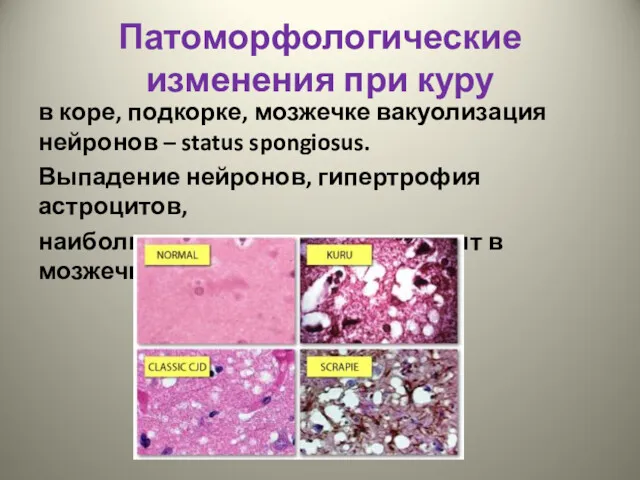
- 9. Патоморфологические изменения при куру в коре, подкорке, мозжечке вакуолизация нейронов – status spongiosus. Выпадение нейронов, гипертрофия
- 10. Болезнь Крейтцфельдта-Якоба (БКЯ -CDJ ) Заболевание прионовой природы с прогрессирующей деменцией и симптомами поражения пирамидальных и
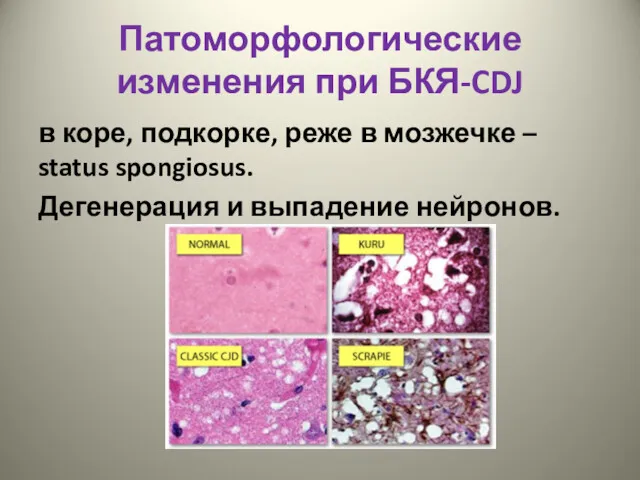
- 11. Патоморфологические изменения при БКЯ-CDJ в коре, подкорке, реже в мозжечке – status spongiosus. Дегенерация и выпадение
- 12. Заболевания прионовой природы животных Первые упоминания: Англия 1732 г., Германия 1750 г.– скрепи (вертячка) -заболевание овец
- 13. Скрепи Поражение ЦНС с развитием губкообразного состояния продолговатого мозга. Клинические проявления: инк. период от 2 мес.
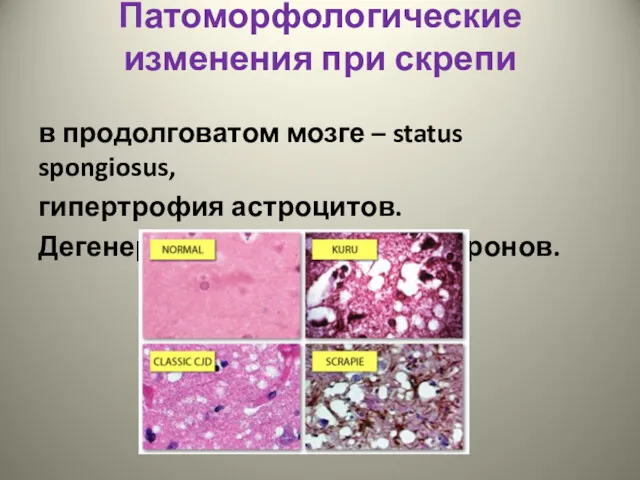
- 14. Патоморфологические изменения при скрепи в продолговатом мозге – status spongiosus, гипертрофия астроцитов. Дегенерация и выпадение нейронов.
- 15. Критерии медленных инфекций Бьерн Сигурдсон – в 1954 г. 1. продолжительный инкубационный период (несколько мес. или
- 16. Нервно-дегенеративные прионовые заболевания Сопровождаются не воспалительными, а нервно-дегенеративными процессами в различных органах. Б. Сигурдсон изучал особенности
- 17. Характеристика агентов, вызывающих скрепи Вначале предполагали что прионы – это очень мелкие вирусы, но оказалось, что:
- 18. Анализ физико-химических свойств неизвестного возбудителя Свидетельствовал о резком их отличии от всех известных типов возбудителей, В
- 19. Характеристика агентов, вызывающих скрепи 1966 г. Tikvah Alper установил отсутствие НК, 1973 г. - D. Asher
- 20. Сравнительный анализ нормальных (N) и инфекционных (In) прионов Общие свойства: N -белок – 33-35 kDa (250
- 21. Проф. Стенли Прусинер Prof. Stanley Prusiner В 1997 г. Нобелевская премия за обобщение материалов по прионам
- 22. Обобщение материалов по прионам (по Стенли Прусинеру) Прионы образуются в нейронах, Через комплекс АГ выходят к
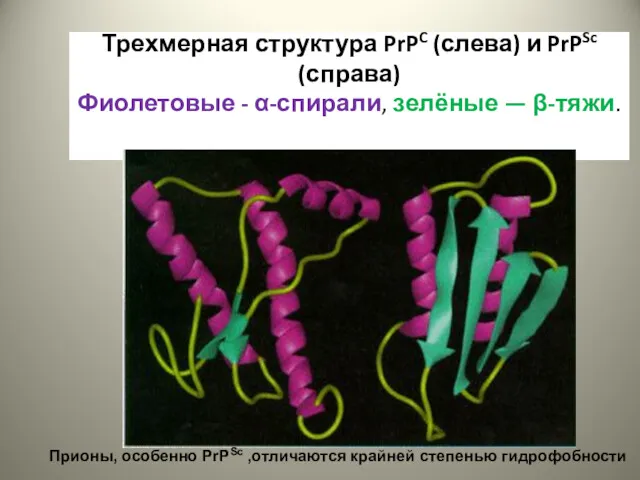
- 23. Трехмерная структура PrPC (слева) и PrPSc (справа) Фиолетовые - α-спирали, зелёные — β-тяжи. Прионы, особенно PrPSc
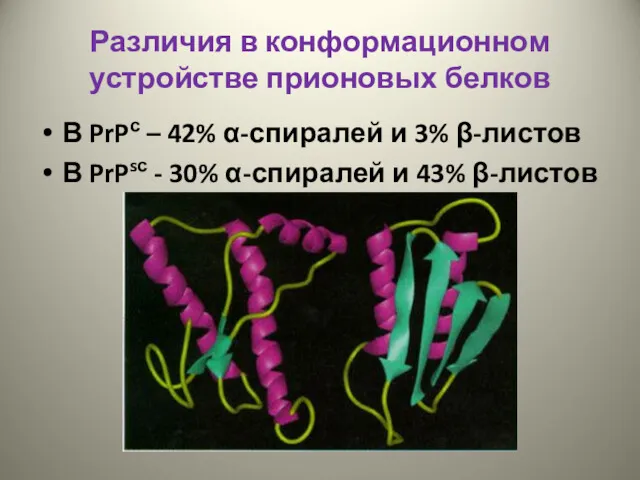
- 24. Различия в конформационном устройстве прионовых белков В PrPс – 42% α-спиралей и 3% β-листов В PrPsс
- 25. Агрегация прионовых белков PrPsс обладают тенденцией к образованию димеров (нерастворимых фибрилл). Агрегаты откладываются в области перикариона,
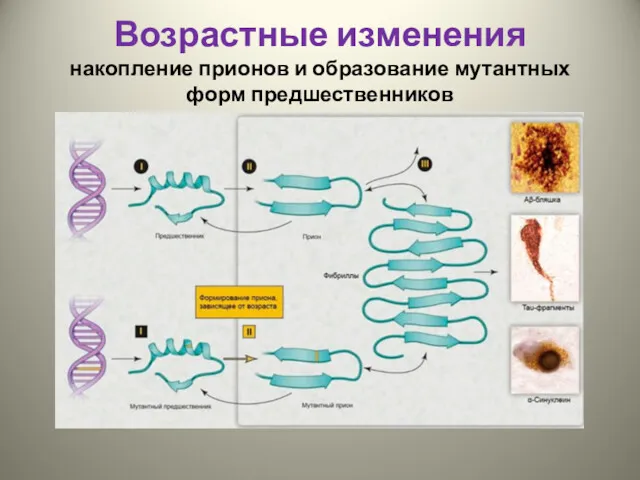
- 26. Возрастные изменения накопление прионов и образование мутантных форм предшественников
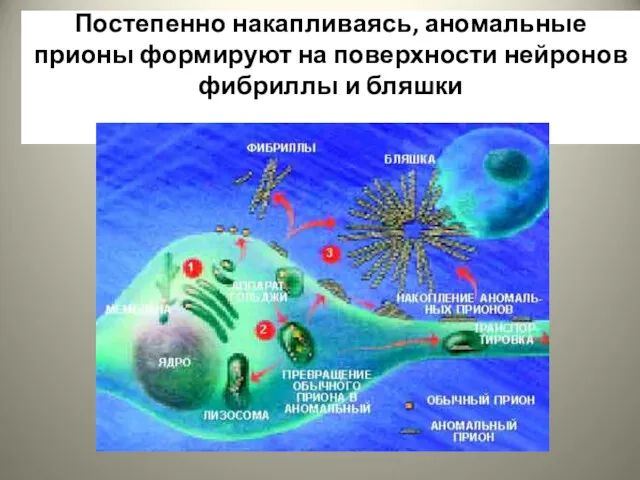
- 27. Постепенно накапливаясь, аномальные прионы формируют на поверхности нейронов фибриллы и бляшки
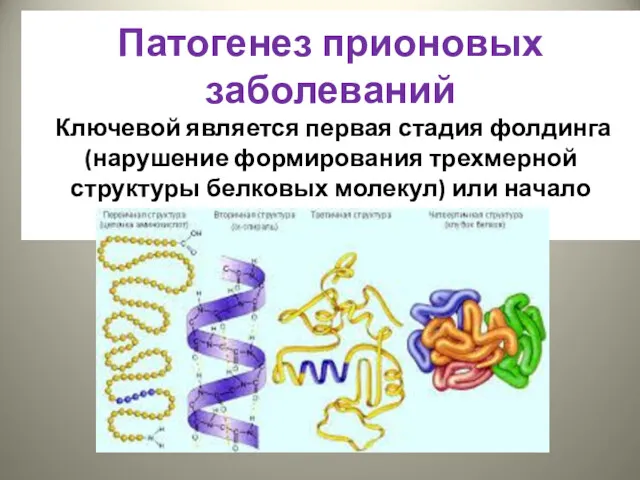
- 28. Патогенез прионовых заболеваний Ключевой является первая стадия фолдинга (нарушение формирования трехмерной структуры белковых молекул) или начало
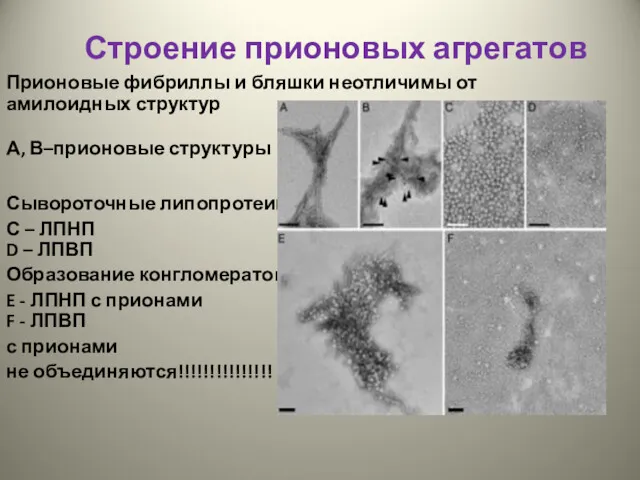
- 29. Строение прионовых агрегатов Прионовые фибриллы и бляшки неотличимы от амилоидных структур А, В–прионовые структуры Сывороточные липопротеины:
- 30. Пути и причины появления Pr в макроорганизме 1. алиментарный путь 2. пересадка мозговых тканей, трупных тканей
- 31. Конформационные (структурные) превращения прионов В процессе посттрансляционного взаимодействия PrPsс с нормальным клеточным белком PrPс , кодирующимся
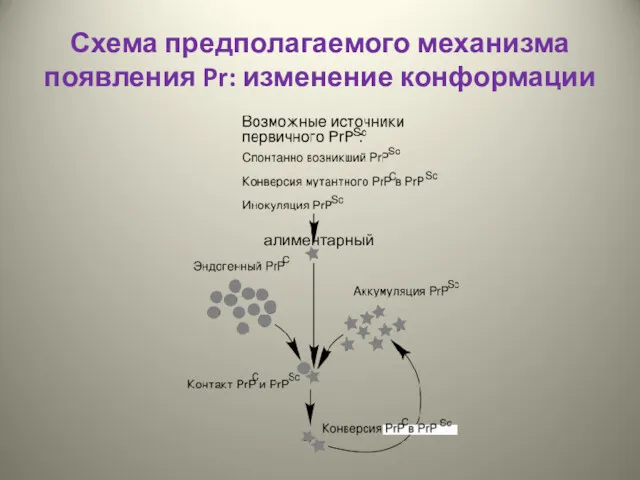
- 32. Схема предполагаемого механизма появления Pr: изменение конформации алиментарный
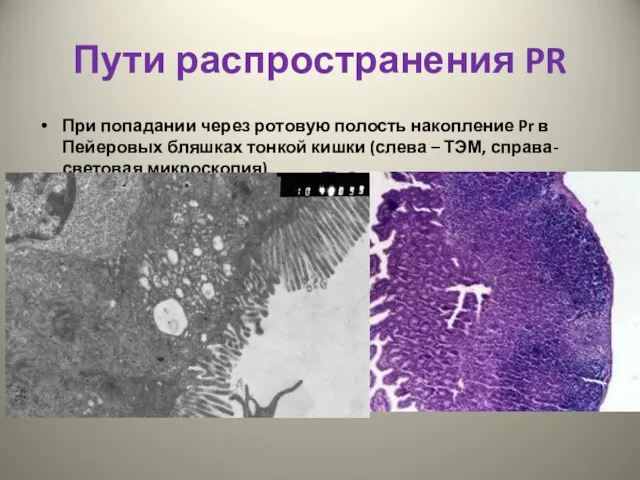
- 33. Пути распространения PR При попадании через ротовую полость накопление Pr в Пейеровых бляшках тонкой кишки (слева
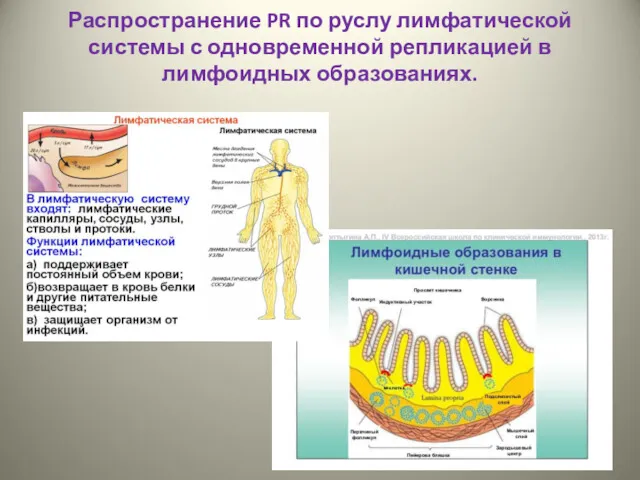
- 34. Распространение PR по руслу лимфатической системы с одновременной репликацией в лимфоидных образованиях.
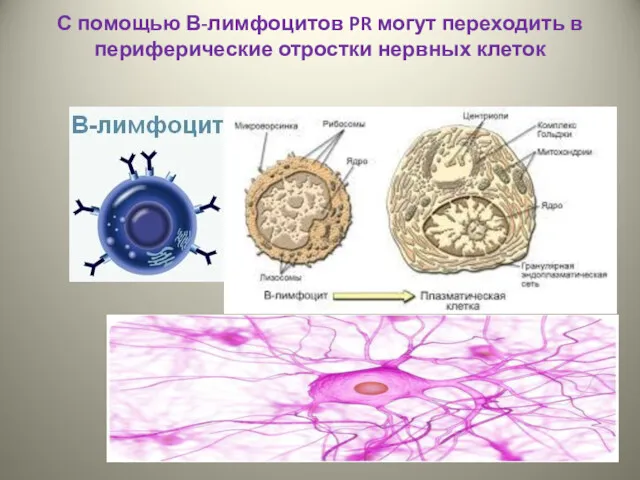
- 35. С помощью В-лимфоцитов PR могут переходить в периферические отростки нервных клеток
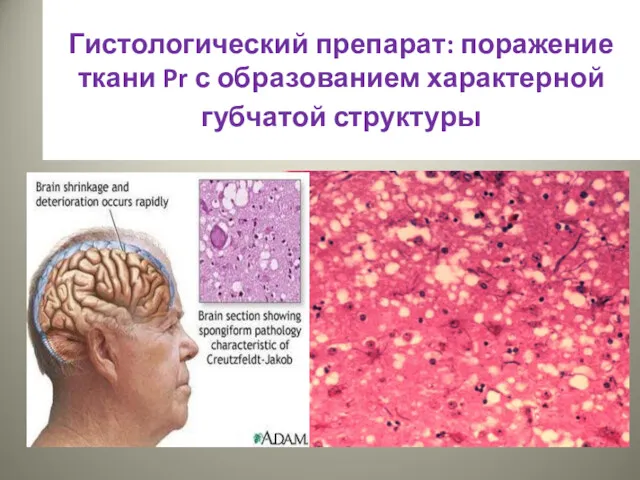
- 36. Гистологический препарат: поражение ткани Pr с образованием характерной губчатой структуры
- 37. Группы риска Лица с наследственными заболеваниями: синдромы Герштманна—Штраусслера—Шейнклера (GSS) и фатальной фамильной инсомнии (FFI), Нейрохирурги, Патологоанатомы,
- 38. Диагностика, перспективы лечения и профилактика Методом Вестерн-Блот: выявление прионовых белков Научные разработки: Доставка рекомбинантных генов Ингибирование
- 39. Спасибо за внимание!!!
- 41. Скачать презентацию






















 Инфильтративный туберкулез легких. Казеозная пневмония. Лекция 8
Инфильтративный туберкулез легких. Казеозная пневмония. Лекция 8 Салқын тізбек
Салқын тізбек Анатомо-физиологические особенности детей различных возрастных периодов
Анатомо-физиологические особенности детей различных возрастных периодов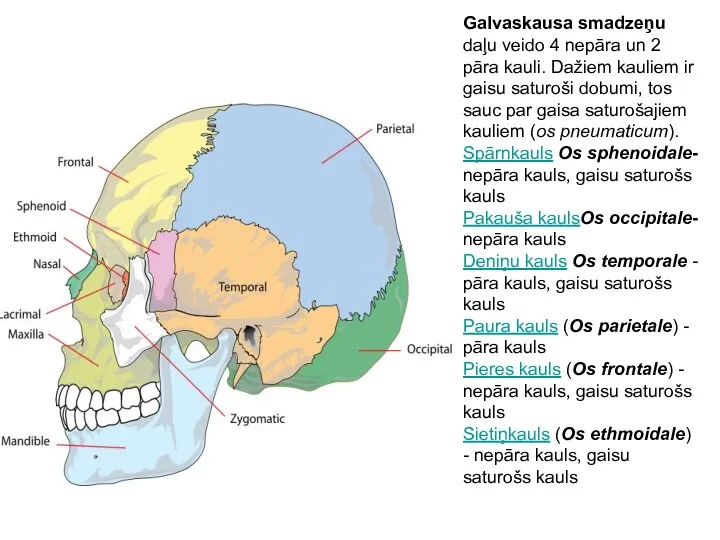 Galvaskausa smadzeņu
Galvaskausa smadzeņu Адаптация диагностических методик для слабовидящих обучающихся
Адаптация диагностических методик для слабовидящих обучающихся Средства, влияющие на обмен в хрящевой ткани. Игра
Средства, влияющие на обмен в хрящевой ткани. Игра Понятия здоровье, образ жизни, качество жизни
Понятия здоровье, образ жизни, качество жизни Анестезия при эндохирургических вмешательствах у детей
Анестезия при эндохирургических вмешательствах у детей Медицина и стоматология. Одонтон и его филогенез
Медицина и стоматология. Одонтон и его филогенез Антиретровирусная терапия ВИЧ-инфекции. Основные принципы комбинирование, показания к назначению
Антиретровирусная терапия ВИЧ-инфекции. Основные принципы комбинирование, показания к назначению Личная гигиена младшего школьника
Личная гигиена младшего школьника Здоровый образ жизни (ЗОЖ)
Здоровый образ жизни (ЗОЖ) Стронгилоидоз при ВИЧ-инфекции
Стронгилоидоз при ВИЧ-инфекции Кардиологиялық аурулардың дәрігерлік- еңбектік сараптамасы (ЖИА)
Кардиологиялық аурулардың дәрігерлік- еңбектік сараптамасы (ЖИА) Пути введения лекарственных средств в организм. Поступление ЛВ в кровь. Транспорт с кровью. Распределение в органах и тканях
Пути введения лекарственных средств в организм. Поступление ЛВ в кровь. Транспорт с кровью. Распределение в органах и тканях Endocrine glands
Endocrine glands Rubella (краснуха)
Rubella (краснуха) Мониторинг, его значение в диагностике тяжести состояния и возможности современного мониторинга
Мониторинг, его значение в диагностике тяжести состояния и возможности современного мониторинга Основы рационального питания
Основы рационального питания Табиғи және техногенді радияциялық фон. Иондық сәулелену көзінің адам ағзасына әсерінің салдары
Табиғи және техногенді радияциялық фон. Иондық сәулелену көзінің адам ағзасына әсерінің салдары Деструктивные пневмониты
Деструктивные пневмониты Медико-соціальні проблеми демографічних процесів. Особливості демографічних показників у різних регіонах світу і в Україні
Медико-соціальні проблеми демографічних процесів. Особливості демографічних показників у різних регіонах світу і в Україні Клінічна фармакологія лікарських засобів, які впливають на секреторну функцію травного тракту
Клінічна фармакологія лікарських засобів, які впливають на секреторну функцію травного тракту Острые лейкозы
Острые лейкозы Методы полногеномного анализа в медицине. Курс 3 ЦИОП Медицина будущего
Методы полногеномного анализа в медицине. Курс 3 ЦИОП Медицина будущего Политравма. Определение
Политравма. Определение Рациональное питание здоровых детей первого года жизни. (Лекция 8)
Рациональное питание здоровых детей первого года жизни. (Лекция 8) Профилактика инфекций
Профилактика инфекций