Содержание
- 2. 5.1. Онковирусы и онкогены
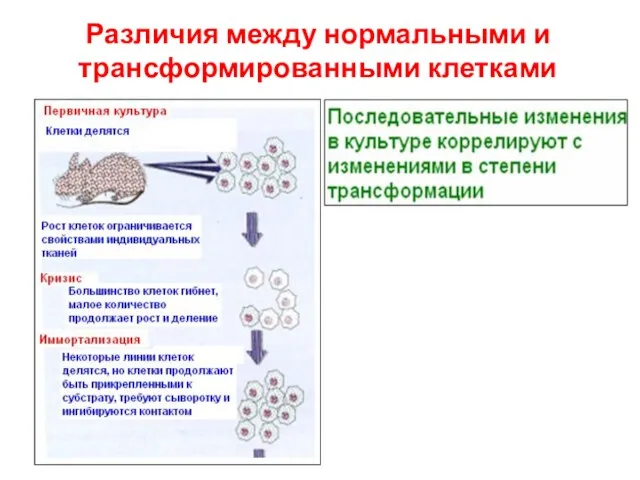
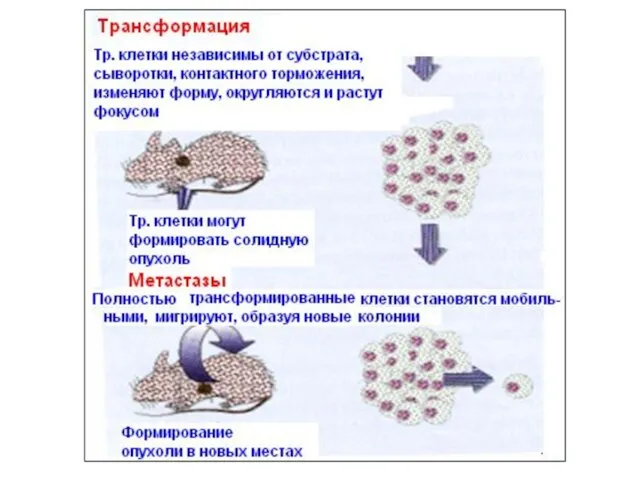
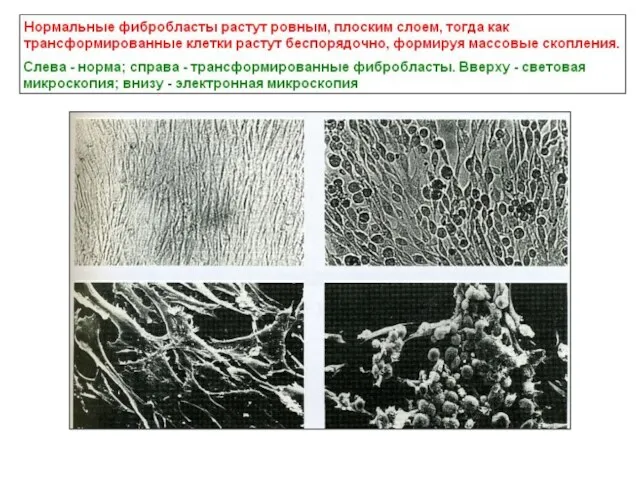
- 3. Различия между нормальными и трансформированными клетками
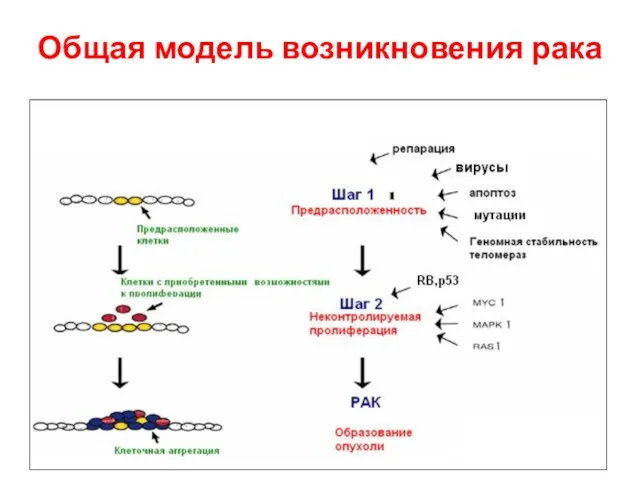
- 6. Общая модель возникновения рака
- 7. Гипотеза раковых стволовых клеток (РСК)
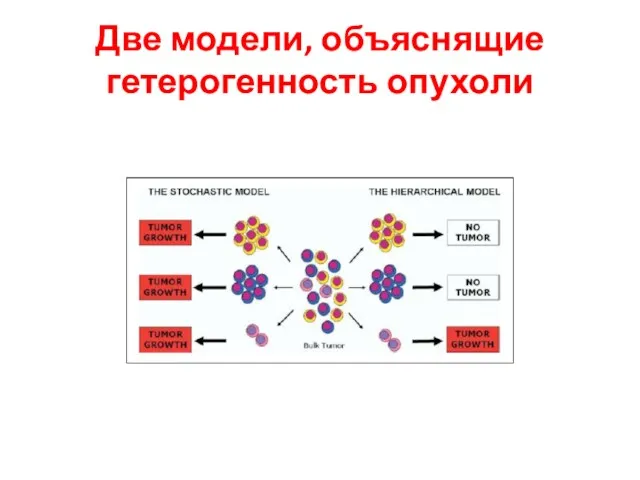
- 8. Две модели, объяснящие гетерогенность опухоли
- 9. Маркеры для обогащения РСК
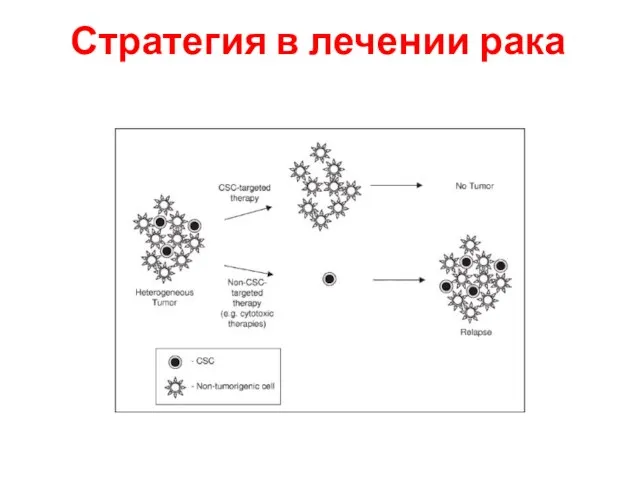
- 10. Стратегия в лечении рака
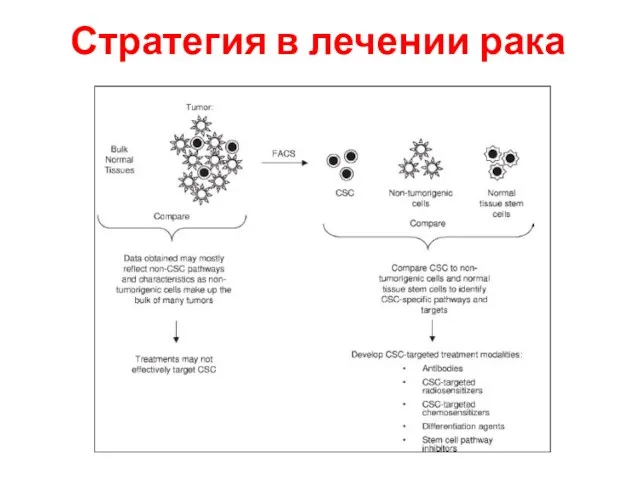
- 11. Стратегия в лечении рака
- 12. Онковирусы
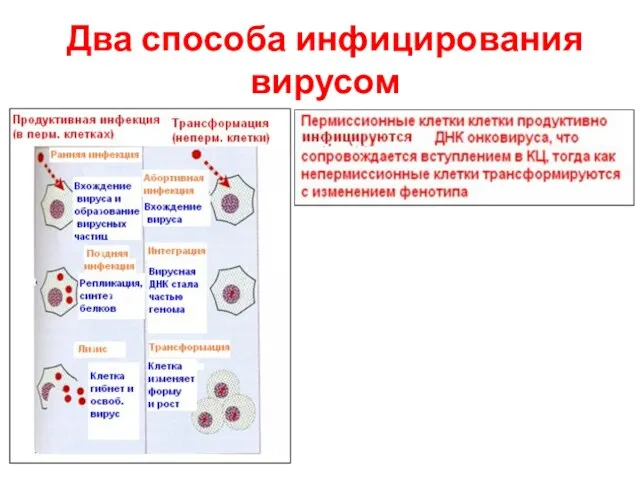
- 13. Два способа инфицирования вирусом
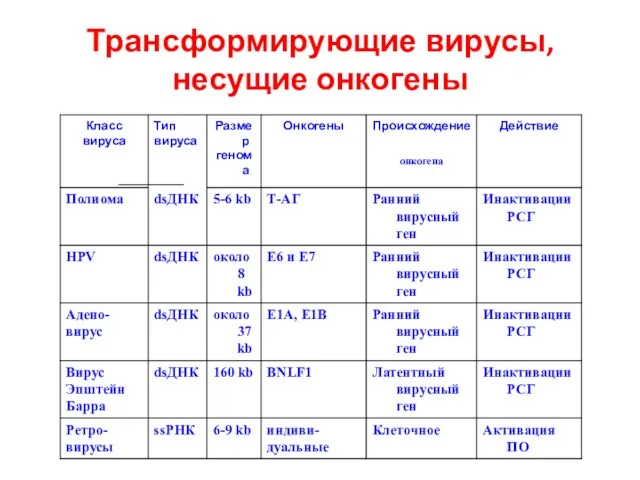
- 14. Трансформирующие вирусы, несущие онкогены
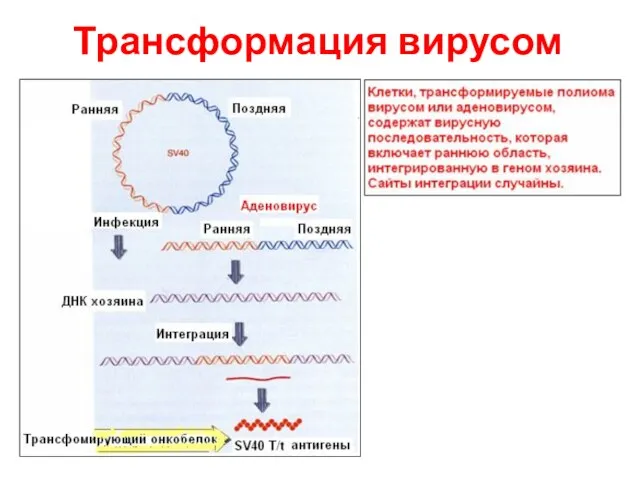
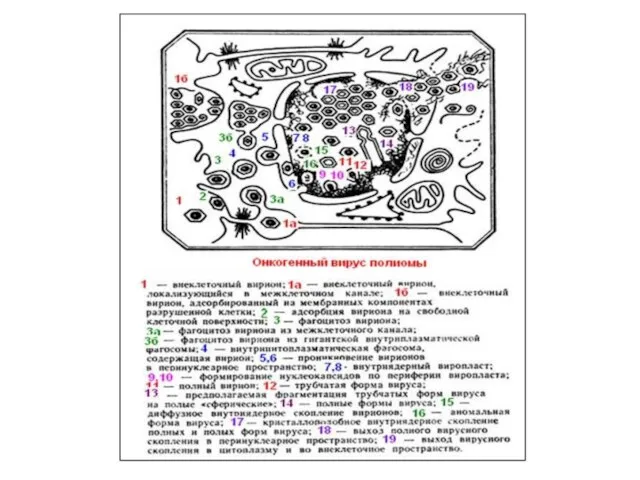
- 15. Трансформация вирусом
- 16. История вирусного канцерогенеза (1)
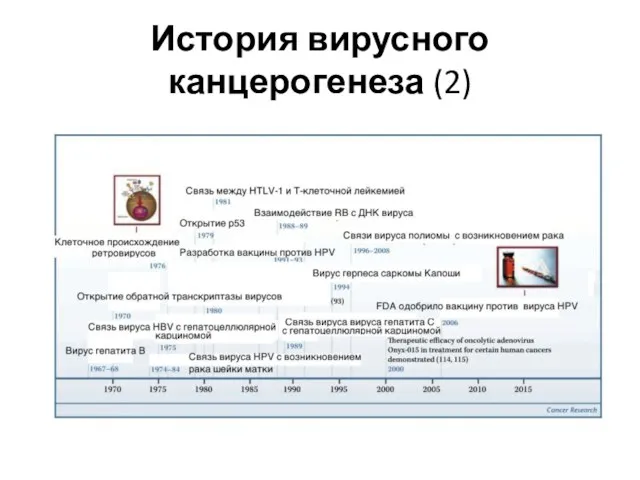
- 17. История вирусного канцерогенеза (2)
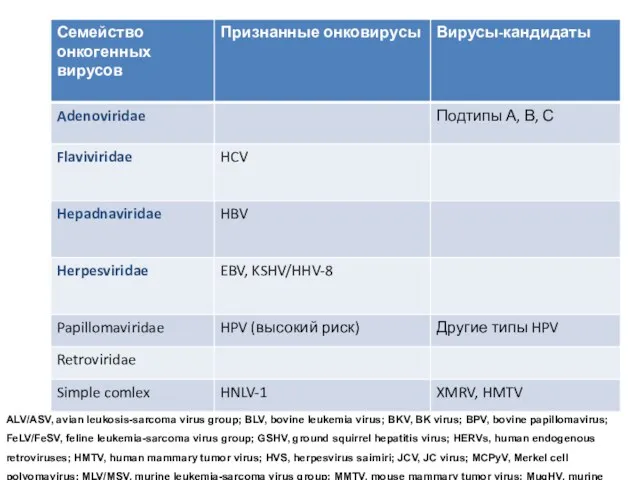
- 18. ALV/ASV, avian leukosis-sarcoma virus group; BLV, bovine leukemia virus; BKV, BK virus; BPV, bovine papillomavirus; FeLV/FeSV,
- 21. Вирус папилломы человека (HPVs) Причина рака шейки матки (90 % случаев)
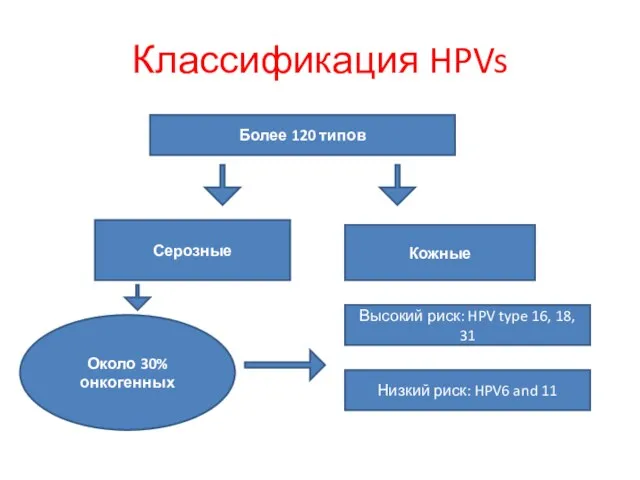
- 22. Классификация HPVs Более 120 типов Серозные Кожные Около 30% онкогенных Высокий риск: HPV type 16, 18,
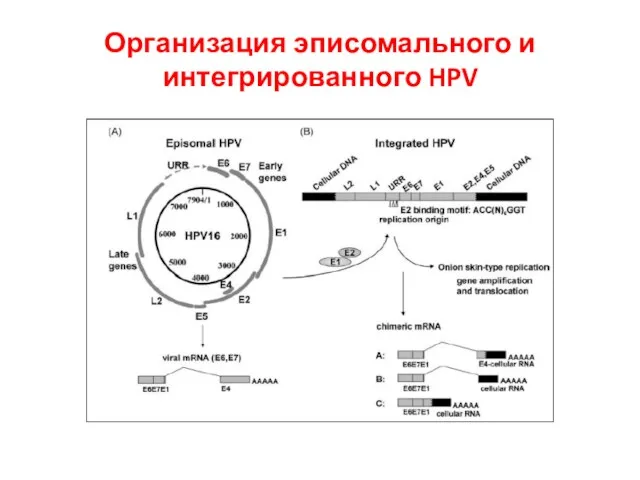
- 23. Организация эписомального и интегрированного HPV
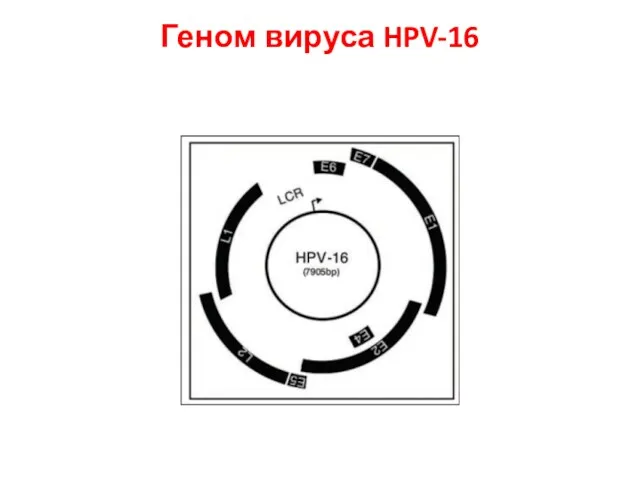
- 24. Геном вируса HPV-16
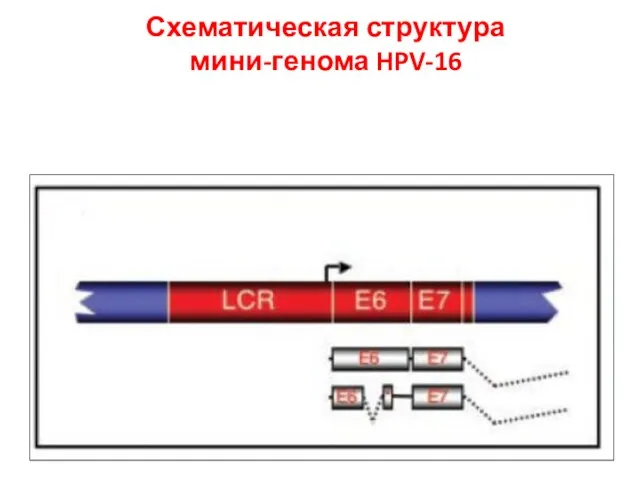
- 25. Схематическая структура мини-генома HPV-16
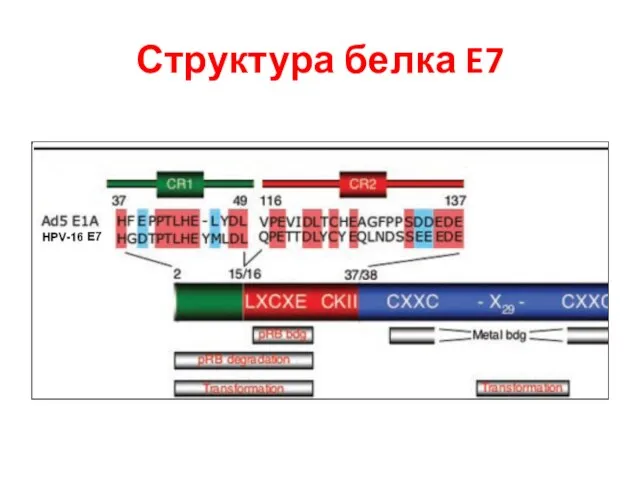
- 26. Структура белка E7
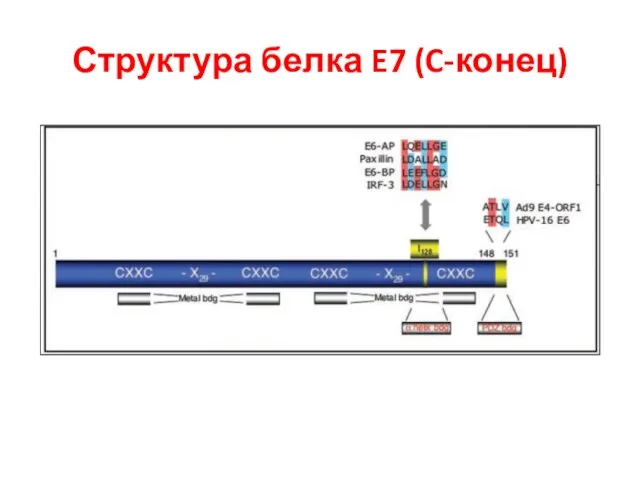
- 27. Структура белка E7 (C-конец)
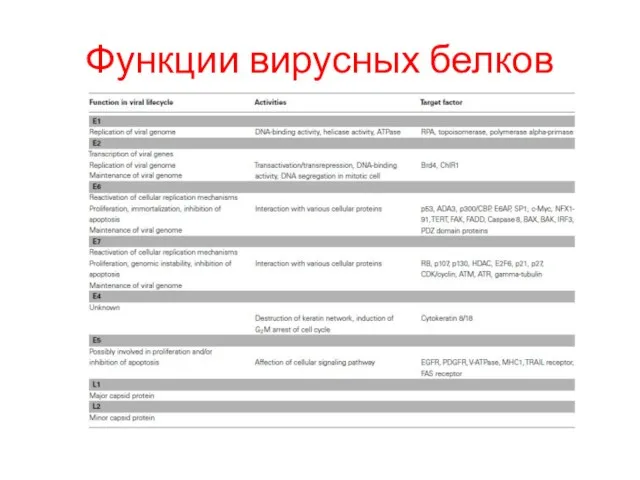
- 28. Функции вирусных белков
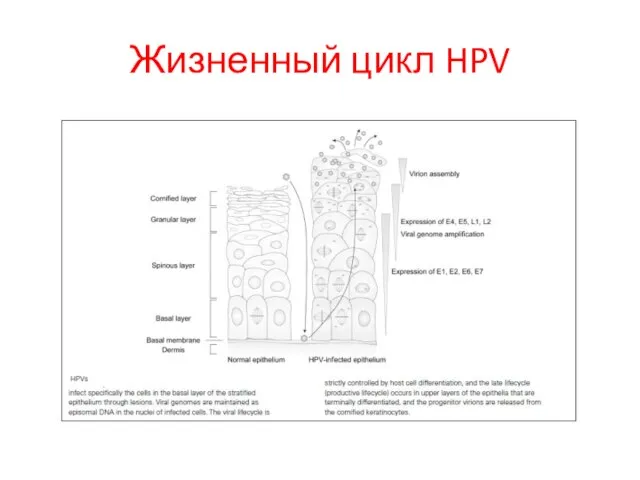
- 29. Жизненный цикл HPV
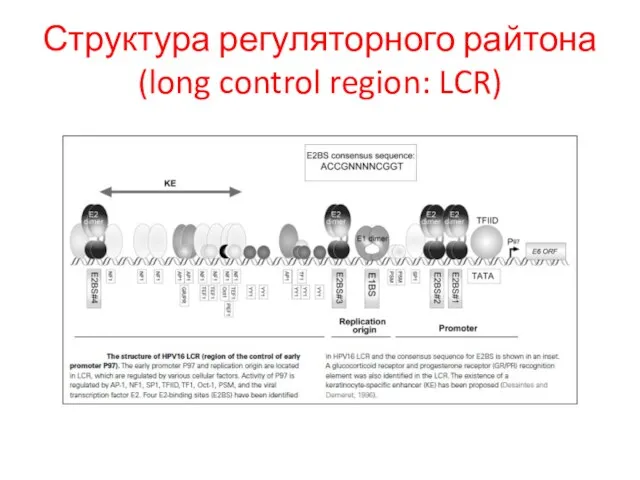
- 30. Структура регуляторного райтона (long control region: LCR)
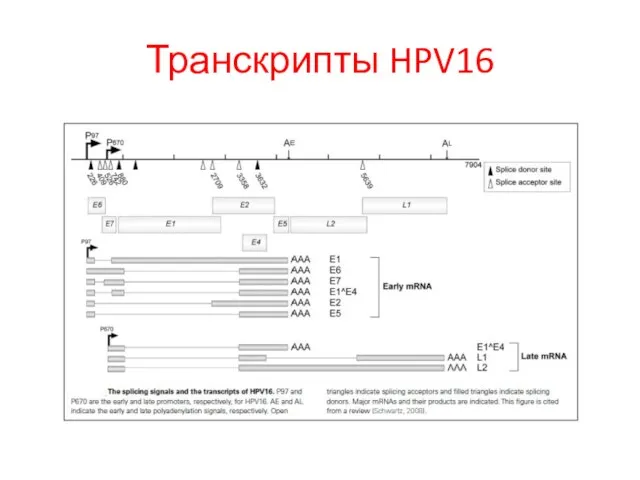
- 31. Транскрипты HPV16
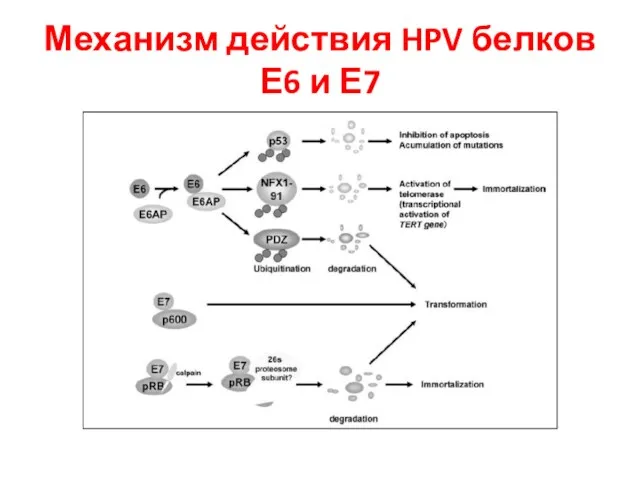
- 32. Механизм действия HPV белков Е6 и Е7
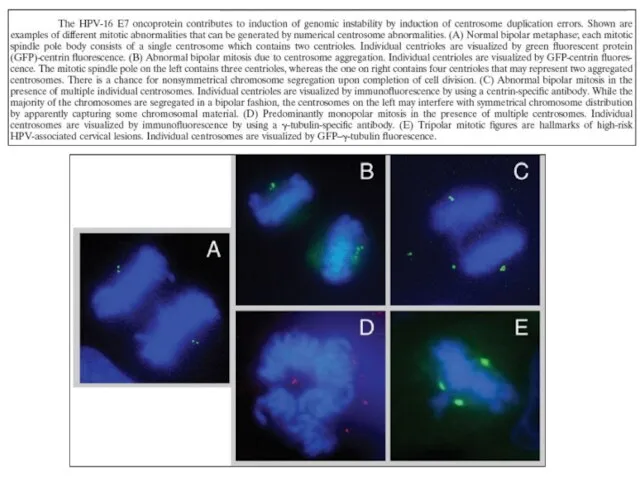
- 33. Роль NOTCH1 белка в канцерогенезе
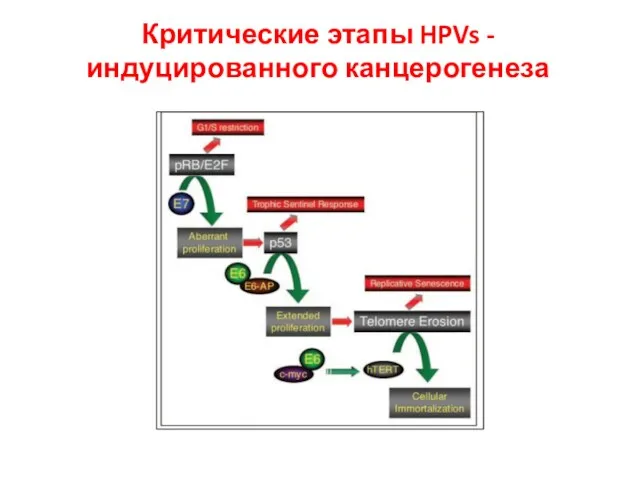
- 34. Критические этапы HPVs -индуцированного канцерогенеза
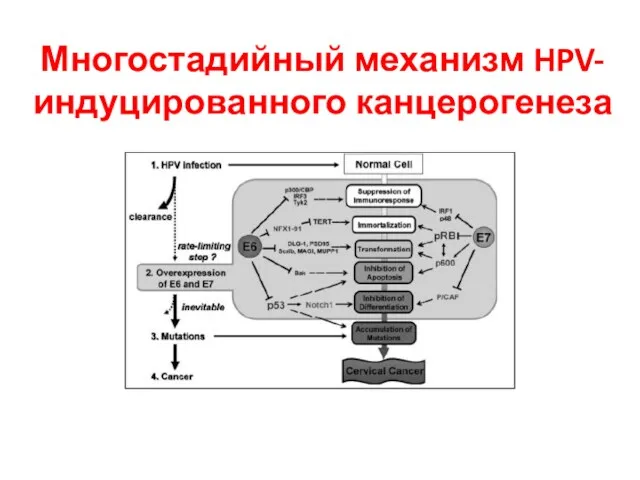
- 36. Многостадийный механизм HPV-индуцированного канцерогенеза
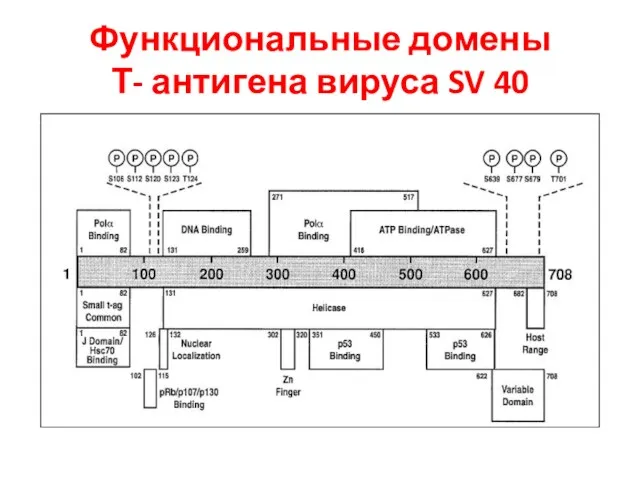
- 37. Функциональные домены Т- антигена вируса SV 40
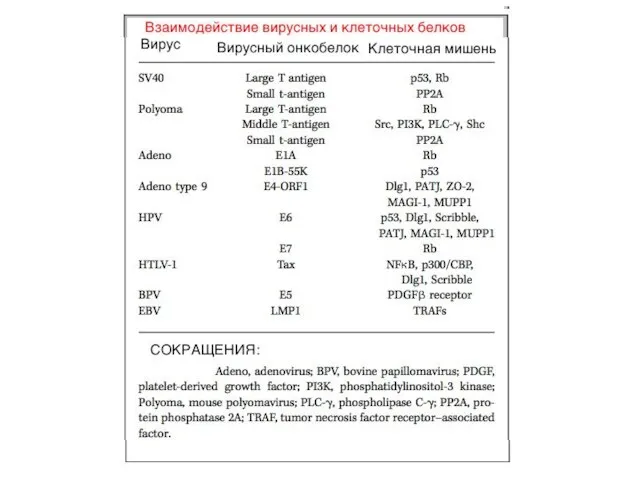
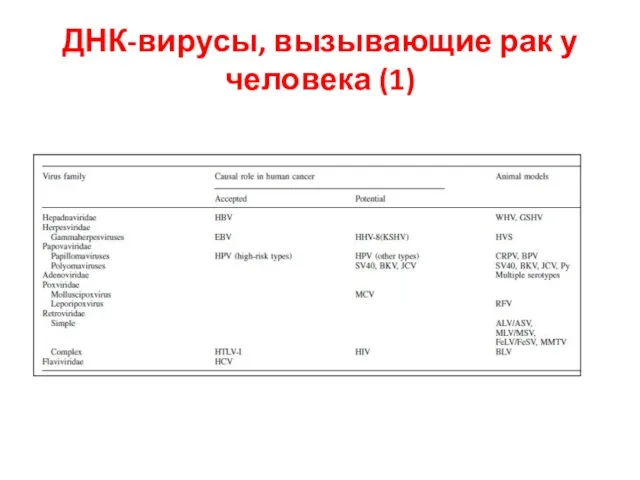
- 38. ДНК-вирусы, вызывающие рак у человека (1)
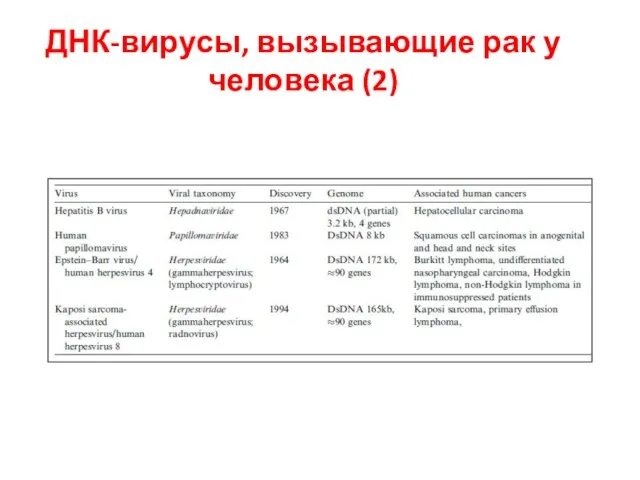
- 39. ДНК-вирусы, вызывающие рак у человека (2)
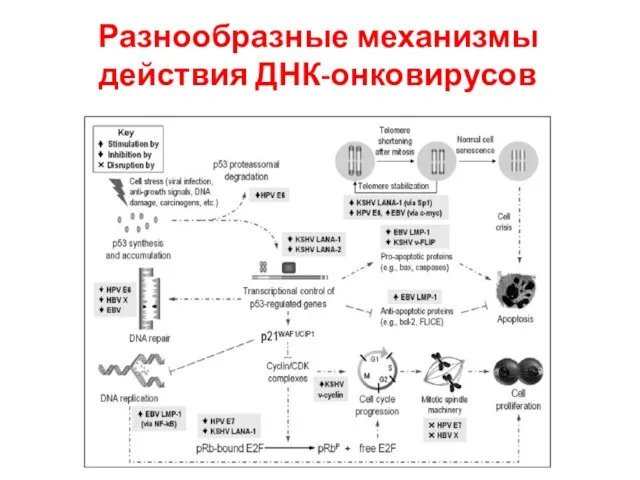
- 40. Разнообразные механизмы действия ДНК-онковирусов
- 41. Мишени для ДНК-онковирусов
- 42. Свойства вирусов человека
- 43. Новые онковирусы Новое исследование указывает на то, что белок синтезируемый вирусом, вызывающим рак, играет важнейшую роль
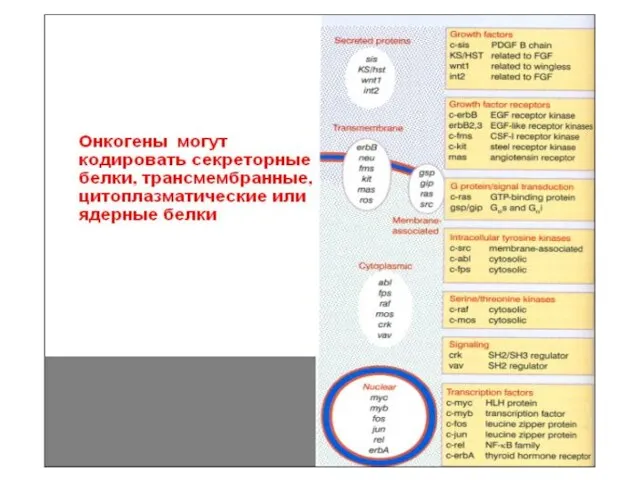
- 44. Основные принципы вирусного онкогенеза Вирусы могут вызывать рак у животных и человека Онковирусы часто вызывают продолжительную
- 45. Ретровирусы
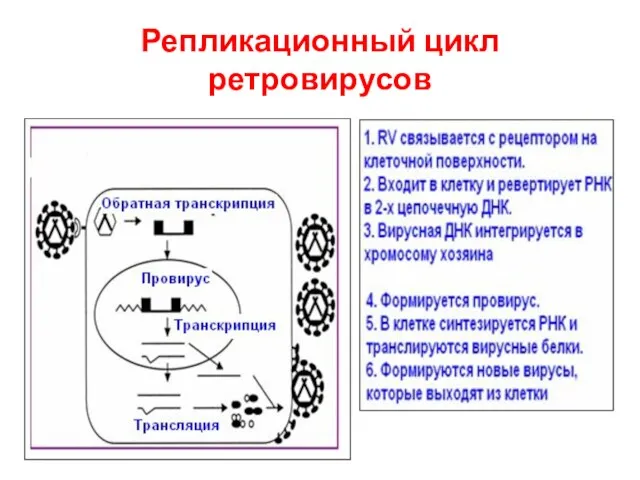
- 46. Репликационный цикл ретровирусов
- 47. Генетическая организация некоторых ретровирусов А. «Недефективные» репликационно-компетентные вирусы . Показаны вирусы с простым или сложным геномом.
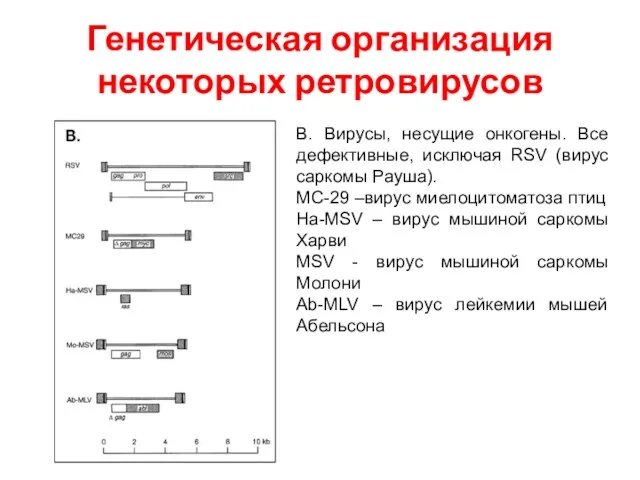
- 48. Генетическая организация некоторых ретровирусов В. Вирусы, несущие онкогены. Все дефективные, исключая RSV (вирус саркомы Рауша). MC-29
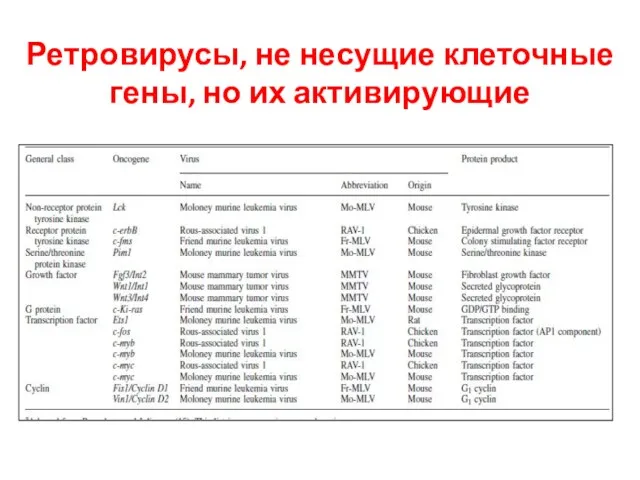
- 49. Ретровирусы, не несущие клеточные гены, но их активирующие
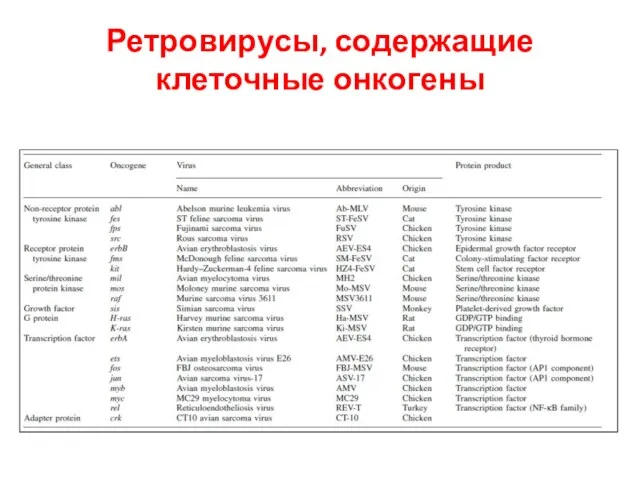
- 50. Ретровирусы, содержащие клеточные онкогены
- 51. Трансформирующий вирус несет копию гена хозяина
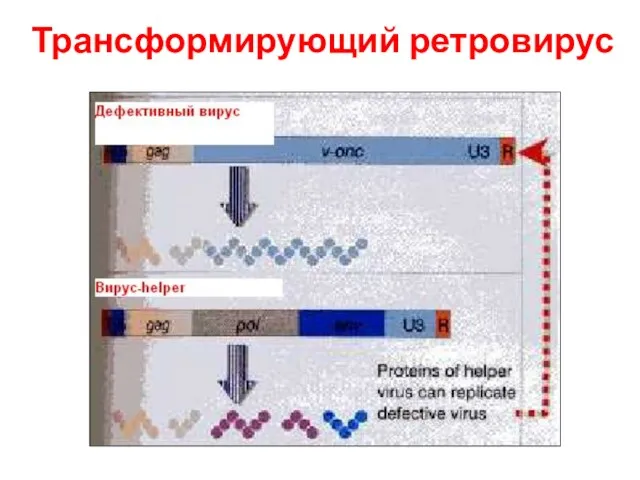
- 52. Трансформирующий ретровирус
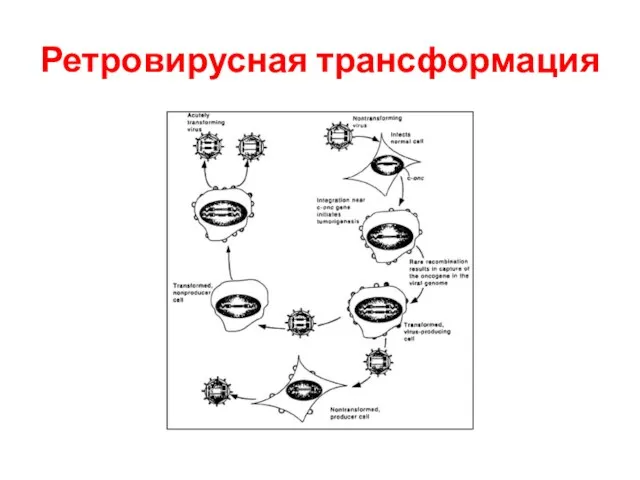
- 53. Ретровирусная трансформация
- 54. Механизмы активации прото-онкогенов (ПО) Траснформирующая «сила» ПО может характеризоваться появлением фокусов. Тестируемая культура – 3Т3- мышиные
- 55. Вставки, транслокация или амплификация могут активировать ПО В случае вставки или транслокации существуют доказательства, что эти
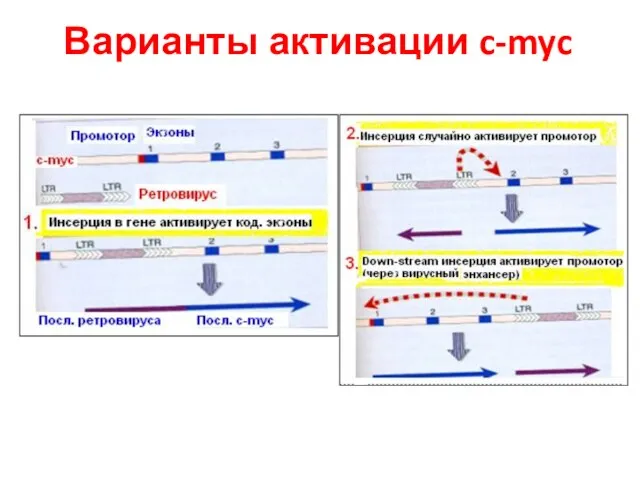
- 56. Варианты активации c-myc
- 57. Другие ПО, активируемые вставкой ретровируса c-erbB, c-myb, c-mos, c-H-ras, c-raf
- 58. Результаты транслокации Часть белка ПО может быть активирована независимо от другой части (c-myc). Другой партнер в
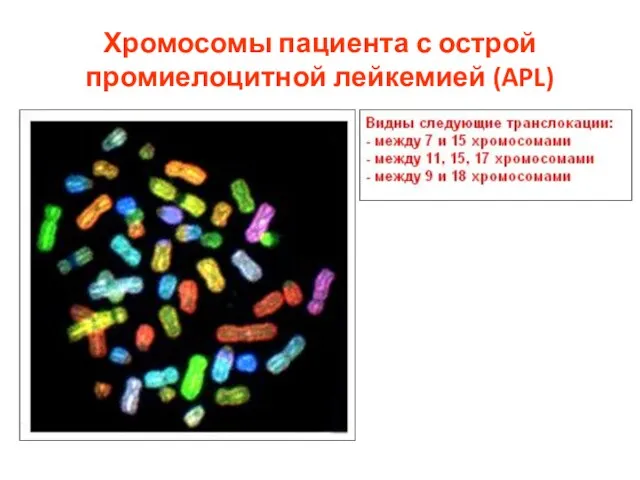
- 59. Хромосомы пациента с острой промиелоцитной лейкемией (APL)
- 60. Филадельфийская хромосома (PH) Хроническая миелогенная лейкемия (CML) – 5000kb конца 9-й хр. (c-abl) b 5,8kb 22-й
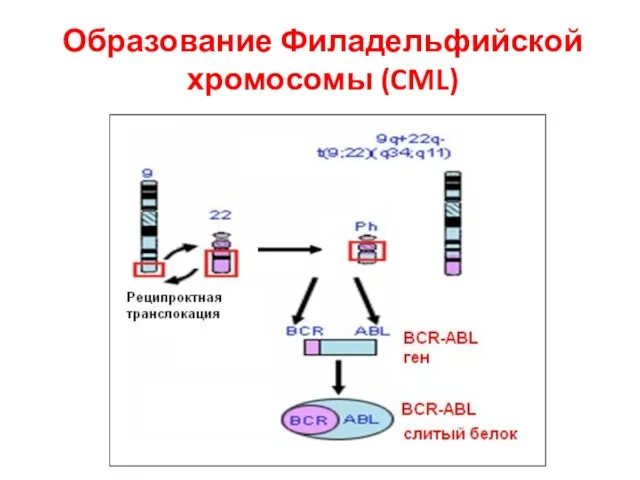
- 61. Образование Филадельфийской хромосомы (CML)
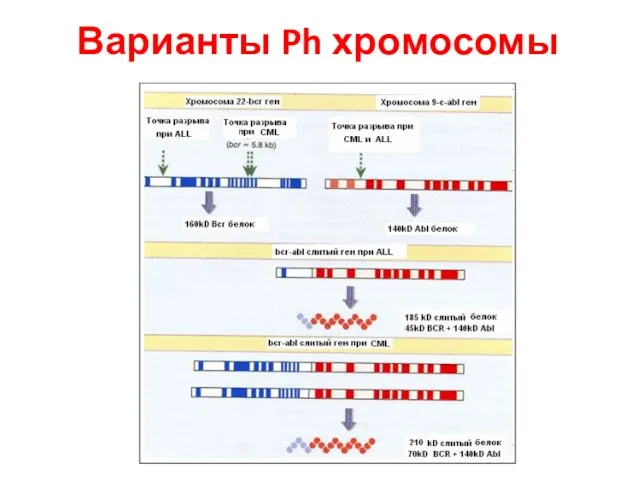
- 62. Варианты Ph хромосомы
- 63. Лечение CML Стандартная терапия хронической миелоидной лейкемии – тирозин киназный ингибитор иматиниб (imatinib). Результат лечения -
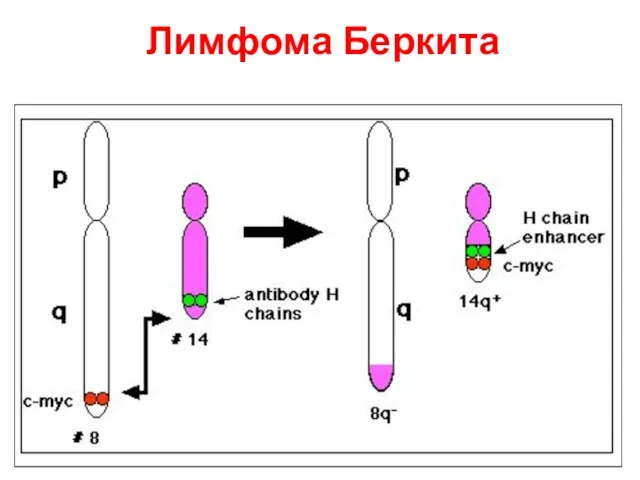
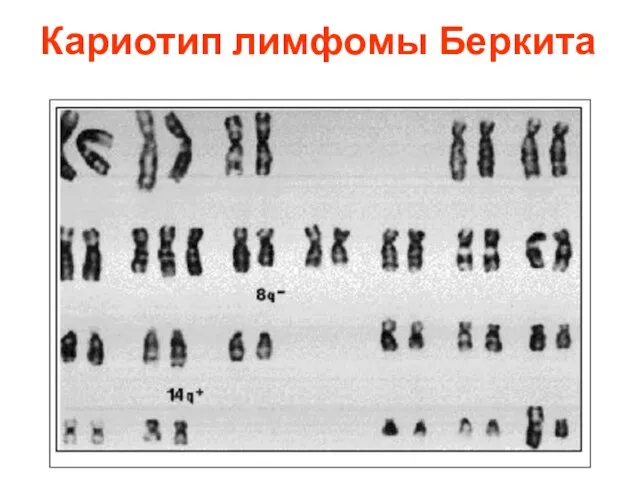
- 64. Лимфома Беркита
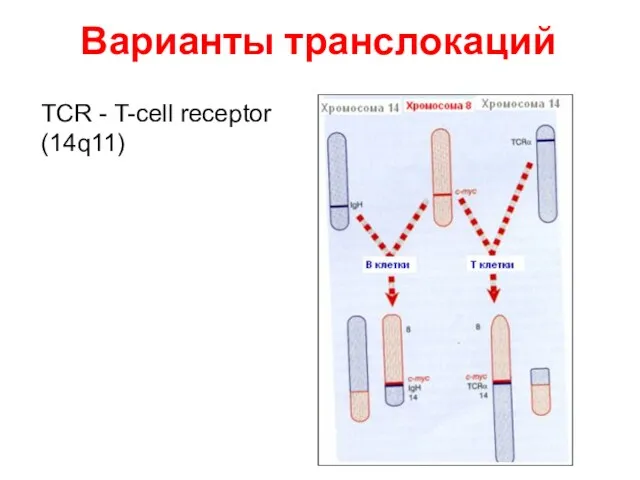
- 65. Варианты транслокаций TCR - T-cell receptor (14q11)
- 66. Кариотип лимфомы Беркита
- 67. Лимфома Беркита
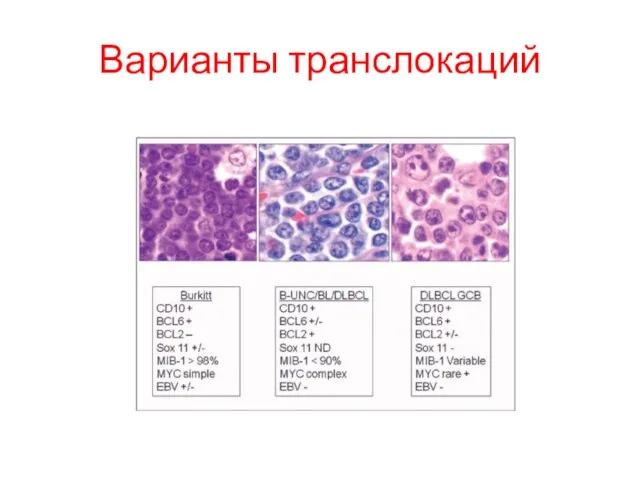
- 68. Классификация лимфом
- 69. Варианты транслокаций
- 70. 5.2. Передача клеточного сигнала (Сигнальная трансдукция)
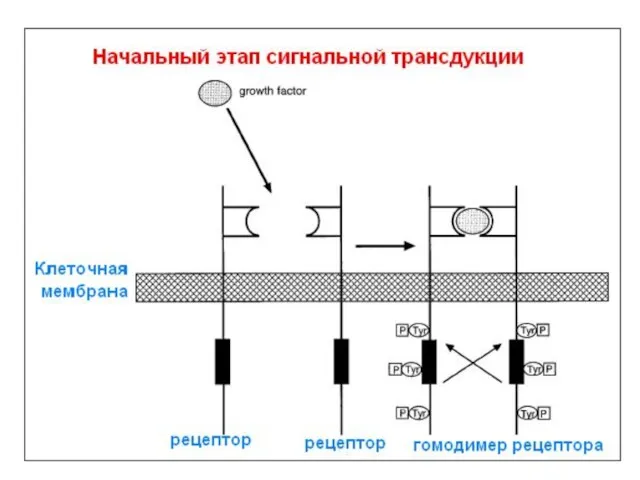
- 71. 5.2.1. Факторы роста и их рецепторы
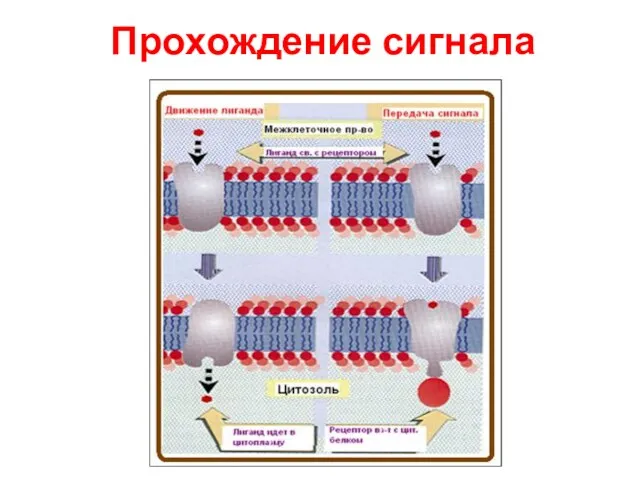
- 72. Прохождение сигнала
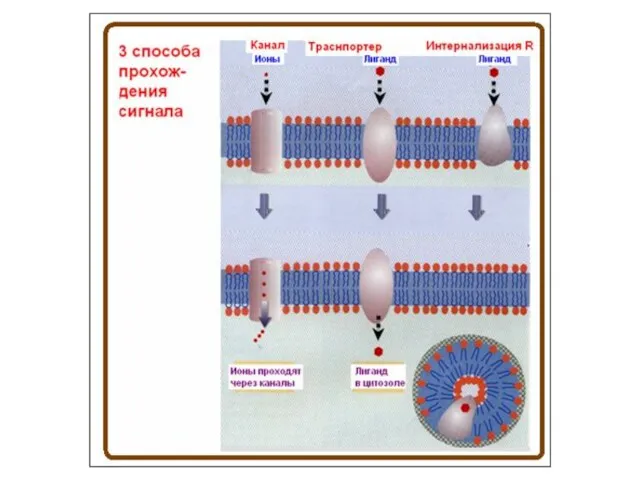
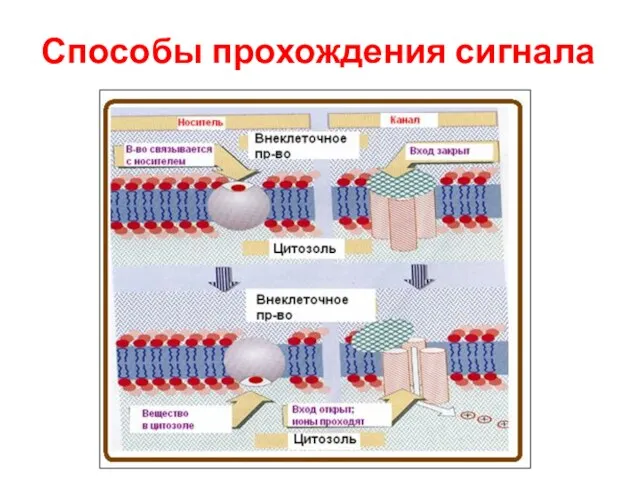
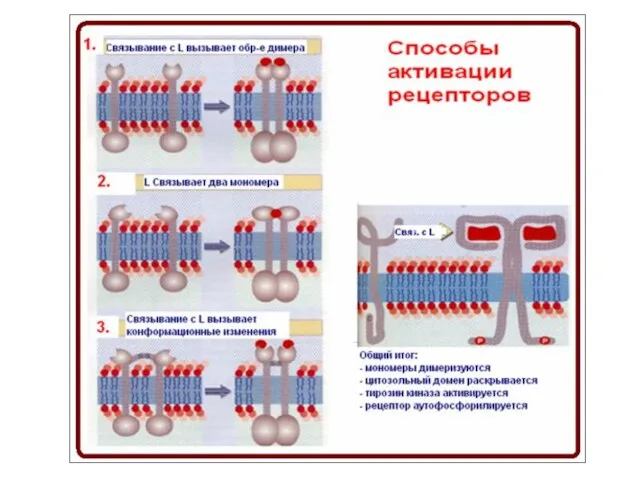
- 74. Способы прохождения сигнала
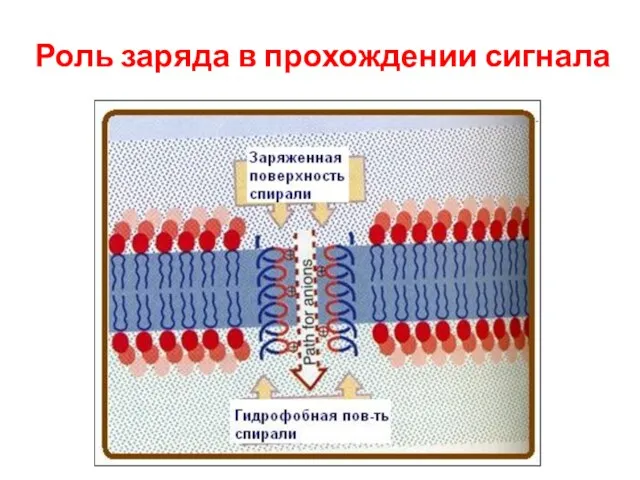
- 75. Роль заряда в прохождении сигнала
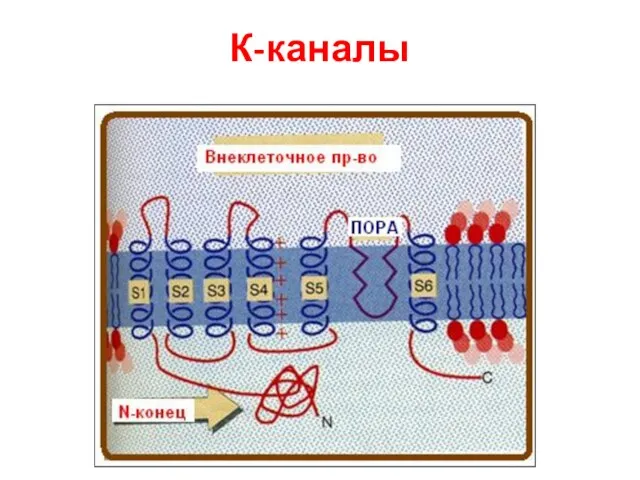
- 76. К-каналы
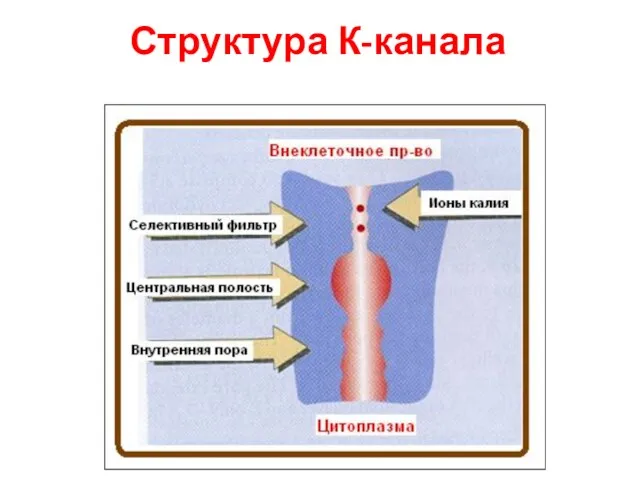
- 77. Структура К-канала
- 80. Факторы роста (GF) К настоящему времени установлено, что семейство факторов роста представлено 13 белками: EGF, transforming
- 81. Процессинг GF В некоторых случаях, как это показано для фактора NRG-1beta1, его расщепление происходит в аппарате
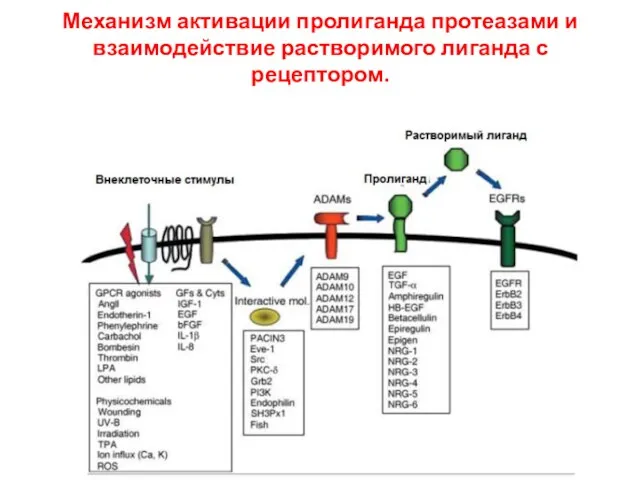
- 82. Механизм активации пролиганда протеазами и взаимодействие растворимого лиганда с рецептором.
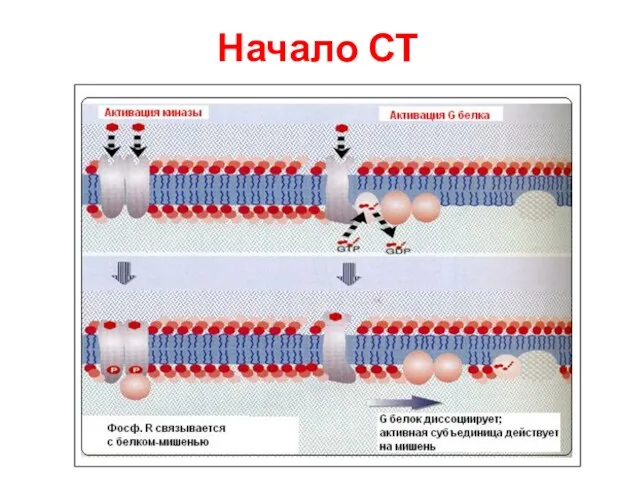
- 83. Начало СТ
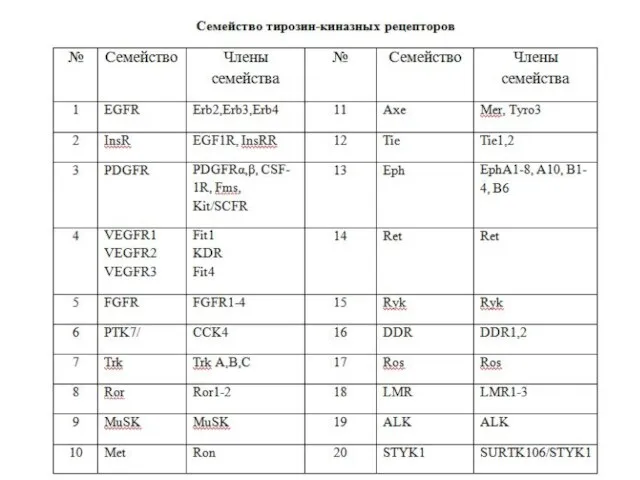
- 85. Характеристика RTKs У человека идентифицировано 58 RTKs, которые подразделяются на 20 подсемейств Все рецепторы имеют сходную
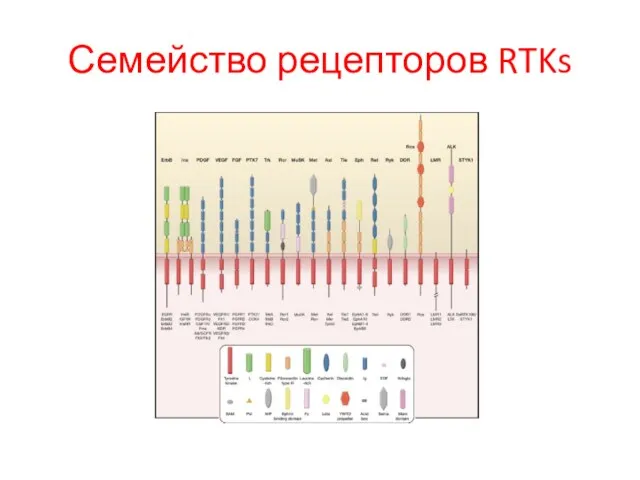
- 87. Семейство рецепторов RTKs
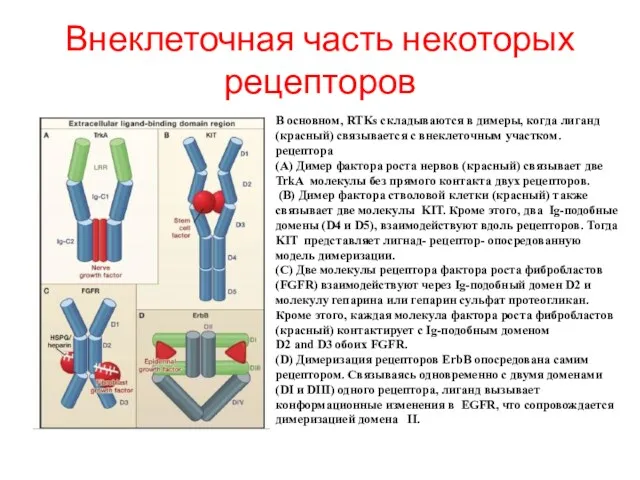
- 88. Внеклеточная часть некоторых рецепторов В основном, RTKs складываются в димеры, когда лиганд (красный) связывается с внеклеточным
- 89. Внутриклеточный домен RTKs E) Инсулин рецептор-подобные Insulin receptor-like (активация-петля-ингибирование, activation loop inhibition). В FGFR, инсулиновом рецепторе
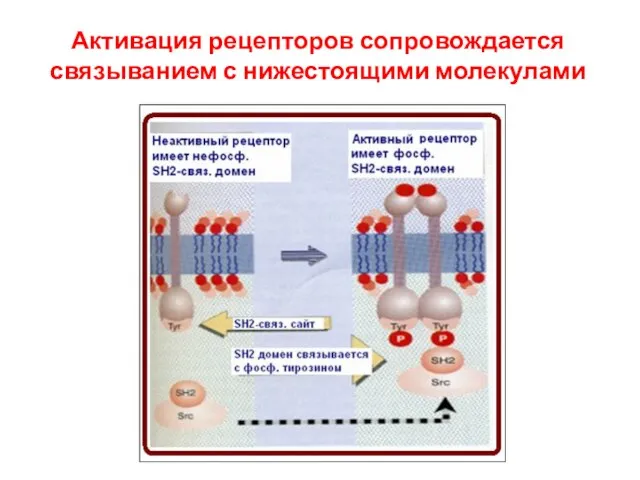
- 91. Активация рецепторов сопровождается связыванием с нижестоящими молекулами
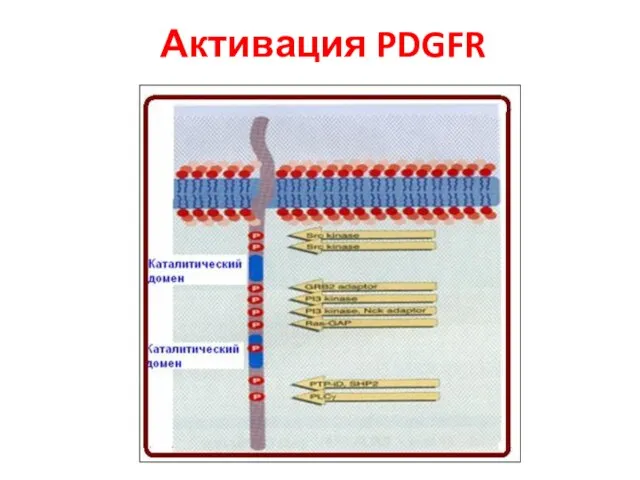
- 92. Активация PDGFR
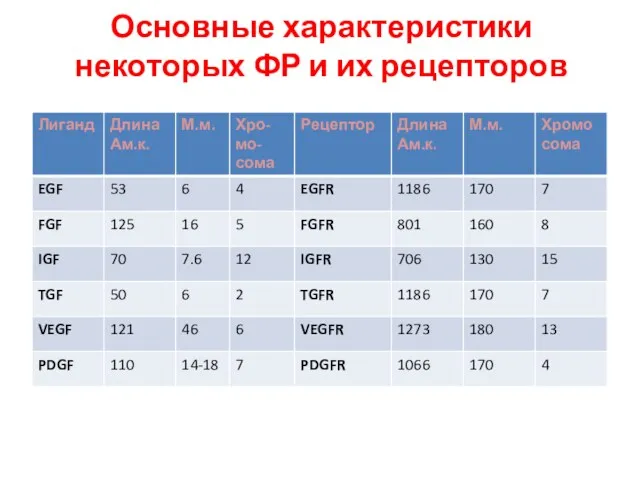
- 93. Основные характеристики некоторых ФР и их рецепторов
- 94. Семейство Epidermal growth factor receptor (EGFR) EGF был изолирован в1962 Stanley Cohen. Его взаимодействие с EGFR
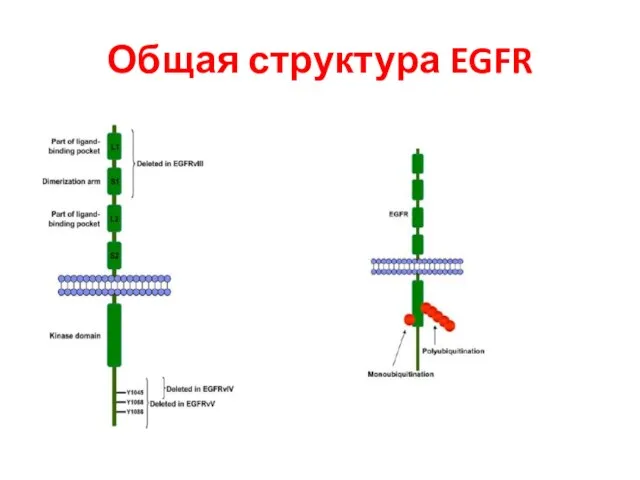
- 95. Общая структура EGFR
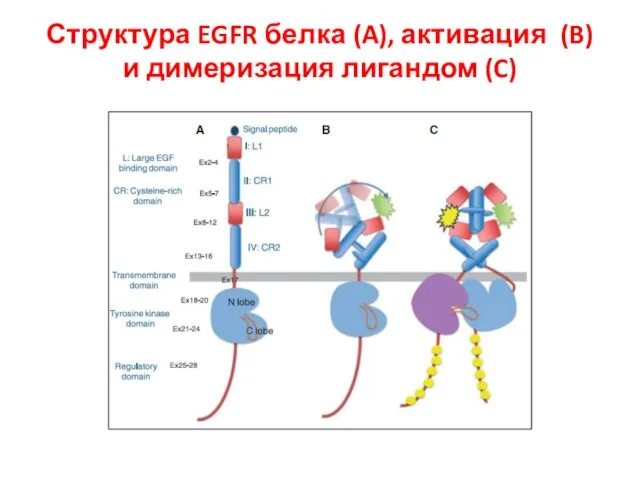
- 96. Структура EGFR белка (A), активация (B) и димеризация лигандом (C)
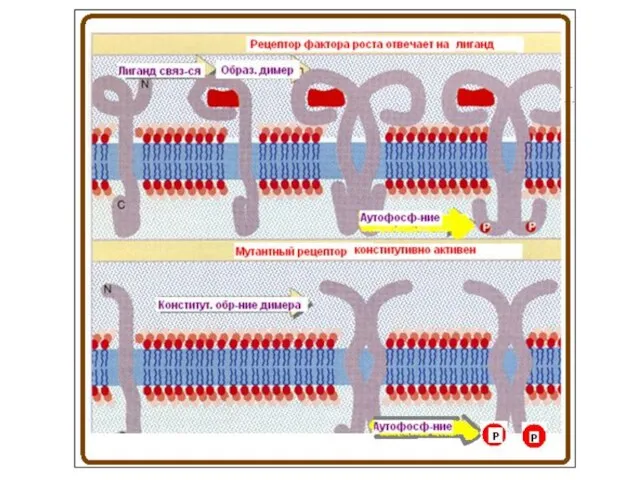
- 97. Лиганды для EGFR Идентифицировано 11 лигандов, которые разделены на 3 группы: 1.EGF, transforming growth factor-a, ампирегулин
- 98. Субстраты для EGFR Phospholipase Cg, CBL, GRB2, SHC и p85. Включая mitogen-activated protein kinase, phosphatidylinositol 3-kinase
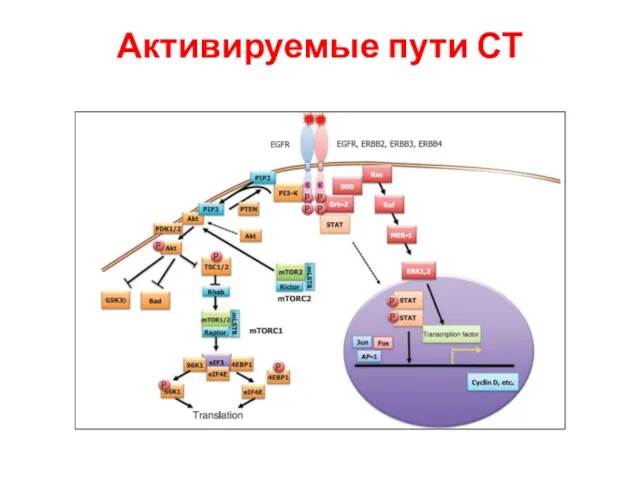
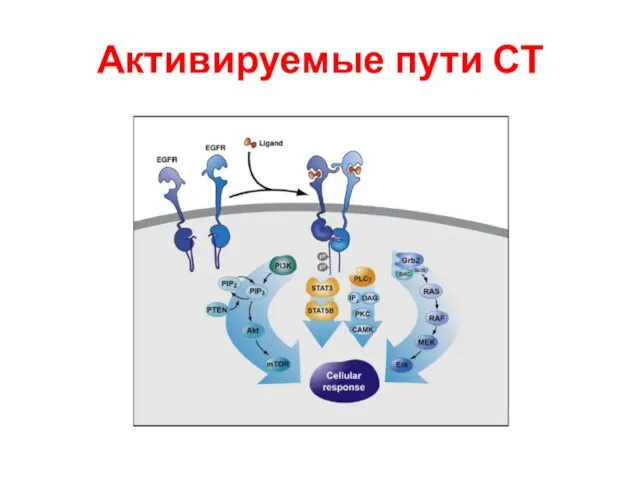
- 99. Активируемые пути СТ
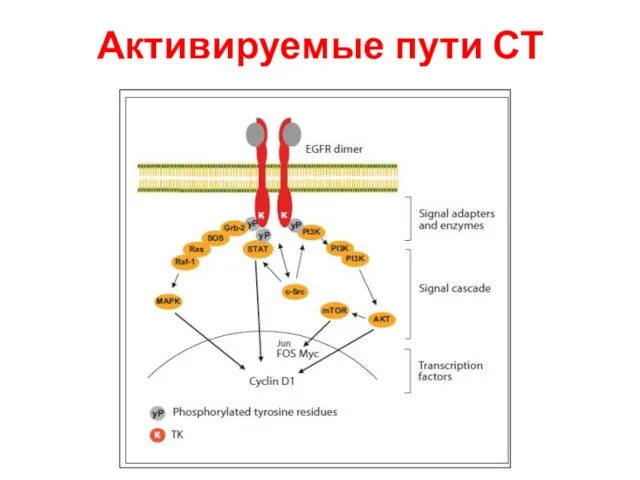
- 100. Активируемые пути СТ
- 101. Активируемые пути СТ
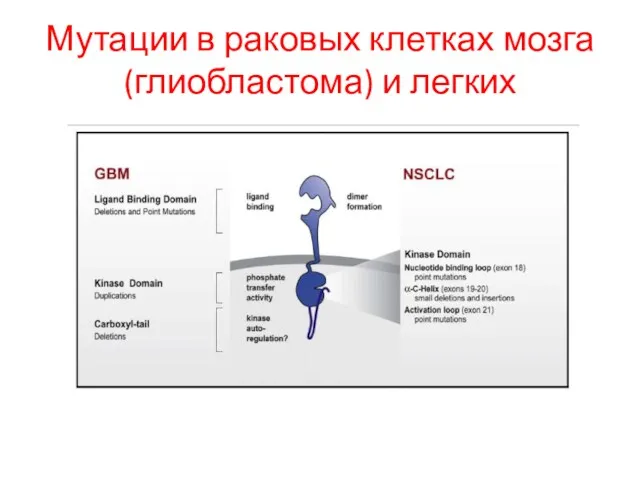
- 102. Мутации в раковых клетках мозга (глиобластома) и легких
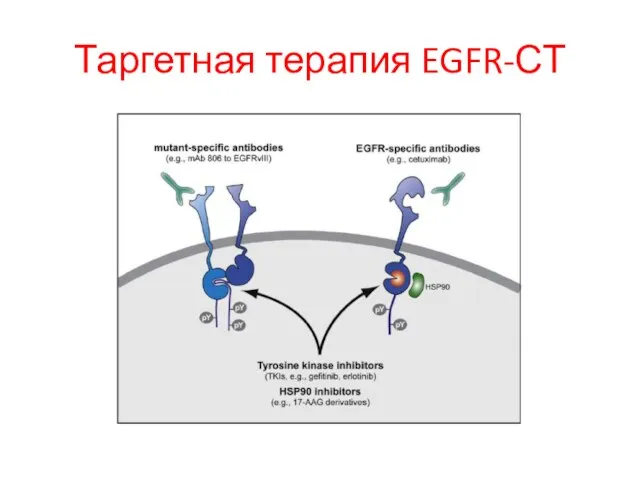
- 103. Таргетная терапия EGFR-СТ
- 104. EGFR и рак
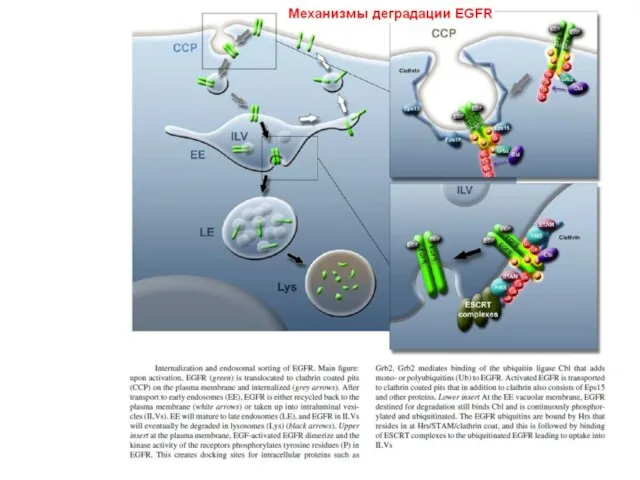
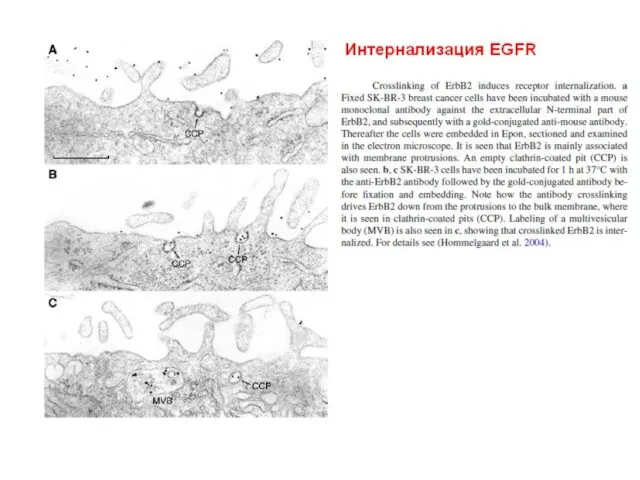
- 105. Down-регуляция EGFR
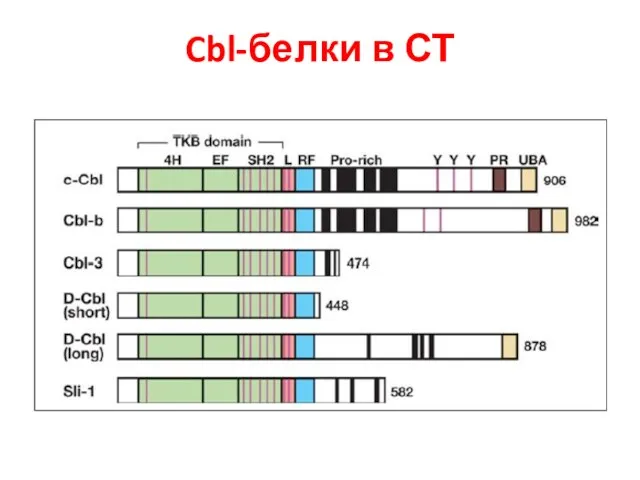
- 108. Cbl-белки в СТ
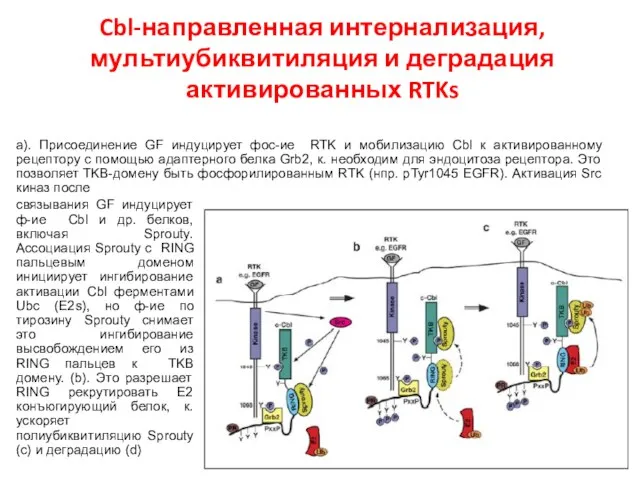
- 109. Cbl-направленная интернализация, мультиубиквитиляция и деградация активированных RTKs а). Присоединение GF индуцирует фос-ие RTK и мобилизацию Cbl
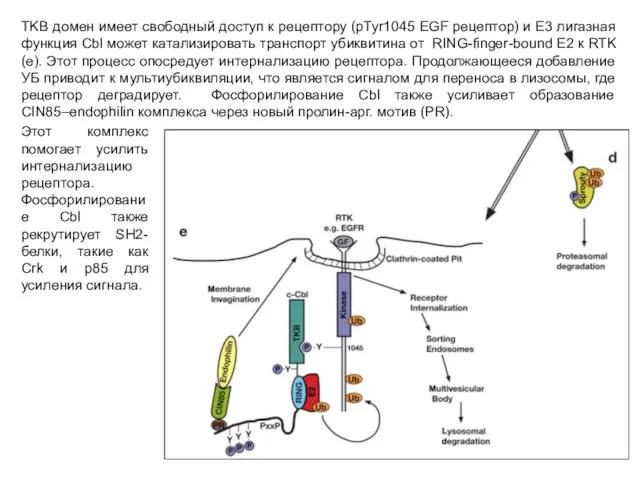
- 110. TKB домен имеет свободный доступ к рецептору (pTyr1045 EGF рецептор) и E3 лигазная функция Cbl может
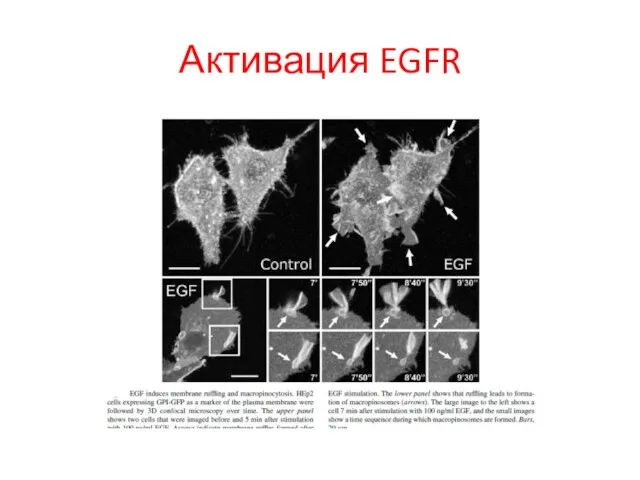
- 111. Активация EGFR
- 113. Скачать презентацию

































 Түбір өзектерін толтыруға арналған пломбалық жадығаттар.Жіктелуі, қолдану көрсеткіштері
Түбір өзектерін толтыруға арналған пломбалық жадығаттар.Жіктелуі, қолдану көрсеткіштері Патофизиология пищеварения
Патофизиология пищеварения Классификация эндокринных желез
Классификация эндокринных желез Регуляция менструального цикла
Регуляция менструального цикла Оказание первой помощи при спортивных травмах
Оказание первой помощи при спортивных травмах Оздоровительные базы, санатории (часть 2)
Оздоровительные базы, санатории (часть 2) Гигиенические требования к инфекционным стационарам
Гигиенические требования к инфекционным стационарам Angina Pectoris
Angina Pectoris Вирусные кишечные инфекции
Вирусные кишечные инфекции Лекция по питанию
Лекция по питанию Патронаж здорового новорожденного на дому с оформлением учебной амбулаторной карты
Патронаж здорового новорожденного на дому с оформлением учебной амбулаторной карты Антибиотиктермен емдеудің резистенттілігінің мәселелері және оның шешу жолдары
Антибиотиктермен емдеудің резистенттілігінің мәселелері және оның шешу жолдары Лабораторные методы диагностики вирусных болезней
Лабораторные методы диагностики вирусных болезней Асфиксии новорождённых
Асфиксии новорождённых Показания и противопоказания к лечебному массажу
Показания и противопоказания к лечебному массажу Рак предстательной железы
Рак предстательной железы Клиническая фармакология лекарственных средств, влияющих на гемостаз
Клиническая фармакология лекарственных средств, влияющих на гемостаз Көкрек және оның ағзаларының жарақаттары Кеуденің ауырып қалуы
Көкрек және оның ағзаларының жарақаттары Кеуденің ауырып қалуы Система здравоохранения в России
Система здравоохранения в России Балаларда периодонтиттерді емдеу ерекшеліктері
Балаларда периодонтиттерді емдеу ерекшеліктері Лейкозы у детей
Лейкозы у детей Ишемический колит
Ишемический колит Основы черпно-челюстнолицевой хирургии. Будущее специальности. Врожденные и приобретенные дефекты ЧЛО
Основы черпно-челюстнолицевой хирургии. Будущее специальности. Врожденные и приобретенные дефекты ЧЛО Очаговый туберкулез
Очаговый туберкулез Атрофические заболевания головного мозга. Болезнь альцгеймера. Болезнь пика
Атрофические заболевания головного мозга. Болезнь альцгеймера. Болезнь пика Ана және бала өлімін төмендету аспектісіндегі халық денсаулығын сақтау және нығайтудағы халықаралық тәжірибе
Ана және бала өлімін төмендету аспектісіндегі халық денсаулығын сақтау және нығайтудағы халықаралық тәжірибе Қоршаған орта мен тұрғындар денсаулығы үшін Қазақстан аймақтарындағы көп жылдық ядролық сынақтар салдары
Қоршаған орта мен тұрғындар денсаулығы үшін Қазақстан аймақтарындағы көп жылдық ядролық сынақтар салдары Инфекции мочевыводящих путей в амбулаторной прaктике на примере Республики Карелия: диагностика и лечение
Инфекции мочевыводящих путей в амбулаторной прaктике на примере Республики Карелия: диагностика и лечение