Содержание
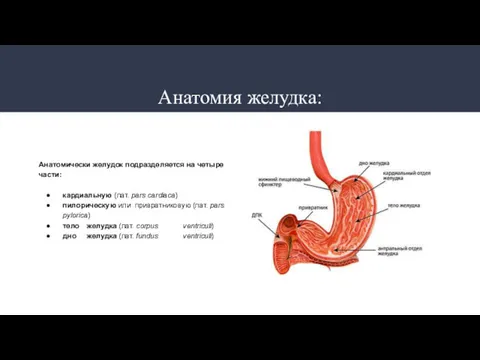
- 2. Анатомия желудка: Анатомически желудок подразделяется на четыре части: кардиальную (лат. pars cardiaca) пилорическую или привратниковую (лат.
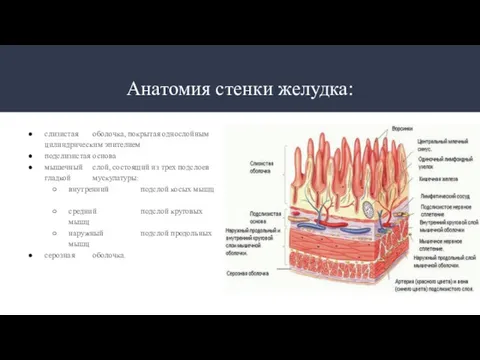
- 3. Анатомия стенки желудка: слизистая оболочка, покрытая однослойным цилиндрическим эпителием подслизистая основа мышечный слой, состоящий из трех
- 4. Определение: Рак желудка - это злокачественная опухоль из клеток эпителия слизистой оболочки желудка. Рак желудка остается
- 5. Факторы риска: Факторы: Helicobacter pylori желудочная инфекция. Пожилой возраст. Мужской пол. Диета с низким содержанием фруктов
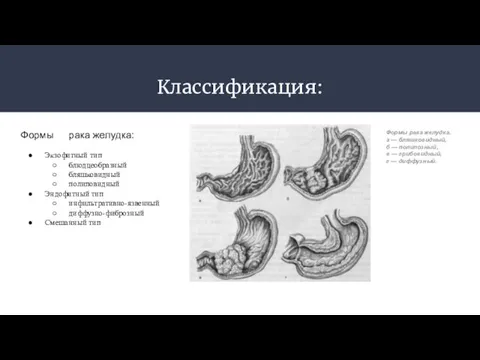
- 6. Классификация: Формы рака желудка: Экзофитный тип блюдцеобразный бляшковидный полиповидный Эндофитный тип инфильтративно-язвенный диффузно-фиброзный Смешанный тип Формы
- 7. Гистологические типы опухолей рака желудка Сегодня выделяют 6 основных гистологических типов опухолей: слизистый рак (он также
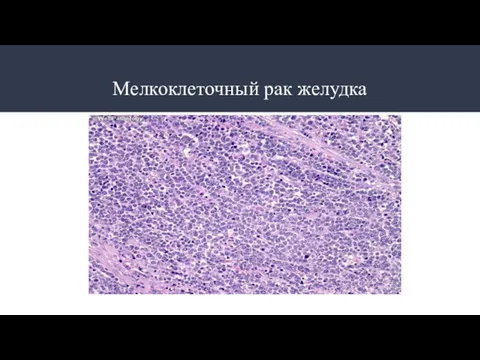
- 8. Мелкоклеточный рак желудка
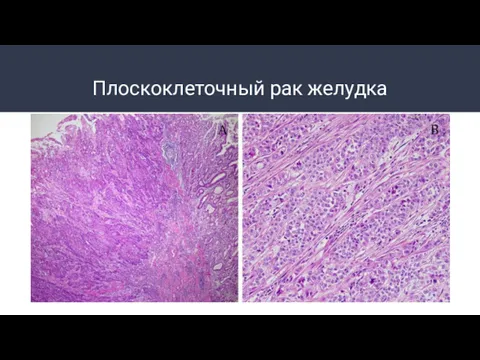
- 9. Плоскоклеточный рак желудка
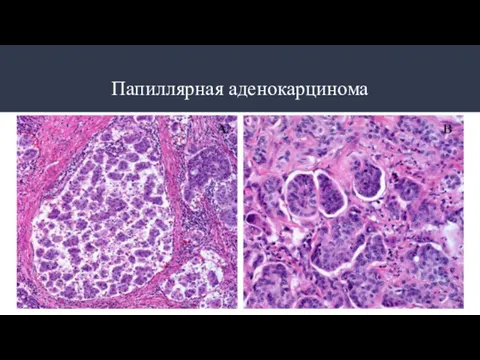
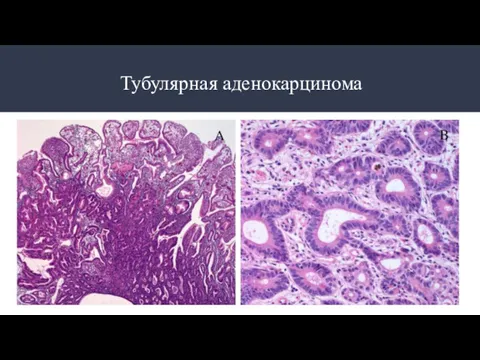
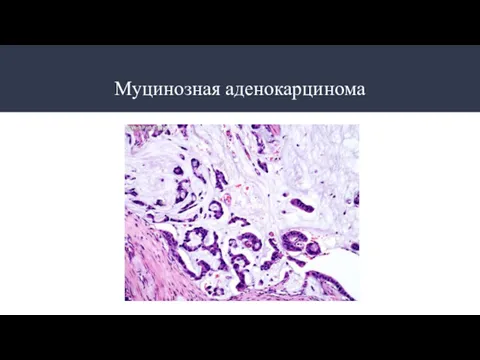
- 10. Типы аденокарцином: Разновидности аденокарцином: Папиллярная аденокарцинома Тубулярная аденокарцинома Муцинозная аденокарцинома Перстневидноклеточная аденокарцинома Аденомы по степени дифференцировки:
- 11. Папиллярная аденокарцинома
- 12. Тубулярная аденокарцинома
- 13. Муцинозная аденокарцинома
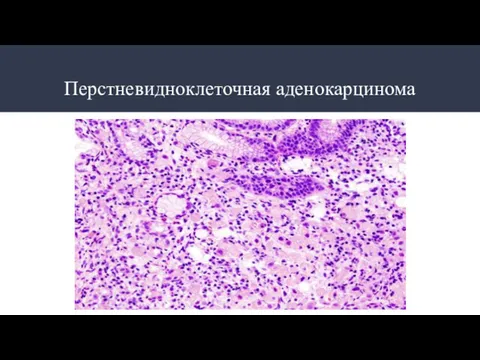
- 14. Перстневидноклеточная аденокарцинома
- 15. Классификация ТNM
- 16. Метастазирование Имплантационное метастазирование :Для рака желудка характерны метастазы в виде канцероматоза плевры, перикарда, диафрагмы, брюшины, сальника.
- 17. Клиническая картина и диагностика сбор жалоб ( местные - длительное время отсутствуют даже при большом размере
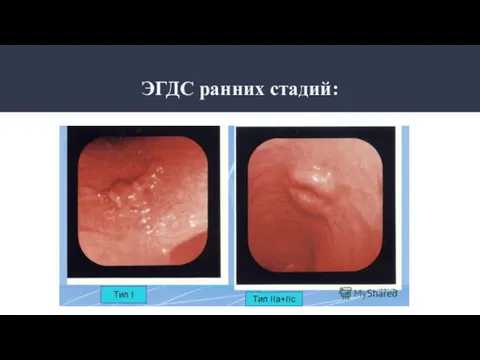
- 18. ЭГДС ранних стадий:
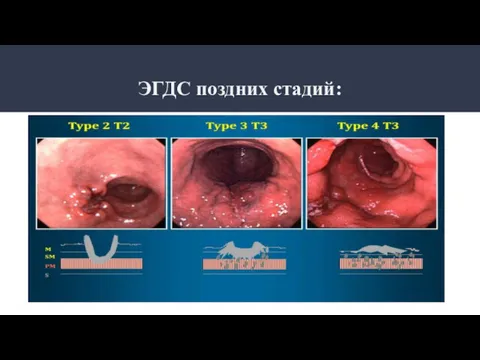
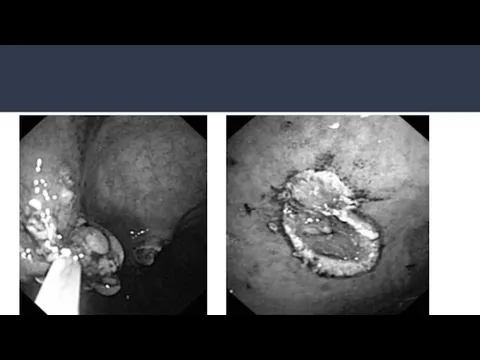
- 19. ЭГДС поздних стадий:
- 21. Эндо-УЗИ:
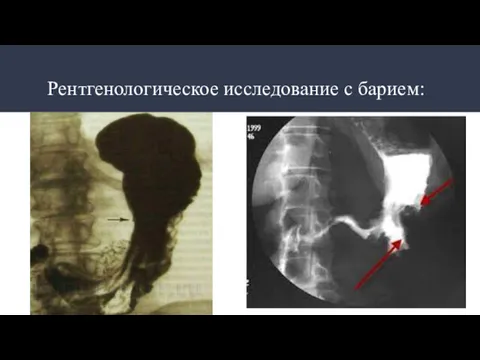
- 22. Рентгенологическое исследование с барием:
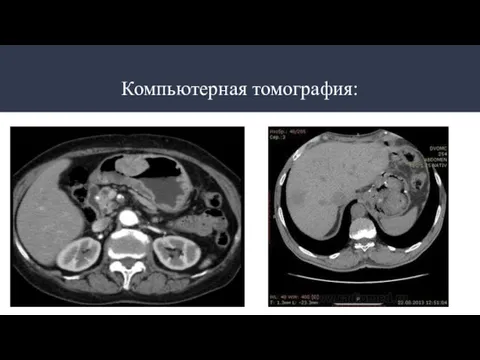
- 23. Компьютерная томография:
- 24. Хирургическое лечение : Радикальные: эндоскопическая резекция слизистой оболочки желудка (ЭРСО) эндоскопическая резекция слизистой оболочки с диссекцией
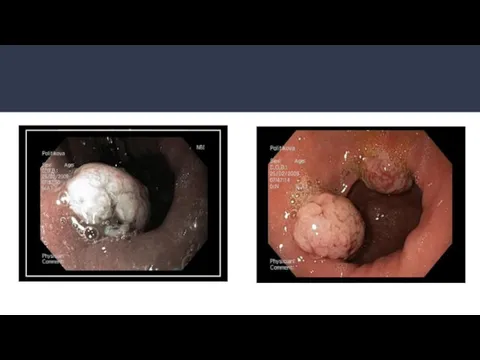
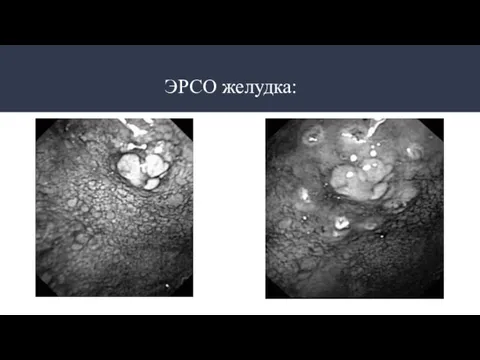
- 25. ЭРСО желудка (виды):
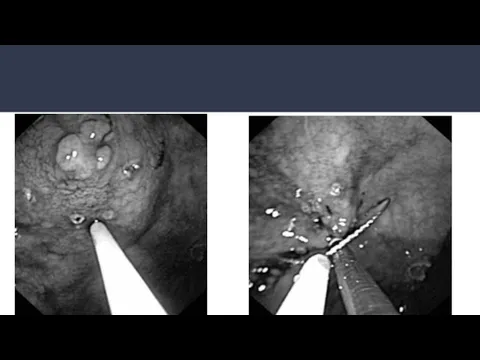
- 26. ЭРСО желудка:
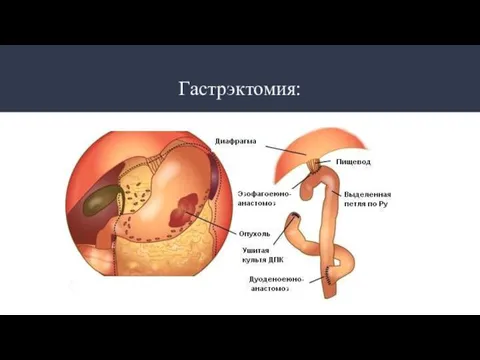
- 29. Гастрэктомия:
- 30. Уровни лимфодиссекций: Радикальность резекции желудка в настоящее время принято оценивать по обширности диссекции лимфатических узлов (от
- 31. Фрагмент Gastric Cancer: ESMO Clinical Practice Guidelines: “Surgical resection of gastric cancer, specifically at early stages,
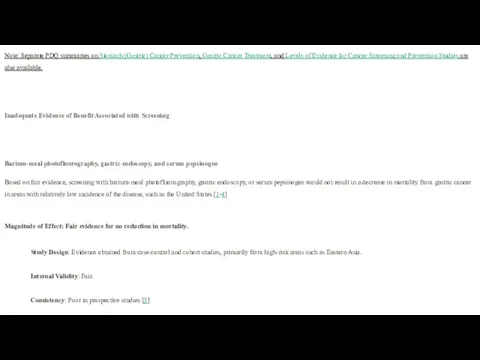
- 32. Stomach (Gastric) Cancer Screening (PDQ®)–Health Professional Version Overview: Inadequate Evidence of Benefit Associated with Screening, Barium-meal
- 34. Скачать презентацию












 Логопедические технологии
Логопедические технологии Введение в токсикологию
Введение в токсикологию Фермент. Ферменттерді ауруларды диагностикалауға және емдеуге қолдану
Фермент. Ферменттерді ауруларды диагностикалауға және емдеуге қолдану Халықтың радиациялық қауіпсіздігін қамтамасыз ету мен қоршаған ортаны
Халықтың радиациялық қауіпсіздігін қамтамасыз ету мен қоршаған ортаны Организация медико-социальной помощи
Организация медико-социальной помощи Микроорганизмдер экологиясы. Адам ағзасының микрофлорасы. Дисбактериоз
Микроорганизмдер экологиясы. Адам ағзасының микрофлорасы. Дисбактериоз Еріту. Сұйықтықтарды араластыру. Қатты заттарды және сұйықтықтарды бөліп алу
Еріту. Сұйықтықтарды араластыру. Қатты заттарды және сұйықтықтарды бөліп алу Санитарно-эпидемиологические требования к организациям, осуществляющим медицинскую деятельность
Санитарно-эпидемиологические требования к организациям, осуществляющим медицинскую деятельность Прогноз и реабилитация больных в современной детской хирургии
Прогноз и реабилитация больных в современной детской хирургии Периоперационная жидкостная терапия
Периоперационная жидкостная терапия Патології серця. Порушення провідності
Патології серця. Порушення провідності Вегетарианство - взгляд прогрессивного человека
Вегетарианство - взгляд прогрессивного человека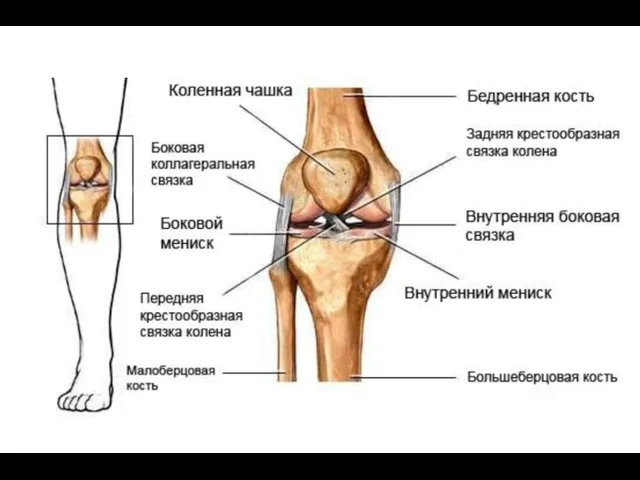 Коленный сустав
Коленный сустав Тактика лечения хронического тонзиллита
Тактика лечения хронического тонзиллита Үрпінің және еннің аномалиялары
Үрпінің және еннің аномалиялары Острый живот
Острый живот Иммунитеттің жасушалық жүйесі Т-лимфоциттер құрылысы, қызметтері Т- және В-лимфоциттердің негізгі белгілері
Иммунитеттің жасушалық жүйесі Т-лимфоциттер құрылысы, қызметтері Т- және В-лимфоциттердің негізгі белгілері Коматозні стани
Коматозні стани Основные виды шока
Основные виды шока Инсульт. Факторы риска инсульта
Инсульт. Факторы риска инсульта Малярия. Стадии развития малярийного плазмодия. (Лекция 12)
Малярия. Стадии развития малярийного плазмодия. (Лекция 12) Сосудистый шов
Сосудистый шов Перинатология, как наука
Перинатология, как наука Ефективність використання лфк у фізичній реабілітації при дифектах постави
Ефективність використання лфк у фізичній реабілітації при дифектах постави Мультисистемная атрофия. Оливопонтоцеребеллярная атрофия
Мультисистемная атрофия. Оливопонтоцеребеллярная атрофия Одонтогенді және одонтогенді емес қабыну аурулары
Одонтогенді және одонтогенді емес қабыну аурулары Основные синдромы при патологии дыхательной системы
Основные синдромы при патологии дыхательной системы Методы диагностики микобактерий туберкулеза
Методы диагностики микобактерий туберкулеза