Содержание
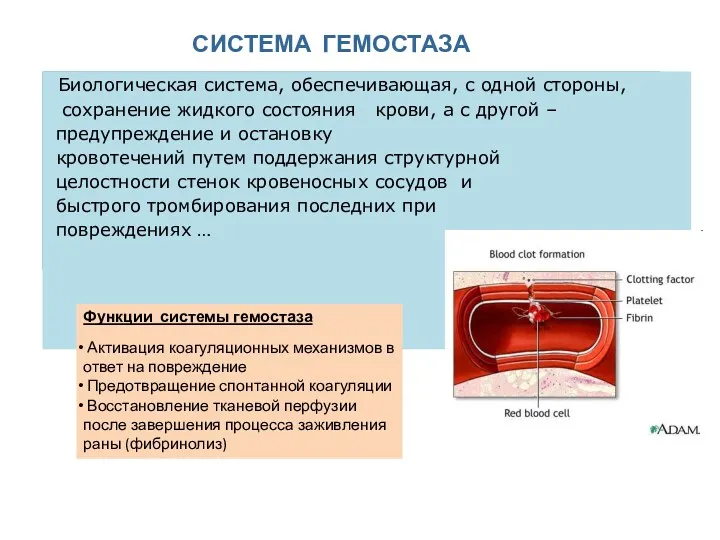
- 2. СИСТЕМА ГЕМОСТАЗА Биологическая система, обеспечивающая, с одной стороны, сохранение жидкого состояния крови, а с другой –
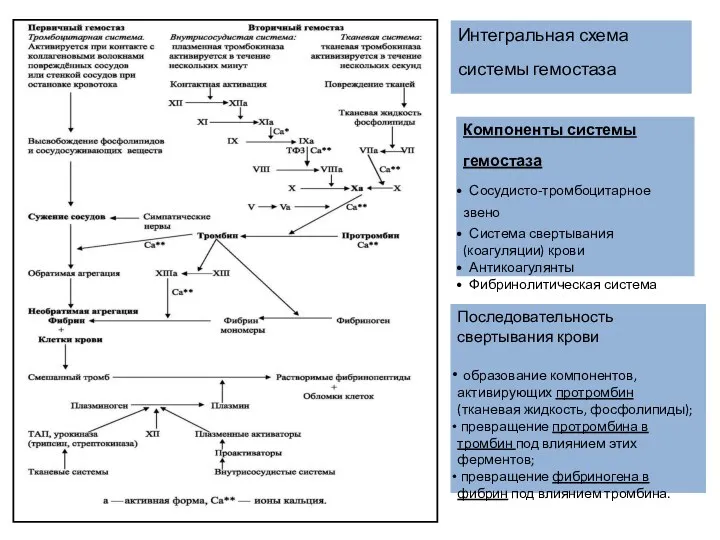
- 3. Интегральная схема системы гемостаза Последовательность свертывания крови образование компонентов, активирующих протромбин (тканевая жидкость, фосфолипиды); превращение протромбина
- 4. Свертывание крови может инициироваться в двух случаях: при разрушении ткани в результате воздействия на нее некоего
- 5. Физиологические механизмы свертывания крови В процессе свертывания крови сопряжены два физиологических механизма: клеточный и плазменный механизмы
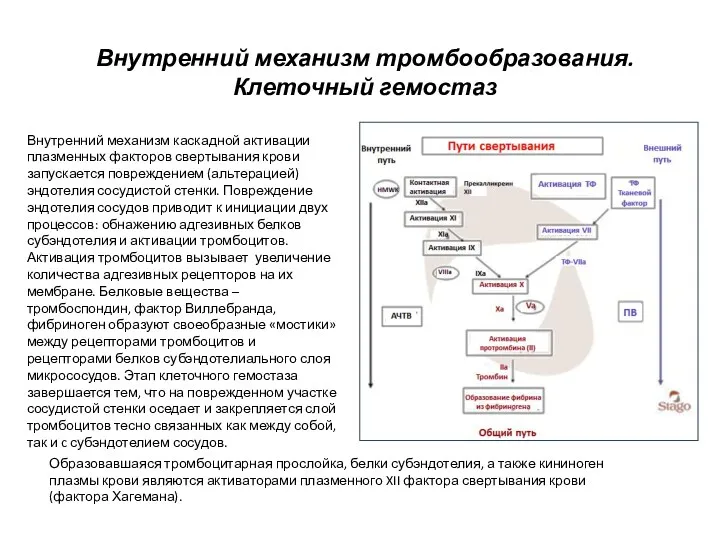
- 6. Внутренний механизм тромбообразования. Клеточный гемостаз Внутренний механизм каскадной активации плазменных факторов свертывания крови запускается повреждением (альтерацией)
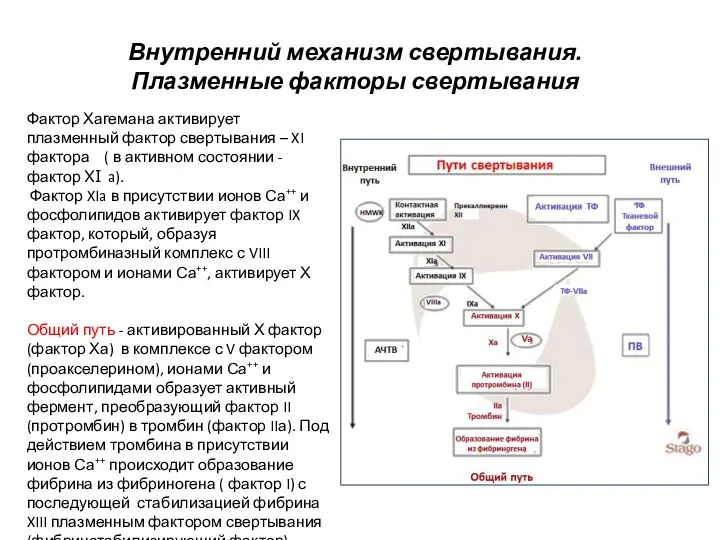
- 7. Внутренний механизм свертывания. Плазменные факторы свертывания Фактор Хагемана активирует плазменный фактор свертывания – XI фактора (
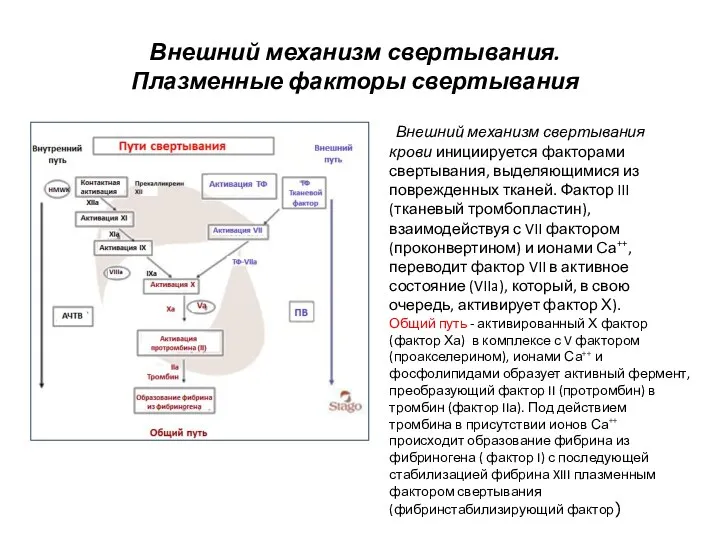
- 8. Внешний механизм свертывания. Плазменные факторы свертывания Внешний механизм свертывания крови инициируется факторами свертывания, выделяющимися из поврежденных
- 9. Модели активации системы гемостаза Классическая каскадная 3 фазы : первичная реакция, образование тромбина, образование фибрина Процесс
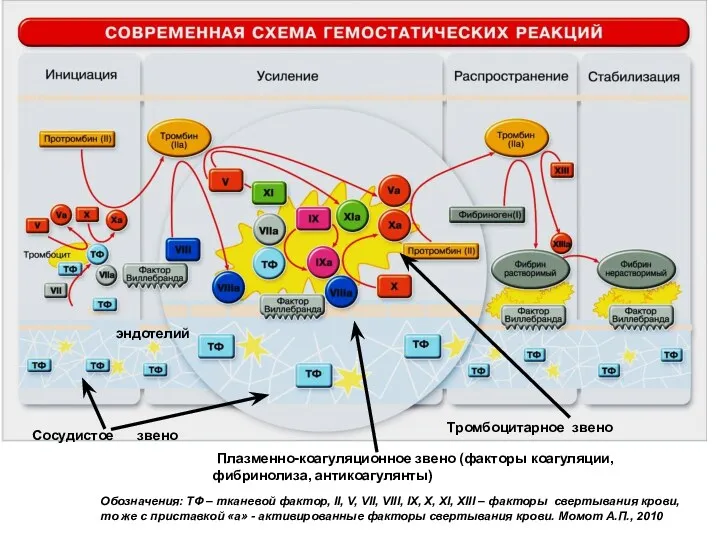
- 10. Сосудистое звено Тромбоцитарное звено Плазменно-коагуляционное звено (факторы коагуляции, фибринолиза, антикоагулянты) Обозначения: ТФ – тканевой фактор, II,
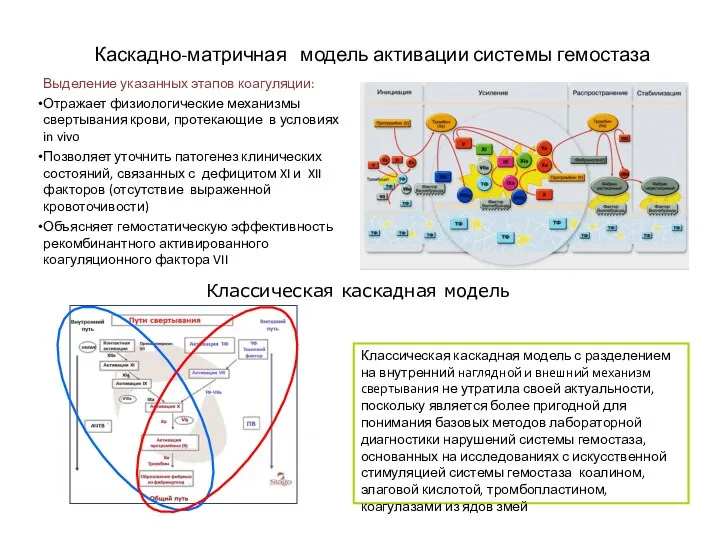
- 11. Каскадно-матричная модель активации системы гемостаза – путь активации тканевым фактором Инициация Характерно резкое увеличение количества VIIa
- 12. Каскадно-матричная модель активации системы гемостаза Выделение указанных этапов коагуляции: Отражает физиологические механизмы свертывания крови, протекающие в
- 13. Компоненты системы гемостаза Сосудисто-тромбоцитарное звено Сосудисто-тромбоцитарный гемостаз (первичный, временный) обеспечивает начальную остановку кровотечения в зоне микроциркуляции
- 14. Компоненты системы гемостаза Сосудистое звено Атромбогенность сосудистой стенки связана со способностью эндотелия : 1. Продуцировать простациклин.
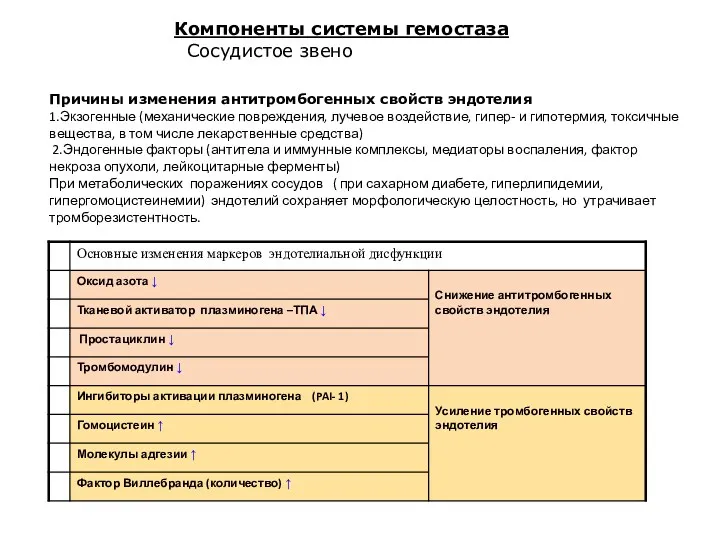
- 15. Компоненты системы гемостаза Сосудистое звено Причины изменения антитромбогенных свойств эндотелия 1.Экзогенные (механические повреждения, лучевое воздействие, гипер-
- 16. Компоненты системы гемостаза Тромбоцитарное звено Тромбоциты играют важную роль в первичном сосудисто-тромбоцитарном гемостазе и плазменных реакциях
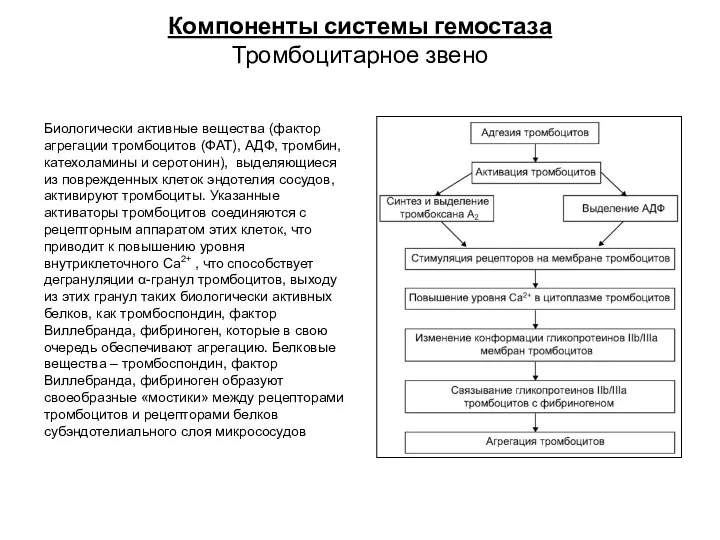
- 17. Компоненты системы гемостаза Тромбоцитарное звено Биологически активные вещества (фактор агрегации тромбоцитов (ФАТ), АДФ, тромбин, катехоламины и
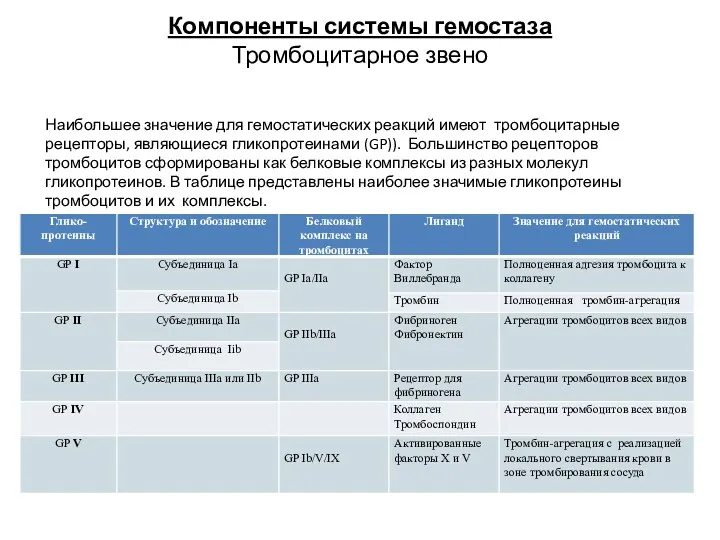
- 18. Компоненты системы гемостаза Тромбоцитарное звено Наибольшее значение для гемостатических реакций имеют тромбоцитарные рецепторы, являющиеся гликопротеинами (GP)).
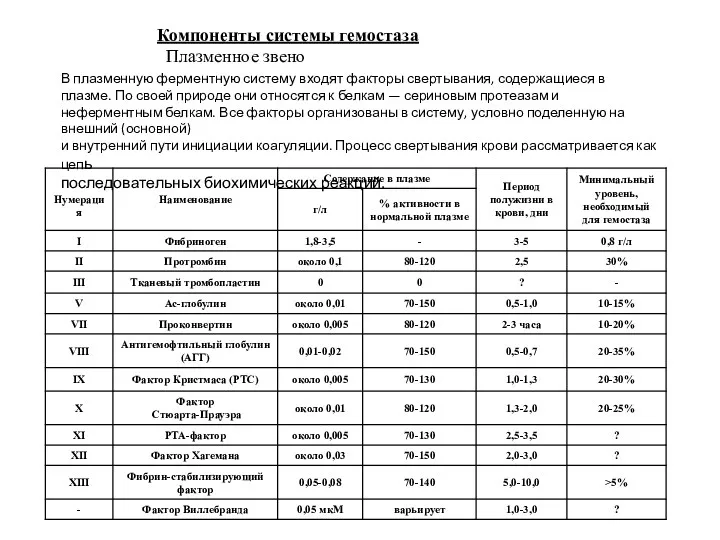
- 19. Компоненты системы гемостаза Плазменное звено В плазменную ферментную систему входят факторы свертывания, содержащиеся в плазме. По
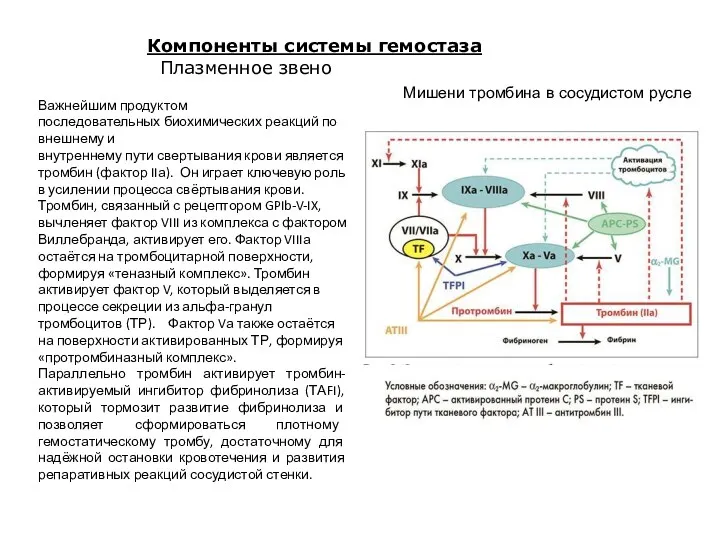
- 20. Мишени тромбина в сосудистом русле Важнейшим продуктом последовательных биохимических реакций по внешнему и внутреннему пути свертывания
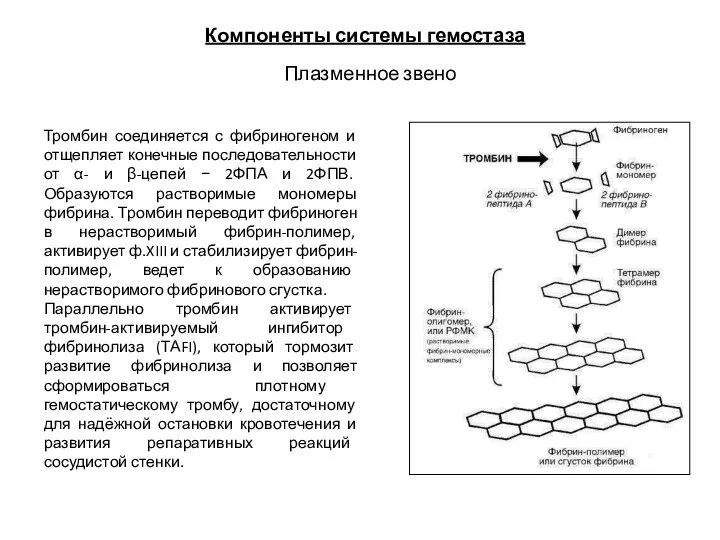
- 21. Компоненты системы гемостаза Плазменное звено Тромбин соединяется с фибриногеном и отщепляет конечные последовательности от α- и
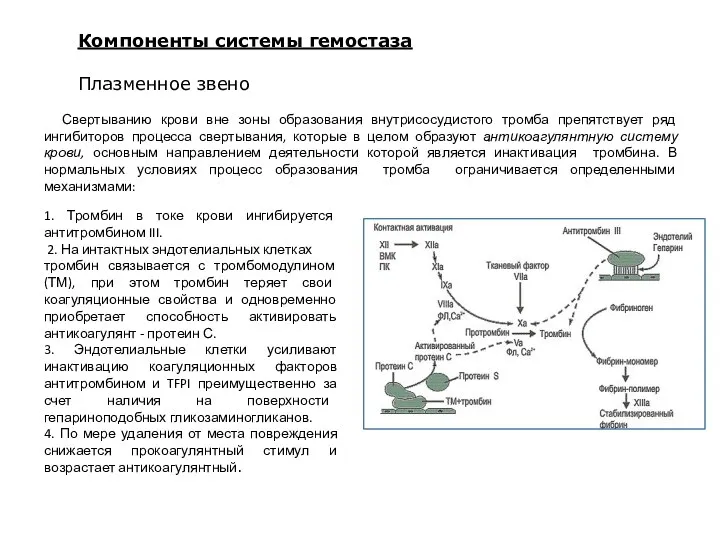
- 22. Свертыванию крови вне зоны образования внутрисосудистого тромба препятствует ряд ингибиторов процесса свертывания, которые в целом образуют
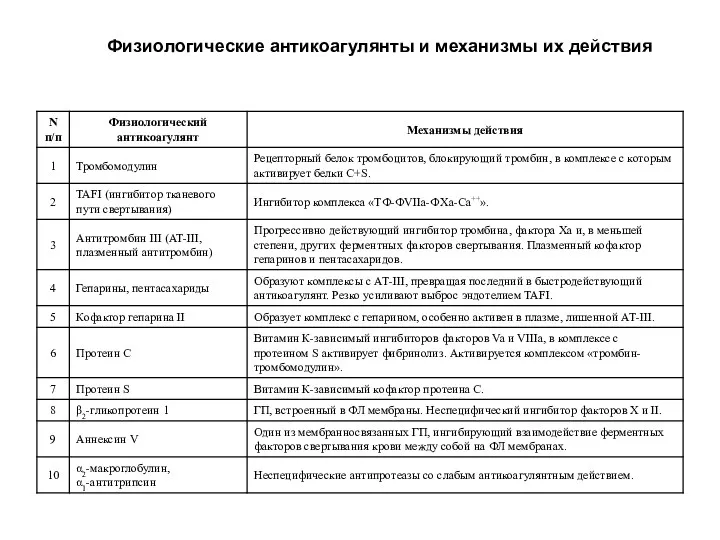
- 23. Физиологические антикоагулянты и механизмы их действия
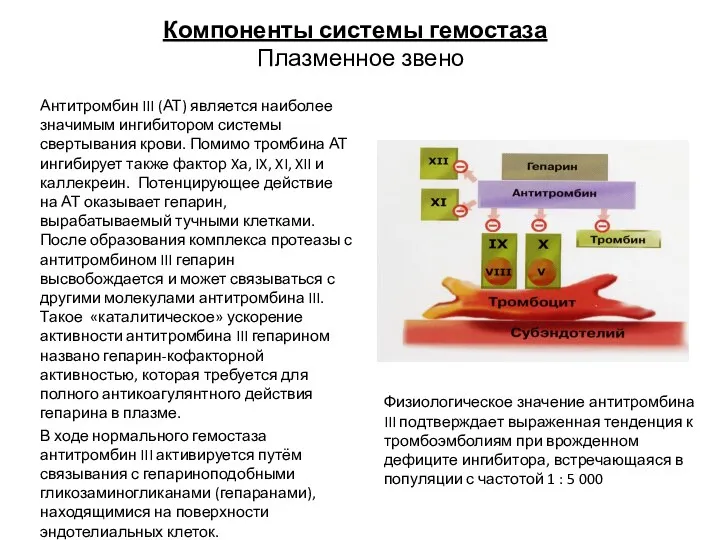
- 24. Компоненты системы гемостаза Плазменное звено Антитромбин III (АТ) является наиболее значимым ингибитором системы свертывания крови. Помимо
- 25. Система протеина С включает непосредственно сам протеин С и кофактор –протеин S. Другими компонентами являются мебранный
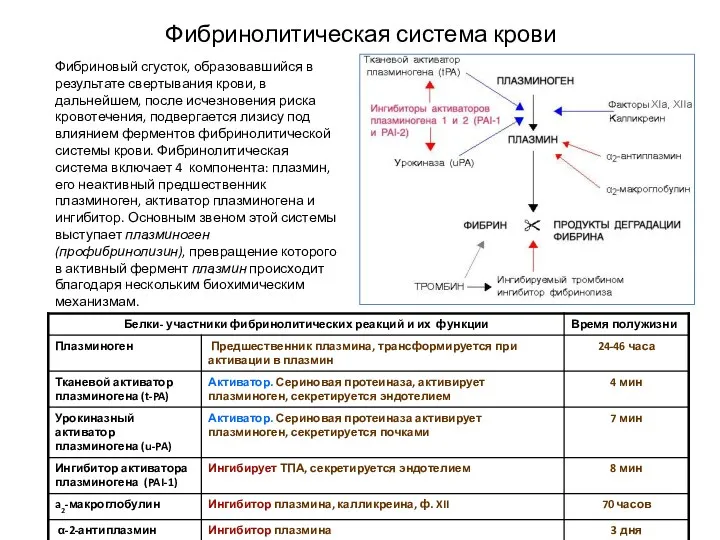
- 26. Фибринолитическая система крови Фибриновый сгусток, образовавшийся в результате свертывания крови, в дальнейшем, после исчезновения риска кровотечения,
- 27. Фибринолитическая система крови Плазминоген — профермент в плазме крови, обнаруживается в плаценте, сперме, миометрии, эндометрии. Синтезируется
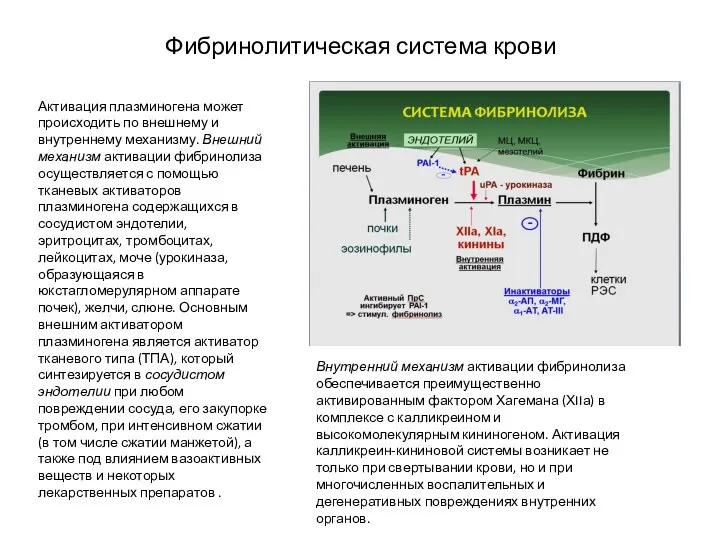
- 28. Фибринолитическая система крови Активация плазминогена может происходить по внешнему и внутреннему механизму. Внешний механизм активации фибринолиза
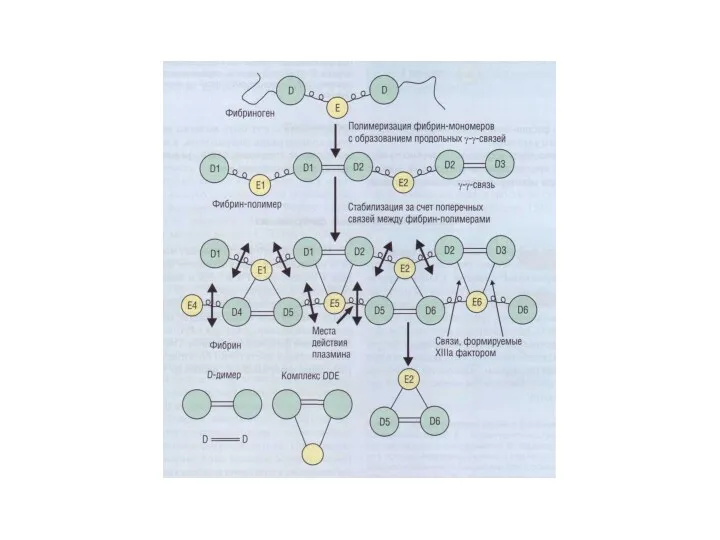
- 30. Фибринолитическая система крови Лизис фибринового сгустка Плазмин является очень активной и в то же время относительно
- 32. Скачать презентацию










 Сальмонеллез. Клиника. Лечение
Сальмонеллез. Клиника. Лечение Адгезивные системы
Адгезивные системы Снотворные, противоэпилептические и противопаркинсонические средства
Снотворные, противоэпилептические и противопаркинсонические средства Синдром Шерешевского-Тернера
Синдром Шерешевского-Тернера Особенности и схемы применения продуктов из серий Симбиотики РОЗ и фитопробиотики БиотикРОЗ
Особенности и схемы применения продуктов из серий Симбиотики РОЗ и фитопробиотики БиотикРОЗ Нефротический синдром
Нефротический синдром Увеальная меланома
Увеальная меланома Удаление аденоидов (операция аденотомия): показания, методы, проведение, послеоперационный период
Удаление аденоидов (операция аденотомия): показания, методы, проведение, послеоперационный период Гормоны коры надпочечников
Гормоны коры надпочечников Серологические реакции
Серологические реакции Дамыған және дамушы елдердегі медициналық сақтандыру
Дамыған және дамушы елдердегі медициналық сақтандыру Күйіктөр көзіндегі жедел жәрдем негідзері
Күйіктөр көзіндегі жедел жәрдем негідзері Кардиомиопатиялардың патологиялық анатомиясы. Нәтижесі, асқынуы, өлім себебі
Кардиомиопатиялардың патологиялық анатомиясы. Нәтижесі, асқынуы, өлім себебі Ахалазия пищевода
Ахалазия пищевода История развития Всероссийской службы медицины катастроф (ВСМК). Определение, задачи и основные принципы организации помощи
История развития Всероссийской службы медицины катастроф (ВСМК). Определение, задачи и основные принципы организации помощи Нарушения роста
Нарушения роста Клинико-лабораторные этапы изготовления металлокерамических коронок и мостовидных протезов
Клинико-лабораторные этапы изготовления металлокерамических коронок и мостовидных протезов Неврозы. Диагностика и лечение невроза
Неврозы. Диагностика и лечение невроза Лучевая диагностика заболеваний сердечно-сосудистой системы
Лучевая диагностика заболеваний сердечно-сосудистой системы Тұрғындардың табиғи қозғалысының анализі. Адам өлімінің медициналық критерийлері: моральді мәселелері мен перспективалары
Тұрғындардың табиғи қозғалысының анализі. Адам өлімінің медициналық критерийлері: моральді мәселелері мен перспективалары Виды нарушения осанки: лордоз, кифоз, сколиоз и другие, их влияние на здоровье и самочувствие детей
Виды нарушения осанки: лордоз, кифоз, сколиоз и другие, их влияние на здоровье и самочувствие детей Сравнительная характеристика средств, стимулирующих ЦНС. Психостимуляторы, ноотропы, адаптогены
Сравнительная характеристика средств, стимулирующих ЦНС. Психостимуляторы, ноотропы, адаптогены Расспрос, осмотр и иструментальные и лабораторные методы исследования желудочно-кишечного тракта
Расспрос, осмотр и иструментальные и лабораторные методы исследования желудочно-кишечного тракта Влагалищная родоразрешающая операция. Наложение вакуум-экстрактора
Влагалищная родоразрешающая операция. Наложение вакуум-экстрактора Центральная линия в/ч смещена вправо
Центральная линия в/ч смещена вправо Чума. Источники инфекции
Чума. Источники инфекции Понятие об инфекционном процессе и инфекционных болезнях
Понятие об инфекционном процессе и инфекционных болезнях Мастит
Мастит